Лихорадка Ку
Лихорадка Ку – инфекционная болезнь человека и животных с природной очаговостью. Характеризуется отсутствием сыпи и первичного аффекта (свойственного другим эндемичным риккетсиозам), множественностью путей передачи возбудителя, практически повсеместным распространением и рядом других своеобразных черт.

Этиология
Возбудитель лихорадки Ку – Coxiella burneti (Philip 1943, 1948) или риккетсия Бернета – мельчайшие полиморфные микроорганизмы, выявляемые в световом микроскопе с помощью специальных методов окраски (Романовского-Гимзы, Здродовского-Маккиавелло, Гименец) в виде кокков, палочек, биполярных и нитевидных форм, иногда образующих цепочки.
Риккетсии Бернета – внутриклеточные паразиты. Выращивание их на обычных питательных средах не удается; риккетсии развиваются только на живых тканевых субстратах или в средах, содержащих переживающие ткани. Они хорошо размножаются в тканях желточного мешка куриных зародышей, в организме белых мышей (особенно в селезенке) и других чувствительных лабораторных животных (морские свинки, хлопковые крысы, кролики), в различных первичных и перевиваемых тканевых культурах.
Размножение коксиелл происходит в цитоплазме клеток, не затрагивая ядра, с образованием разнообразных по размерам вакуолей, в которых риккетсии находятся в состоянии броуновского движения. В отличие от других риккетсий С. burneti свойственна так называемая фазовая изменчивость, связанная с условиями культивирования микроорганизмов. Культуры риккетсий Бернета, выделенные от больных людей и животных, от клещей и грызунов до адаптации их к куриным эмбрионам находятся в так называемой первой фазе. По мере пассирования на куриных эмбрионах осуществляется их переход во вторую фазу.
Этот переход сопровождается изменением антигенной структуры риккетсий, их иммуногенных и вирулентных свойств равно как величины и субмикроскопического строения микробной клетки. Фазовые различия коксиелл должны учитываться при' проведении диагностических и эпидемиологических исследований.
Риккетсии Бернета, в отличие от других видов риккетсий,. малоустойчивых к воздействию неблагоприятных физических или химических факторов, обладают выраженной резистентностью. Они длительно сохраняют жизнеспособность вне организма как в высушенном состоянии, так и во влажной среде. В высохшей моче инфицированных животных риккетсии выживают в течение ряда недель, в фекалиях клещей – многие месяцы, в стерильной воде – не менее 160 дней, в стерильном молоке – 275 дней, в свежем мясе при хранении его в холодильнике – не менее 30 дней, а в засоленном мясе – до 90 дней и более. Часовое нагревание до 80-90° не обеспечивает безусловной гибели риккетсий Бернета, а кипячение убивает их в течение одной минуты.
Распространенность
Заболевания лихорадкой Ку людей или природные очаги этой инфекции выявлены на всех континентах. Отсутствие сведений по отдельным странам обусловлено, можно полагать, малой их изученностью в отношении данного риккетсиоза.
В СССР наличие лихорадки Ку впервые установлено в Средне-Азиатских республиках в 1950-1952 гг. (И. А. Шифрин, Н. И. Ходукин, М. П. Чумаков и др.). В дальнейшем природные очаги этой инфекции обнаружены на территории Северного Кавказа, в Закавказье, Башкирии, на Украине, в Белоруссии, на Северо-Западе РСФСР, в Заполярье и в ряде других районов. Кроме того во многих местностях нашей страны, в том числе в Центральной России, имели место одиночные и групповые заболевания завозного происхождения.
Клинические черты
Люди в любом возрасте восприимчивы к риккетсиям Бернета. Заболевание начинается остро после инкубационного периода недельной, реже – большей продолжительности. Лихорадка (постоянного типа или ремиттирующая) длится от нескольких дней до двух недель. В отдельных случаях она принимает затяжной характер и продолжается в течение ряда месяцев. Снижение температуры до нормы происходит обычно в виде ускоренного лизиса.
Лихорадочное состояние сопровождается сильной головной и. мышечными болями (в особенности в нижних конечностях), некоторой адинамией, утратой аппетита; могут наблюдаться тошнота и рвота; характерным является увеличение печени и селезенки. Со стороны сердечно-сосудистой системы отмечаются
брадикардия и понижение артериального давления. При гематологическом обследовании больных определяется лейкопения или количество лейкоцитов оказывается в пределах нижней границы нормы. Лейкоцитарная формула характеризуется сдвигом влево; может иметь место относительный лимфоцитоз и реже – умеренный нейтрофильный лейкоцитоз. РОЭ ускорена или в пределах нормы.
При проникновении возбудителя через верхние дыхательные пути возникают бронхиты, а также острая или подострая бронхопневмония, довольно тяжело протекающая и сопровождающаяся болями в груди, одышкой, сухим кашлем. Согласно данным Е. Н. Бартошевич (1957), пневмония при лихорадке Ку регистрируется в 12-28%. У некоторых больных возникают поражения центральной или периферической нервной системы (явления энцефалита, менингита, невриты, радикулиты).
Иногда наблюдаются субфебрильные формы, характеризующиеся лишь легким недомоганием, а также бессимптомное течение инфекции. Болезнь в общем протекает доброкачественно: смертельные исходы очень редки.
В плане сравнительного распознавания надо иметь в виду грипп, брюшной тиф, паратиф, бруцеллез, болезнь Брилля, равно как болезни, для которых характерны рецидивы лихорадки (лептоспирозы, туляремия, малярия и др.). Дифференциальную диагностику следует проводить комплексно, основываясь на данных клиники, эпидемиологических материалах и результатах лабораторного обследования больных.
Эпидемиология
Эпидемиологические особенности Ку-риккетсиоза как инфекции с природной очаговостью в значительной мере определяются своеобразными чертами биологии и экологии ее возбудителя. В обобщенном виде эти особенности могут быть сформулированы следующими положениями:
1. Возбудитель болезни характеризуется полиадаптированностью. В природных очагах инфекции в СССР, например, оказались зараженными риккетсиями Бернета многие виды грызунов и другие дикие и полудикие млекопитающие (антилопы-джейраны, олени), а также некоторые виды птиц. Возбудитель обнаружен также у 32 видов и подвидов иксодовых клещей, 6 видов аргасовых и 4 видов гамазовых клещей, в организме которых риккетсии Бернета длительно сохраняются в вирулентной форме. Инфицированные клещи передают риккетсии по ходу постэмбрионального развития и трансовариально своему потомству; они выделяют риккетсии со слюнным секретом, испражнениями, коксальной жидкостью.
Выраженная биологическая пластичность С. burneti способствует поддержанию циркуляции возбудителя в природных очагах, отличающихся стойкостью, и вовлечению в цепь циркуляции возбудителя широкого круга позвоночных и беспозвоночных животных. Вместе с тем, в зависимости от степени чувствительности этих животных к возбудителю, их численности, особенностей экологии и ряда других факторов, лишь некоторые из возможных носителей риккетсий выступают в качестве основных резервуаров и переносчиков. Виды их неодинаковы в различных природных очагах.
2. В связи с первичными природными очагами Ку-риккетсиоза могут возникать вторичные – антропоургические (или хозяйственные) – среди сельскохозяйственных и домашних животных. Они имеют большое эпидемиологическое значение. Нападая для кровососания на мелкий и крупный рогатый скот во время пастбищного сезона, а также лошадей, собак и других животных зараженные клещи инфицируют их. Ку-риккетсиоз часто протекает у крупного и мелкого рогатого скота как латентная инфекция, которая обостряется под влиянием беременности и родов. Животные длительно выделяют возбудитель с молоком, мочой, фекалиями, становясь тем самым самостоятельным источником заразного начала. Особенно заразительны околоплодная жидкость и плацента. Антропоургические очаги лихорадки Ку распространены значительно шире природных и ответственны практически за всю заболеваемость людей этой формой. Возможно также возникновение новых очагов Ку-риккетсиоза в природе с развитием их из антропоургических благодаря иррадиации возбудителя в естественные биоценозы.
Природные очаги Ky-риккетсиоза имеют свои отличительные особенности, обусловленные структурой биоценозов определенной географической зоны и, в частности, составом кровососущих клещей различных экологических групп и их связей с позвоночными. Различают следующие зональные типы природных очагов Ky-риккетсиоза: пустынный, полупустынный, степной, лесостепной, лесной и низкогорный (3. М. Жмаева и соавт., 1959; Б. Е. Карулин, 1960; А. Б. Дайтер, 1962; Н. И. Кереев, 1965). Характеристика типов очагов представлена в сводке Ю. С. Балашова и А. Б. Дайтера (1973).
3. Устойчивость риккетсий Бернета во внешней среде обусловливает транспортируемость их на любые расстояния и создает предпосылки возникновения спорадических и групповых заболеваний Ky-лихорадкой в местностях, весьма отдаленных от энзоотических районов. Вспышки завозного характера, по данным ряда отечественных авторов, имели место на текстильных предприятиях, на ковровоплюшевом и прядильнониточном комбинатах и на предприятиях кожевенной и меховой промышленности.
Ку-риккетсиоз характеризуется множественностью источников (сельскохозяйственные и домашние животные, грызуны, клещи и т. д.) и факторов передачи инфекции (молоко, мясо, вода, шкуры, хлопок, солома и др.), равно как и разнообразием путей передачи заразного начала: аспирационный, алиментарный, контактный, трансмиссивный. В связи с тем, что инфицирование людей с наибольшей частотой происходит прямо или опосредованно от сельскохозяйственных животных, ведущее значение имеет аспирационный и алиментарный пути заражения. Больные люди практически не контагиозны.
Риккетсии Бернета проникают в организм человека: а) через поврежденную кожу или слизистые оболочки глаза (при уходе за животными, разделке туш, обработке сырья животного происхождения и т. п.); б) через желудочно-кишечный тракт (главным образом, в результате употребления молока и молочных продуктов, не подвергнутых кипячению, реже – загрязненной воды, овощей и пр.); в) через воздух (в результате аспирации пылевых частиц, содержащих риккетсии Бернета, например, при работе с шерстью, соломой и т. п.).
Есть единичные указания на заражения также при купании в водоемах, загрязненных выделениями больных животных; не исключена, кроме того, возможность возникновения случаев лихорадки Ку в связи с нападением на людей инфицированных клещей.
Заболевания Ky-лихорадкой могут возникать в течение круглого года; увеличение их числа отмечается в весенне-летние месяцы, что обычно связано с сезоном окота и отела рогатого скота.
Среди взрослых чаще заболевают лица «угрожаемых» профессий (К. Н. Токаревич, 1969). В сельских местностях это — сельскохозяйственные рабочие, пастухи, чабаны, доярки, зоотехнический и ветеринарный персонал. В городах заболевания возникают преимущественно среди рабочих шерстеобрабатывающих, меховых и хлопкопрядильных фабрик. Могут наблюдаться заболевания и на различных других производствах в связи с применением в них отходов хлопка или иного сырья, например, в качестве обтирочного или оберточного материала.
Противоэпидемические и профилактические мероприятия
Проведение профилактических мероприятий в отношении Ку-лихорадки тесно связано с установлением местных ее очагов (К. Н. Токаревич, 1969). Решение этой задачи может быть обеспечено выяснением источников и путей заражения как при групповых заболеваниях, так и в каждом отдельном случае.
Современная эпидобстановка в отношении Ку-риккетсиоза обязывает:
- Обеспечивать активное выявление больных среди лихорадящих с неподтвержденным лабораторно диагнозом путем серологического обследования с антигеном из риккетсий Бернета, обращая первоочередное внимание на лиц с нетипичным течением пневмоний с затяжными бронхитами, с подозрением на вышеупомянутые инфекционные формы, как важные в плане дифференциальной диагностики. При этом кроме клинической картины следует принимать во внимание данные эпиданамнеза.
- Проводить активную эпидразведку с использованием иммунологических методов исследования среди рабочих «угрожаемых» профессий кожевенных, хлопкообрабатывающих предприятий, меховых фабрик, мясо- и молококомбинатов, сельскохозяйственных рабочих, а также зоотехнического и ветеринарного персонала.
- Организовать серологическое обследование мелкого и крупного рогатого скота, а также кроликов (если имеются кролиководческие хозяйства) для решения вопроса о зараженности животных и возможности существования очагов Ку-риккетсиоза хозяйственного характера.
- Для обнаружения очагов лихорадки Ку в природе и уточнения путей циркуляции возбудителя в конкретных условиях той или иной местности исследовать грызунов и кровососущих клещей. Работы по выявлению и изучению природных и хозяйственных очагов Ку-риккетсиоза целесообразно проводить комплексно с участием медицинских и ветеринарных специалистов, зоологов и паразитологов.
Наличие, широта и множественность очагов Ку-риккетсиоза определяют содержание и размеры профилактических и противоэпидемических мероприятий.
Обнаружение инфицированных сельскохозяйственных животных влечет за собой обособленное содержание от основного стада положительно реагирующего крупного рогатого скота и изоляцию зараженных отар овец и коз. Необходимо запрещать вывоз скота из районов, энзоотичных по Ку-риккетсиозу.
Мероприятия, ограничивающие распространение возбудителя, и дезинфекция должны особенно тщательно осуществляться на мясокомбинатах и молочных заводах, на предприятиях, перерабатывающих различное сырье животного происхождения. Большое значение имеют общие мероприятия санитарно-гигиенического порядка и санитарно-просветительная работа среди населения.
Перенесение лихорадки Ку создает невосприимчивость к инфекции. В числе профилактических мероприятий предложен метод активной иммунизации людей, подвергающихся опасности заражения, однократным накожным применением живой вакцины из риккетсий Бернета штамма М-44 (В. А. Гениг, 1965).
Микробиологические исследования прямым подтверждением инфицирования риккетсиями Бернета или носительства является выделение возбудителя.
Лабораторная диагностика
Микробиологические исследования
С этой целью проводят комплекс исследований микробиологического характера, включающих в себя:
1) постановку биологических проб; 2) изучение биопроб микроскопическими, серологическими и бактериологическими методами; 3) инокуляцию и инкубирование развивающихся куриных эмбрионов; 4) идентификацию выделенной культуры микроорганизмов.
В качестве исходного материала для исследования с наибольшей частотой при обследовании больных служат кровь, моча, спинномозговая жидкость, мокрота, при обследовании крупного и мелкого рогатого скота – кровь, молоко, молозиво, плацента, органы абортированных плодов; при изучении грызунов и других диких мелких млекопитающих – селезенка, печень, почки. Органы грызунов, кусочки плаценты и органы сельскохозяйственных животных до исследования могут сохраняться в 50% глицерине при 4° в течение длительного времени. При исследовании кровососущих клещей или насекомых используют тотальные суспензии из членистоногих определенного вида, или отпрепарированные внутренние органы (кишечник).
Выделение возбудителя от больных удается легче на высоте лихорадки, однако оно возможно и в период реконвалесценции даже при наличии специфических антител.
В качестве подопытных животных обычно используют морских свинок (250-300 г) и белых мышей (12-14 г), которым инокулируют испытуемый материал внутрибрюшинно; морским свинкам можно вводить до 3-5 мл, белым мышам – 0,5-1,0 мл. Кровь вводят дефибринированную или взвесь из сгустка в физиологическом растворе (сыворотка, отделенная от сгустка, может быть использована для серологического исследования).
Органы грызунов, кусочки плаценты, органы абортированных плодов, а также членистоногих растирают в ступке со стерильным песком и добавляют физиологический раствор; после отстаивания или 10-минутного центрифугирования при 1000 об/мин надосадочную жидкость вводят животным.
Эмульсии из органов грызунов при массовом обследовании могут быть приготовлены от группы животных (до 10 шт.) одного вида и места отлова. Членистоногие могут быть также сгруппированы по видовой принадлежности и месту сбора (не более 20 экз. на пробу, в зависимости от размера особей, фазы развития и степени насыщения).
До растирания органы животных, если они хранились в глицерине, отмывают многократным промыванием в стерильном физиологическом растворе. Клещей и других кровососущих членистоногих до эмульгирования обрабатывают промыванием в 70° спирте и до трех раз – в стерильном физиологическом растворе (до этого целесообразно удалить у клещей конечности, а у летающих насекомых и крылья).
Голодных клещей, собранных в природе, можно кроме того исследовать путем подсадки для кормления на морских свинок или белых мышей, которых подвергают дальнейшему исследованию. Для этого, в случае кормления иксодовых клещей, на выстриженный участок спинки животного наклеивают бязевый мешочек, в который и помещают испытуемых иксодид. Для предохранения клещей от повреждения зверьком в процессе питания, подопытным животным одевают картонный воротничок. Животных рассаживают в банки, принимая меры предосторожности от возможного расползания клещей.
При необходимости кормления быстрососущих видов (например, клещи орнитодорины) членистоногих подсаживают в кормушку на выстриженный участок брюшка животного, закрепленного в станочке. Более подробно техника подготовки животных для целей кормления изложена в специальных работах по паразитологии и в соответствующих методических пособиях.
У подопытных морских свинок в результате внутрибрюшинного или подкожного введения исходного инфицированного материала или успешного заражения путем кормления клещей примерно через недельный срок инкубации обычно развивается лихорадка (до 40-41°), продолжающаяся 5-7 дней, иногда с повторными подъемами температуры.
Риккетсии Бернета в большом количестве накапливаются в селезенке, печени и других органах. Отдельные штаммы возбудителя вызывают смертельные заболевания. В некоторых случаях инфекция у морских свинок может не сопровождаться подъемом температуры; об их инфицированности судят по результатам серологических реакций с кровью, взятой на 21-30-й день после введения испытуемого материала.
У белых мышей инфекция протекает, как правило, в скрытой форме, с накоплением большого количества риккетсий в селезенке на 7-9-й день после заражения. Положительный результат эксперимента доказывается обнаружением в сыворотке крови инфицированных животных специфических антител (агглютининов, комплементсвязывающих и др.).
Последовательным заражением здоровых лабораторных животных кровью или взвесью из селезенки инфицированных свинок основного заражения можно поддерживать экспериментальную инфекцию в цепи пассажей. Кроме внутрибрюшинного или подкожного введения материала рекомендуется проведение интратестикулярных пассажей (морским свинкам-самцам вводят в оба яичка по 0,2-0,3 мл взвеси из селезёнки морской свинки основного опыта, затем можно проводить пассажи взвесью из тестикул). В яичках морских свинок при этом происходит накопление большого количества риккетсий. Скротальный феномен, как правило, отсутствует.
Чистые культуры риккетсий, выделенные на подопытных животных, сохраняют при 10-15° в виде лиофильно высушенной взвеси селезенки или тестикул с большим содержанием риккетсий. Выделение чистых культур риккетсий Бернета проводится также путем инфицирования развивающихся куриных эмбрионов (6-7 дневной инкубации) в желточный мешок взвесью органов (селезенка, печень, почка, яичко) подопытных животных. Взвесь готовят в 2-5 мл физиологического раствора и после отстаивания или центрифугирования вводят из расчета по 0,2-0,4 мл на эмбрион. На каждую пробу берут от 5 до 10 эмбрионов. Куриные эмбрионы могут быть использованы и для биопробы, особенно при выделении возбудителя из крови больного. Для получения желточных культур риккетсий нередко необходимо проведение до двух-четырех «слепых» пассажей.
Инфицированные куриные эмбрионы инкубируют при 37° и ежедневно овоскопируют. Погибшие в течение первых 4 суток (главным образом от травмирования при заражении) эмбрионы выбраковывают. Погибшие в последующие дни эмбрионы помещают в холодильник (+4°), живых выдерживают до 10-13 дней с момента инфицирования, а затем всю партию эмбрионов вскрывают; из оболочки желточного мешка каждого эмбриона готовят параллельные мазки. Фиксация препаратов для микроскопического исследования производится спиртом, ацетоном или смесью спирта с эфиром (смесь Никифорова). Затем один препарат окрашивают по Романовскому-Гимзе, второй обрабатывают флуоресцирующими антителами по Кунсу. Микроскопируют в световом и люминесцентном микроскопах, накопление риккетсий оценивают крестами.
Пассажные субкультуры риккетсий Бернета в желточных мешках куриных эмбрионов хорошо удаются при правильно выбранной дозе заражения. Оптимальная заражающая доза соответствует разведениям 1:1000-1:10000 в физиологическом растворе взвеси желточного мешка, содержащего большое количество риккетсий (+ + +) в объеме 0,2 мл на эмбрион. Куриные эмбрионы используют для производственного приготовления диагиостикумов из риккетсий Бернета. Идентификация выделенных риккетсии с целью определения их принадлежности к коксиеллам проводится с помощью перекрестных опытов иммунитета на морских свинках и иммунолюминесцентной пробы по прямому методу Кунса; для этой цели может быть использован и двуступенчатый метод Уиллера-Кунса. Сочетание иммунолюминесцентного метода с общепринятым способом биопроб может оказать существенную помощь для диагностики Ку-риккетсиоза.
При изучении нозогеографии Ку-риккетсиоза, выявления и локализации его природных очагов большую роль играют массовые исследования иксодовых клещей. Однако выделение риккетсий Бернета от клещей обычными методами – трудная и длительная процедура, ограничивающая масштабы работы. С помощью метода флуоресцирующих антител можно проводить исследования большого числа клещей на зараженность риккетсиями Бернета. Наиболее удобно исследовать гемолимфу и кишечник этих членистоногих. Этим же методом могут быть исследованы препараты из отпечатков внутренних органов (селезенка, печень, почки) диких грызунов и других мелких млекопитающих, а также мазки-оттиски из плаценты абортировавших коров, коз, овец (Н. И. Амосеенкова и соавт., 1961; Р. Б. Гольдин и Н. И. Амосенкова, 1961).
Для снижения неспецифического фона при исследовании различных тканевых материалов применяется метод контрастирования с помощью бычьего альбумина, меченого родамином. Этот конъюгат применяется совместно со специфической люминесцирующей сывороткой. Бычий альбумин, меченый родамином, сообщает клеткам и тканям, а также прочим органическим частицам, содержащимся в исследуемых препаратах, оранжевокрасное неспецифическое свечение. Правильно выбранные соотношения конъюгатов должны обеспечить изумрудно-зеленое специфическое свечение изучаемого антигена, четко выделяющегося на оранжево-красном фоне.
Люминесцентную сыворотку против риккетсий Бернета и бычий альбумин, меченый родамином, выпускает ИЭМ им. Гамалеи АМН СССР.
Микробиологические исследования с риккетсиями Бернета требуют специальных условий, что ограничивает круг практических лабораторий СЭС, работающих по выделению и изучению возбудителя Ку-риккетсиоза. Иммунологические же исследования не требуют особых условий и могут осуществляться повсеместно.
Иммунологические методы
Иммунологические методы исследования лихорадки Ку включают в себя серологические тесты, из которых наиболее часто применяют реакцию связывания комплемента (РСК) и реакцию агглютинации (РА), а также кожно-аллергическую пробу.
Кроме того в настоящее время, в том числе в нашей лаборатории, разработаны дополнительные иммунологические пробы: реакция микроагглютинации (РМА) с диагностикумами из риккетсий Бернета, меченых изотиоцианатом флуоресцеина, реакция непрямой иммунофлуоресценции по методу Уиллера-Кунса (РНИФ), реакция кольцепреципитации с растворимым антигеном из риккетсий Бернета I фазы. Эти пробы в силу ряда причин не нашли пока широкого применения в практике работы санэпидстанций, но являются перспективными.
Иммунологические реакции применяются в целях лабораторного подтверждения Ку-риккетсиоза у больных людей и выявления переболевших, обнаружения инфекции у сельскохозяйственных и домашних животных, равно как среди диких грызунов, для оценки эффективности вакцинации и других важных вопросов эпидемиологического характера. Наконец, серологические реакции –необходимый этап комплекса исследований по изоляции и идентификации возбудителя. Реакция связывания комплемента с антигеном из риккетсий Бернета – высокоспецифическая проба. Однако в связи с тем, что комплементсвязывающие антитела редко обнаруживаются на первой неделе заболевания, она мало пригодна для ранней диагностики.
В большинстве случаев положительные реакции возникают на 10-12 дни болезни. Наиболее высокие титры наблюдаются на 3-4 неделе от начала лихорадки. После перенесения болезни комплементсвязывающие антитела в титрах 1:10-1:20 сохраняются в крови на протяжении ряда лет, что обеспечивает возможность ретроспективной диагностики лихорадки Ку с помощью этой пробы.
Комплементсвязывающие антитела в сыворотках больных и реконвалесцентов не являются однородными: в острой стадии заболевания образуются антитела к риккетсиям второй фазы (см. выше), а позднее, по мере выздоровления, в сыворотке больных появляются антитела и к первой фазе риккетсий.
Антиген, вырабатываемый в СССР для серодиагностики Ку-риккетсиоза с помощью реакции связывания комплемента, представляет собой очищенную взвесь убитых риккетсий Бернета, выращенных в желточных мешках развивающихся куриных эмбрионов, и находящихся во второй фазе. Этот препарат выпускают в сухом виде и перед постановкой опыта его разводят физиологическим раствором. Учитывая, что у реконвалесцентов и переболевших имеются антитела и к первой фазе риккетсий, серологические исследования необходимо проводить в РСК с двумя антигенами из риккетсий Бернета, находящихся в I и II фазовых состояниях.
Антигены из риккетсий в I фазе представляют собой очищенную взвесь убитых коксиелл, прошедших после выделения лишь несколько пассажей на куриных эмбрионах. Антиген I фазы может быть получен и из селезенок белых мышей, инфицированных риккетсиями Бернета в I фазе. Антиген из риккетсий Бернета I фазы промышленностью не выпускается. Его готовят лишь в виде экспериментальных серий. Между тем, опыт нашей лаборатории показывает, что при проведении широких эпидемиологических исследований с целью ретроспективного выявления переболевших лихорадкой Ку, установления истинных размеров очага, равно как определения иммунной прослойки населения необходимо использование в РСК антигенов из риккетсий Бернета, находящихся в I и II фазах.
Реакцию связывания комплемента ставят, как обычно, в 2 этапа: сначала проводят титрование комплемента с целью выбора его рабочей дозы. Затем проводят постановку основного опыта. РСК ставится на холоде или при 37°. Опыт нашей лаборатории показывает целесообразность проведения титрования комплемента в присутствии антигена. За одну единицу комплемента условно принимают количество его, вызывающее полный гемолиз, а за одну полную единицу принимают количество комплемента во второй пробирке с полным гемолизом. Если реакцию ведут на холоде, то в качестве «рабочей дозы» берут в основной опыт две полных единицы комплемента. При температуре + 37° рабочую дозу комплемента берут в количестве одной полной единицы. Результаты РСК оцениваются условными обозначениями (крестами). Она считается положительной при задержке гемолиза на четыре креста. При этом в контролях испытуемых сывороток, в контроле антигена и комплемента должен быть полный гемолиз, а в контроле гемолитической системы он должен отсутствовать. Титром реакции считают конечное разведение сыворотки, в котором задержка гемолиза еще имеет место не менее, чем на три креста (+ + +).
Антиген из риккетсий Бернета II фазы, выпускаемый промышленностью, снабжен соответствующим наставлением по его применению. Минимальным диагностическим титром считается разведение сыворотки 1:8–1:10.
При дифференцировании положительных результатов РСК анамнестического характера от реакций наблюдаемых при остром заболевании, учитывают высоту титра, наличие или отсутствие динамики накопления комплементсвязывающих антител. Все это должно приниматься во внимание и при постановке других серологических проб.
Реакция агглютинации
Реакцию агглютинации ставят в пробирках в объеме 0,4 мл. К восходящим разведениям сыворотки, начиная с 1:5 в объеме 0,2 мл, добавляют равный объем антигена; каждый опыт сопровождается контролями исследуемой сыворотки (к 0,2 мл основного ее разведения добавляют 0,2 мл физиологического раствора) и антигена (к 0,2 мл антигена добавляют 0,2 мл физиологического раствора). Рекомендуется в качестве контроля исследовать также заведомо положительную и отрицательную сыворотки. Реакция проводится в термостате при 37° в течение 18-20 часов. Результаты ее учитывают через 2 часа после выдерживания при комнатной температуре. Положительные реакции характеризуются возникновением очень нежного агглютината на дне пробирки. Чтение реакции осуществляют обязательно с помощью агглютиноскопа. Оценку интенсивности положительных реакций проводят по следующей условной шкале: полное просветление надосадочной жидкости и компактные агглютинаты обозначаются тремя крестами (+ + +); неполное просветление при наличии четких агглютинатов – двумя крестами (++); слабо выраженные агглютинаты оцениваются одним крестом ( + ). При заключении о титре сыворотки принимают в расчет только трех- и двухкрестовые реакции. Контроль антигена— равномерно мутная взвесь, без агглютинатов. Контроль сыворотки должен быть прозрачным. Реакцию агглютинации ставят с двумя антигенами из риккетсий Бернета в I и II фазах. В качестве антигена из риккетсий II фазы используют производственные серии диагностикума, предназначенного для РСК (так как, по сути дела, он является корпускулярным, что необходимо для РА). Для РА этот антиген используют в удвоенной концентрации (в ампулу с сухим антигеном добавляют физиологический раствор в объеме в два раза меньшим, чем указано на этикетке).
Агглютинаты из риккетсий в I фазе, как правило, крупнохлопчатые, рыхлые, а из риккетсий во II фазе – мелкозернистые. Диагностическим титром следует считать разведение сыворотки 1:10. Для подтверждения острого заболевания необходимо учитывать нарастание концентрации антител в динамике.
Реакция микроагглютинации (РМА) с диагностикумами из риккетсий Бернета, меченых изотиоцианатом флуоресцеина
Из испытуемых сывороток без предварительного прогревания готовят на физиологическом растворе двухкратные разведения, начиная с 1:5 до 1:1280 и выше. В контроле антигена сыворотку заменяют соответствующим объемом физиологического раствора К 3 каплям каждого разведения сыворотки добавляют равный объем флуоресцирующего антигена, предварительно разведенного до такой концентрации, чтобы при микроскопии в поле зрения содержалось не менее 200 микробных тел.
Пробирки со смесью помещают на 2 часа в термостат при 37°, после чего переносят в холодильник (+4°). На следующий день из каждой пробирки по капле смеси наносят на предметное стекло (8-10 капель в два ряда), подсушивают на воздухе, фиксируют пламенем и исследуют в люминесцентном микроскопе. В случае положительной реакции наблюдаются различной величины агглютинаты из светящихся риккетсий. Результаты оценивают по 3-балльной ккале по соотношению свободных риккетсиальных телец и агглютинатов. Титром антител считают то разведение испытуемой сыворотки, при котором выявляются характерные агглютинаты риккетсий. Отсутствие агглютинатов указывает на отсутствие в сыворотке агглютининов против риккетсий Бернета. При учете результатов следует иметь в виду особенности распределения риккетсиальных телец в капле. При высыхании риккетсии скапливаются по краю капли. Учитывать следует картину, которая наблюдается в центре капли, просматривать надо не менее 20 полей зрения. В качестве контроля в каждый опыт вводится заведомо положительная и отрицательная по этой реакции сыворотка. В контроле антигена отдельные риккетсии должны располагаться по всему полю зрения равномерно, без образования хлопьер. Контроли сывороток в этой реакции ставить нет необходимости. Препараты на предметных стеклах после учета результатов реакции могут длительно, в течение месяцев, сохраняться в холодильнике. Результаты реакции можно регистрировать фотографированием.
В реакции микроагглютинации применяют меченые флуорохромом риккетсии в I и II фазовых состояниях (Н. И. Амосенкова и соавт., 1966). Диагностикумы сохраняют в жидком виде с добавлением мертиолата (1 : 10000) при 4°.
Реакция непрямой иммунофлуоресценции по методу Уиллера-Кунса (РНИФ)
Из испытуемых сывороток, без их предварительного прогревания, готовят двухкратные разведения на физиологическом растворе от 1:10 до 1:80, а при необходимости и выше. Каплю каждого разведения наносят на мазки антигенов и выдерживают 40 минут во влажной камере при 37°. Затем препараты промывают фосфатным буферным раствором (pH 7,4) в течение 10 мин. После высушивания на мазки наносят антивидовой гаммаглобулин, соответствующий испытуемой сыворотке и вновь выдерживают во влажной камере при 37 в течение 30 мин.
Затем промывают в свежей порции буфера в течение 10 мин., ополаскивают дистиллированной водой и высушивают. Учет результатов проводят в люминесцентном микроскопе. Антигены из риккетсий Бернета в I и II фазах для РНИФ разводят физиологическим раствором до концентрации, обеспечивающей в каждом поле зрения до 200 риккетсиальных телец. Антиген в рабочем разведении каплями (до 8 капель) наносят на предметное стекло, высушивают и фиксируют спиртом или смесью спирта с эфиром. Заготовленные таким образом мазки сохраняют до использования при температуре +4° (пригодны в течение месяца). В качестве антигена из риккетсий II фазы могут быть использованы производственные серии антигенов Института им. Гамалеи и Ташкентского ИВС, выпускаемые для РСК антивидовые флуоресцирующие сыворотки против глобулинов человека, кролика, морской свинки, барана и быка выпускает в сухом виде Институт им. Гамалеи. Они используются в рабочем разведении, указанном на ампуле. В каждый опыт вводится заведомо положительная и отрицательная сыворотки. Контроль флуоресцирующей антивидовой сыворотки в рабочем разведении – свечение риккетсий в препарате должно отсутствовать. Оценку результатов РНИФ проводят на основании яркости флуоресценции риккетсий и по выявлению феномена «ободка». Титром антител считают то разведение сыворотки, которое обусловливает свечение риккетсиальных корпускул на 2 креста (+ + ), при этом риккетсии, четко выявляются в препарате. Результаты реакции могут быть сфотографированы (Н. И. Амосенкова и соавт., 1966).
Реакция кольцепреципитации с растворимым антигеном, полученным из риккетсий Бернета I фазы
Реакцию кольцепрепитации (РКП) проводят при комнатной температуре в пробирках диаметром 0,5 см. На 0,2 мл испытуемой без предварительного прогревания сыворотки осторожно наслаивают 0,2 мл антигена. Через 20-30 мин при наличии в сыворотке соответствующих антител против коксиелл на границе жидкостей возникает беловатое кольцо преципитации, хорошо выявляемое на темном фоне. Контроли: а) испытание заведомо положительной и отрицательной сывороток; б) исследование испытуемых сывороток с трихлоруксусным экстрактом, полученным из селезенок незараженных мышей тем же способом, что и специфический растворимый антиген. Титром антител в РКП считается разведение испытуемой сыворотки, при котором возникает кольцо преципитации. При постановке РКП с диагностической целью или эпидемиологической разведки можно считаться при положительных реакциях с цельными сыворотками.
Растворимый антиген получают путем обработки трихлоруксусной кислотой взвеси из ткани селезенок белых мышей инфицированных коксиеллами I фазы (Р. И. Куделина, 1970, Н. И. Амосенкова и др., 1973).
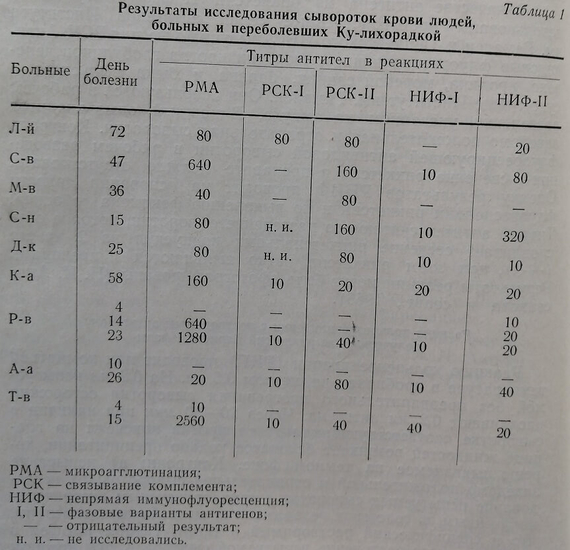
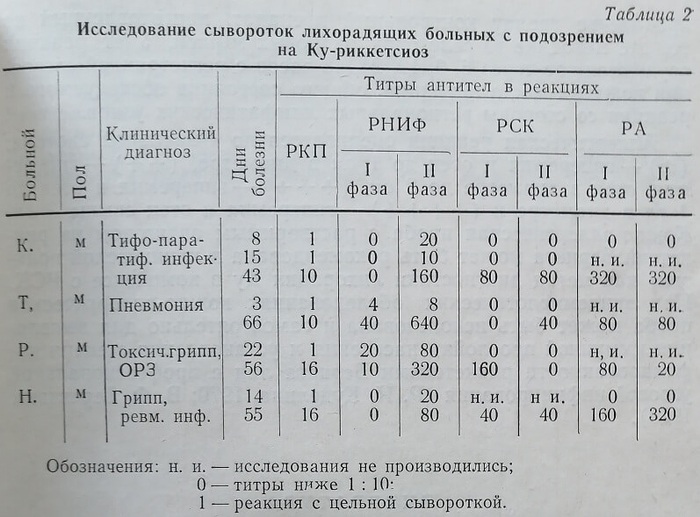
Параллельное использование нескольких серологических реакций значительно повышает возможности и ранней диагностики Ку-риккетсиоза. Это положение сохраняет свою силу и при применении лабораторных методов с целью эпидемиологической разведки местностей в отношении этой инфекции (см. табл. 1 и 2).
Все вышеописанные серологические реакции могут быть использованы для выявления инфицированности животных возбудителем Ку-риккетсиоза.
У сельскохозяйственных животных комплементсвязывающие антитела, как правило, исчезают сравнительно быстро. Поэтому в местностях, где обнаружены очаги Ку-риккетсиоза, необходимо исследовать крупный и мелкий рогатый скот ежегодно – в конце выпасного сезона, при обязательном включении в исследование молодняка. Наличие антител у телят и ягнят свидетельствует об активности Ку-риккетсиоза в период обследования. Наш опыт показывает, что у крупного и мелкого рогатого скота выявляются преимущественно комплементсвязывающие антитела и агглютинины к риккетсиям I фазы. В сыворотке животных обнаруживаются также преципитины и антитела, выявляемые в РНИФ.
Для иммунологической диагностики Ку-риккетсиоза может быть применена, предложенная Р. И. Куделиной (1970) кожноаллергическая проба с растворимым антигеном из риккетсий Бернета фазы I. Автор получала растворимый антиген из селезеночных культур риккетсий Бернета I фазы путем обработки трихлоруксусной кислотой по Буавену. Лиофилизированный антиген разводят физиологическим раствором в соответствующем объеме. Препарат в объеме 0,1 мл вводят внутрикожно во внутреннюю поверхность предплечья туберкулиновым шприцем или безыгольным инъектором «Пчелка». В противоположное
предплечье вводят контрольный препарат, приготовленный по той же методике из селезенок здоровых мышей. Учет реакции осуществляют через 6, 9, 12, 24, 48 часов с регистрацией состояния кожи на месте инъекции, общего состояния обследуемого и реакции со стороны региональных лимфатических узлов.
Аллергическая реакция оценивается по 4-балльной системе: (±)—гиперемия и отек до 1 см в диаметре, ( + + ) – гиперемия, отек в диаметре до 2 см, ( + + + )– гиперемия и отек до 3 см в диаметре и (+ + + + ) – гиперемия и отек свыше 3 см. Кожно-аллергическая проба с растворимым антигеном из риккетсий Бернета может быть рекомендована в клинической практике как метод диагностики лихорадки Ку в комплексе с РСК. При эпидемиологических обследованиях кожно-аллергическая проба может быть использована и самостоятельно для выявления иммунной прослойки населения и установления степени инфицированности риккетсиями Бернета лиц с профессиональной угрозой инфицирования (Р. И. Куделина, 1970; В. Ф. Терентьев).