Влияние лазерного излучения на процессы репродукции и внутриутробное развитие плода
Экспериментальные и клинические данные о влиянии лазерного излучения на процессы репродукции, течение беременности и внутриутробное развитие плода крайне малочисленны.
S. Fine и соавторы (1965) одними из первых сообщили об отдаленных последствиях облучения высокомощными лазерами половых органов животных. После облучения яичников и яичек мышей было отмечено отсутствие у потомства облученных родителей каких-либо существенных отклонений в развитии. Направленное воздействие сфокусированного луча рубинового лазера на эмбрионы (область бластодермы) при облучении через скорлупу, оболочки и белка глубиной в несколько миллиметров с последующей инкубацией яиц вызывало появление врожденных аномалий развития у зародышей – вывернутых наружу изуродованных лап, бугристости внутренних органов. Аномалии развития наблюдали и в том случае, когда эмбрионы облучали через стерильное покровное стекло, помещенное над небольшим отверстием в скорлупе.
J. Edlow и соавторы (1964, 1965) воздействовали на развивающиеся зародыши рубиновым лазером с энергией от 20 до 40 Дж, непосредственно облучая выведенный наружу рог матки крысы в конце беременности. При этом разрывов стенки матки не наблюдали, целость амниотической сумки также сохранялась, однако у эмбрионов развивались очаги поражения (разрывы, фрагментация ткани, некротические изменения) различной локализации, проявляющиеся особенно резко на границе между разнородными тканями. В ряде случаев имели место и поражения внутренних органов (некроз гепатоцитов, локальные поражения легких). Несмотря на значительную вариабельность данных, в целом поражения у зародышей были более выражены при облучении на более поздних стадиях развития, что в определенной мере связано с толщиной стенки матки, мембран плаценты (Н. Ф. Гамалея, 1972).
Приведенные экспериментальные исследования свидетельствуют об избирательности воздействия лазерного излучения на биологические ткани, а также о его способности повреждать глубоколежащие ткани при значительной деструкции поверхностных.
В работах по изучению влияния излучения лазеров на эмбриогенез использовали в основном лишь лазеры относительно высокой мощности импульсного режима генерации.
Обстоятельные данные о влиянии различных типов лазерного излучения на процессы репродукции и внутриутробное развитие в доступной нам литературе отсутствуют, тем не менее исследования такого рода необходимы, так как известна высокая чувствительность этих процессов к лучевым факторам.
В связи с наиболее широкими возможностями применения в самых различных областях медицины, включая и акушерство, излучения лазеров гелий-неонового типа (как нового физиотерапевтического средства) исследования процессов репродукции, эмбриогенеза, функционального состояния беременных, течения родов, состояния плода и новорожденного в условиях облучения этими ОКГ представляют особый интерес. Такие немногочисленные исследования выполнены преимущественно отечественными авторами.
Представляет интерес краткое сообщение К. Г. Кайдаулова (1976) о влиянии излучения гелий-неонового лазера на процессы репродукции у птиц. Автор отметил увеличение яйценоскости и стимуляцию сперматогенеза в результате лазерного облучения. При многократном облучении самцов низкоинтенсивным потоком монохроматического красного света гелий-неонового лазера ЛГ-75 (дозы, режимы и способы воздействия не указаны) наблюдалось увеличение объема эякулята более чем в 2 раза, повышение активности сперматозоидов, а при искусственном обсеменении – повышение оплодотворения яиц на 17 %.
Начиная с 1974 г., стали появляться немногочисленные сообщения о влиянии низкоинтенсивного излучения гелий- неонового лазера (выходной мощностью до 25 мВт) на течение беременности у крольчих (К. В. Чачава и соавт., 1974; Г. Г. Джвебенава и соавт., 1974-1981; Ц. Г. Дидия и соавт., 1976, и др.). Во всех этих исследованиях облучение животных проводилось только во II половине беременности; условия и дозировка воздействия была одинаковой: проводили ежедневное 10-минутное облучение животных потоком лазерного света, направленного на область шейных рефлексогенных зон (ППМ составляла 20-25 мВт/см2). При таком воздействии нарушений течения беременности авторами не обнаружено. Клеточный состав периферической крови беременных был в пределах нормы. Показатели коагулограммы крови в целом также были в физиологических пределах, отмечалось лишь незначительное понижение коагулирующих свойств крови.
У облученных беременных животных по сравнению с контрольными увеличивался pH.Последнее происходило под влиянием накопления щелочных радикалов, что подтверждалось увеличением буферных оснований, истинных и стандартных бикарбонатов. Незначительное увеличение количества базофильных и полихроматофильных нормобластов не выходило за пределы нормы. Не было также обнаружено структурно-функциональных изменений паренхиматозных элементов гипофиза, надпочечников и яичников облученных крольчих. Некоторые изменения сосудистых элементов по типу гиперемии и стаза выявлялись главным образом на уровне капилляров и в целом были выражены в незначительной степени.
Беременность у облученных кроликов во всех случаях протекала нормально. Роды нормальными крольчатами наступили в срок. Отставания и отклонений от нормального развития у потомства облученных животных не выявлено. Эти экспериментальные данные в какой-то мере послужили основанием к клиническому применению гелий-неонового лазерного излучения для лечения нефропатии беременных и другой акушерской патологии (Г. Г. Джвебенава, 1979, 1980).
Однако приведенных данных явно недостаточно для суждения о характере влияния лазерного излучения на процессы репродукции и эмбриогенез, а без этого невозможны широкое внедрение лазеротерапии в акушерско-гинекологическую практику и оценка излучения гелий-неонового лазера как нового профессионально-гигиенического фактора.
Учитывая вышесказанное, нами проведено изучение влияния гелий-неонового лазерного излучения на внутриутробное развитие плода, включая до- и постимплантационные стадии эмбриогенеза; тератогенного действия излучения в дозах, в 5-6 раз превышающих оптимальные терапевтические, рекомендуемые для клинического применения при акушерской патологии; комбинированного воздействия излучения гелий-неоновых лазеров и некоторых химических тератогенов на эмбриональное развитие, а также цитогенетических эффектов этого фактора в эксперименте на животных.
Согласно поставленным задачам, нами было выполнено 3 серии экспериментов:
- I – исследование влияния излучения гелий-неонового лазера на беременных самок и внутриутробное развитие плода;
- II – изучение комбинированного действия лучей лазера и некоторых тератогенов на эмбриональное развитие;
- III – исследование цитогенетических эффектов гелий-неонового излучения в клетках костного мозга крыс.
Опыты проводили на белых крысах-самках линии Вистар питомника АМН СССР “Рапполово” (всего было
использовано 182 половозрелые крысы и 1259 крысиных плодов).
Источником облучения служил гелий-неоновый лазер ЛГ-75 (А, 632,8 нм, выходная мощность, контролируемая в процессе проведения опытов при помощи прибора ИМО-2 составляла 25 мВт). ППМ излучения во всех сериях составляла 25 мВт/см2, площадь облучения – 1 см2, экспозиция одного сеанса – 5 мин. Проводили ежедневное местное транскутанное облучение эпилированной области кожи; количество сеансов, место облучения и другие условия опытов определялись задачами каждой серии исследований и указаны ниже.
В настоящем разделе главы представлены результаты исследований I и II серии опытов.
Для получения датированной беременности половозрелых крыс-самок массой 160-200 г подсаживали к самцам в фазе течки, а день обнаружения спермиев во влагалищных мазках считали 1-м днем беременности.
Облучение иммобилизованных животных проводили ежедневно с 1-го по 2-й день беременности (I серия опытов) или с 9-го по 13-й день беременности (II серия опытов). Концентрированный пучок лазерных лучей направляли на переднюю брюшную стенку в области проекции только правого маточного рога. Животным II серии опытов на 13-й день беременности вводили внутрижелудочно антималярийный препарат хлоридин в дозе 50 мг/кг или противоопухолевый препарат меркаптопурин в дозе 60 мг/кг.
Установлено, что эти препараты, будучи введенными в организм беременных в период активного органогенеза (13-й день беременности), в указанных концентрациях вызывают уродства развития у 100 % зародышей крыс (А. П. Дыбан, И. М. Акимова, 1965; Ю. С. Вишняков, 1968).
Животных контрольной группы иммобилизовали на модифицированной доске Ренауда аналогичным образом, кроме того, группе животных вводили тератогены в те же сроки и в тех же дозах, что и опытным крысам II серии опытов. Всех беременных крыс забивали на 20-й день беременности бескровным методом (путем перерывания спинного мозга), производили лапаротомию, извлекали и рассекали рога матки, подсчитывали число мест имплантации, количество погибших, мацерированных, резорбцированных) и живых зародышей. Половину зародышей фиксировали в жидкости Буэна для последующего анализа состояния внутренних органов при помощи модифицированной микроанатомической методики Вильсона (И. Р. Бариляк, 1967), остальных – в 96 % спирте этиловом с целью изучения состояния костной
системы на тотальных просветленных препаратах, окрашенных ализариновым красным. Учет результатов опытов проводили раздельно для правого (облученного) и левого (необлученного) рогов матки у каждого опытного животного.
Печень самок, эмбриональную печень и плаценту фиксировали в жидкости Буэна или 10 % водном растворе формальдегида и впоследствии подвергали гистологической и гистохимической обработке. При этом использовали следующие методы: окраску гематоксилином и эозином по Маеру, выявление ДНК – по Фельгену, РНК – по Элквисту, гликогена – ШИК-реакцией с амилазным контролем (Э. Пирс, 1962). На препаратах, окрашенных по методу Фельгена, подсчитывали число делящихся клеток и соотношение отдельных фаз митоза.
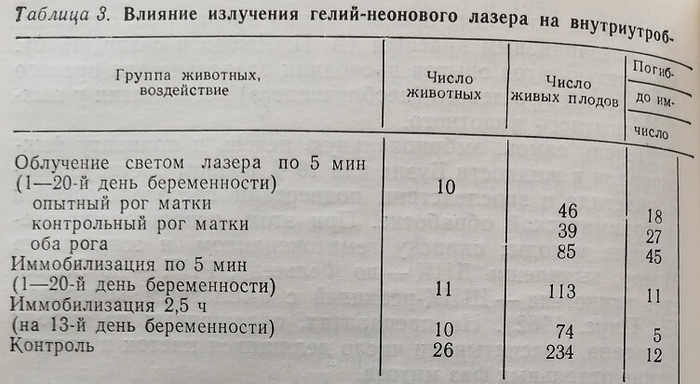
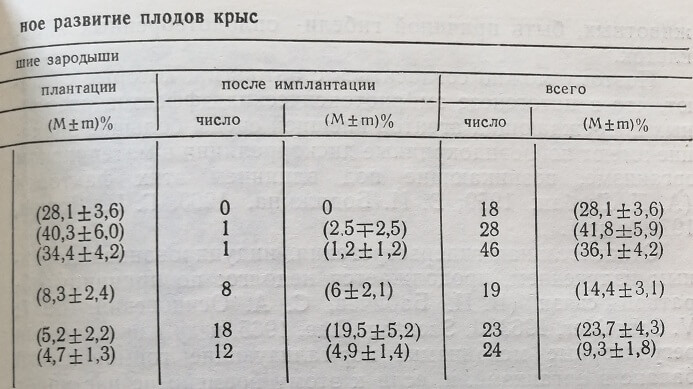
В опытах по изучению влияния лазерного излучения на внутриутробное развитие плода при воздействии концентрированного пучка света ежедневно по 5 мин на протяжении всей беременности (I серия опытов) установлено отсутствие тератогенной активности излучения. Тем не менее, как представлено в табл. 3, такое воздействие обусловило выраженный эмбриолетальный эффект: общая гибель зародышей достигла (35,1 ±4,2) %, в контроле – (9,3±1,8) %, разница статистически достоверна, Р<0,05. Причем этот эффект реализовался, как правило, на доимплантационной стадии, когда гибель зародышей составляла (34,4 ±4,2) %. После имплантации отмечена гибель лишь 1 из 131 зародышей, что составило (1,2±1,2) %, в контроле – (4,9±1,4) %, Р<0,05. Заслуживает внимания тот факт, что гибель зародышей наблюдали не только в правом, находившемся на стороне облучения роге матки, но и в левом, не подвергавшемся непосредственному действию лучевого фактора и служившим относительным контролем (различия в показателях до- и постимплантационной эмбриолетальности между обоими рогами матки были статистически не достоверны, Р>0,05). Это указывает на то, что наблюдаемый эффект облучения реализовался не путем местных реакций в зоне воздействия излучения, а был опосредован общими изменениями в организме беременной, индуцированными гелий-неоновым светом.
Таким образом, в результате лазерного воздействия погибла 7 из крысиных зародышей, в 98,8 % случаев – на доимплантационных стадиях эмбриогенеза.
Наблюдаемый эмбриолетальный эффект не связан с ежедневной иммобилизацией крыс на протяжении всего периода беременности, так как, согласно представленным в табл. 3 данным, такая кратковременная иммобилизация не влияет на внутриутробное развитие крысы (показатели до- и постимплантационной гибели эмбрионов иммобилизованных животных статистически достоверно не отличаются от таковых у животных контрольной группы) , Р>0,05. Более того, даже 2,5-часовая иммобилизация (см. табл. 3) на 13-й день беременности (период активного органогенеза) только незначительно повышала постимплантационную гибель зародышей и не вызывала каких-либо отклонений от нормального морфогенеза.
Учитывая результаты собственных исследований и вышеприведенные данные литературы о повышении активности фолликулярного аппарата яичников под влиянием лучей гелий-неонового лазера в условиях эксперимента и клиники, можно предположить, что рост доимплантациоиной эмбриолетальности обусловлен эффектом временно индуцированной гиперпродукции эстрогенных гормонов в организме беременных самок, наступившим в результате облучения.
Если исходить из общих положений о регуляции полового цикла, вероятный механизм наблюдаемого явления нам представляется следующим.
Низкоинтенсивное лазерное излучение красной области спектра путем воздействия на кожную рефлексогенную зону активизирует функцию гипоталамуса, следствием чего является максимальный выброс либеринов (рилизинг-факторов), поступающих в аденогипофиз. Последнее усиливает деятельность прежде всего тех гормон-продуцирующих гонадотропных клеток, клеток гипофиза, которые к моменту
овуляции и оплодотворения находились в состоянии наибольшей функциональной активности. Это ведет к дополнительному биосинтезу и выбросу гонадотропинов в кровяное русло, что в свою очередь стимулирует фолликулярный аппарат яичников и продукцию эстрогенов. В таких условиях временно создается относительная гиперэстрогения, которая оказывает существенное влияние на начальный период внутриутробного развития: задерживаются процессы созревания и функционирования желтого тела, что ведет к относительной прогестероновой недостаточности. При таком гормональном фоне возможно нарушение имплантации в стенку матки оплодотворенной яйцеклетки, в связи с чем наступает ее гибель.
Известно, что повышенное содержание в организме эстрогенов или пониженная секреция прогестерона приводят к гиперплазии эндометрия (при отсутствии секреторной его перестройки), к интерстициальным геморрагиям, увеличению относительной плотности соединительной ткани, понижению содержания в эндометрии гликогена (Е. С. Hughes и соавт., 1950), что в конечном итоге ведет к нарушению процессов имплантации, в частности к «поверхностной» имплантации (J. Н. Mulvany, 1956) или невозможности ее осуществления и, следовательно, гибели зародышей на ранних стадиях эмбриогенеза. Кроме того, гормональные дискорреляции, в частности гиперэстрогения, могут способствовать так называемому перезреванию яйцеклеток, что также может обусловливать высокую частоту хромосомных аномалий в раннем эмбриогенезе человека и животных, быть причиной гибели оплодотворенных яиц и. клеток.
Поэтому можно согласиться с авторами, которые считают, что в патогенезе эмбриотоксических эффектов различных повреждающих агентов внешней среды большое значение имеют нейроэндокринные дискорреляции в материнском организме, возникающие под влиянием этих факторов.
Относительная гиперэстрогения, индуцированная лазерным излучением, продолжается недолго: по принципу обратной связи включаются регуляторные механизмы, нормализующие гормональный баланс в организме, и, если к этому времени не наступает гибель плодного яйца, в дальнейшем беременность развивается нормально.
Организм как бы «привыкает» к действию нового раздражителя, и развитие зародышей на постимплантационной стадии эмбриогенеза протекает нормально. Так, несмотря на то, что животных продолжали облучать в том же режиме в течение всей беременности, гибель зародышей после имплантации была такой же, как и у животных контрольной группы, не подвергавшихся облучению, врожденные пороки развития и отставание в развитии у новорожденных животных не наблюдались.
При наружном осмотре плодов под бинокулярной лупой и исследовании состояния внутренних органов по микроанатомической методике было установлено, что лазерное облучение не оказывало тератогенного эффекта: ни у одного из живых зародышей не были обнаружены аномалии развития. Размеры плодов, определяемые по теменно-копчиковому индексу, у облученных и контрольных животных были идентичными и составляли в среднем (30 ±0,8) нм, некоторые различия показателей отдельных опытных и контрольных групп животных статистически недостоверны.
При изучении костной системы плодов на тотальных просветленных препаратах, окрашенных ализариновым красным, также не выявлено каких-либо аномалий развития.
При этом происходит стимуляция экстрамедуллярного кроветворения (рис. 11, 12, 13), метаболических процессов в клетках печени зародышей крыс, в них снижается содержание гликогена (рис. 14, 15, 16), повышается уровень РНК (рис. 17, 18), увеличивается кровенаполнение печени зародышей. Проницаемость сосудистого барьера в условиях опыта не нарушается. Следует отметить, что все эти изменения, так же как и результаты тератологических методов исследования, были однотипны как на стороне облучения, так и на противоположной интактной стороне. Это еще раз подтверждает представление о том, что наблюдаемый у плодов эффект облучения реализуется опосредованно, через изменения в организме беременных самок.
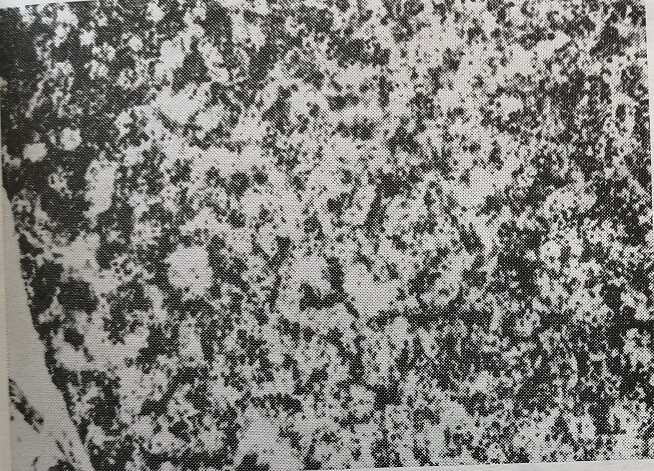
Рис. 11. Печень 20-дневного зародыша крысы, подвергавшейся влиянию излучения гелий-неонового лазера. Наличие большого количества кровяных островков, сформированных гемопоэтическими клетками. Окраска гематоксилин-эозином. Микрофото. Об. 10, ок. 10
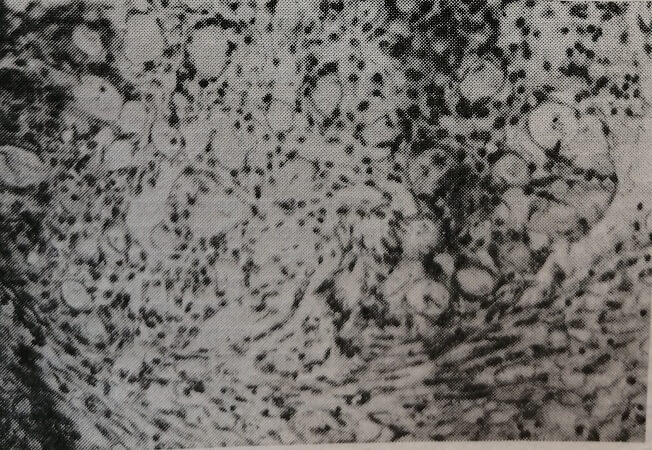
Рис. 13. Печень 20-дневного зародыша крысы, подвергавшейся действию излучения гелий-неонового лазера. Гепатоциты без деструктивных изменений. Окраска гематоксилин-эозином. Микрофото. Об. 20, ок. 10
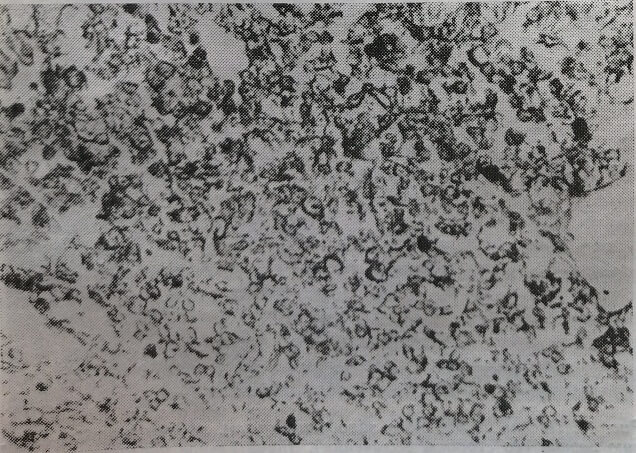
Рис. 15. Печень 20-дневного зародыша крысы, подвергавшейся влиянию С лазера. Незначительное содержание гликогена в единичных патоцитах ШИК-реакция. Микрофото. Об. 20, ок. 10
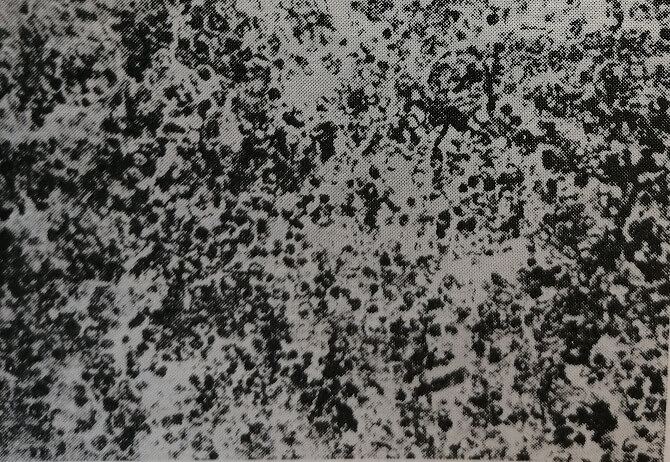
Рис. 17. Печень 20-дневного зародыша крысы, подвергавшейся влиянию лазера (со стороны облучения). Значительное увеличение содержания РНК в цитоплазме гепатоцитов, в зрелых гемопоэтических клетках кровяных островков РНК отсутствует. Окраска по Элквисту. Микрофото. Об. 20, ок. 10
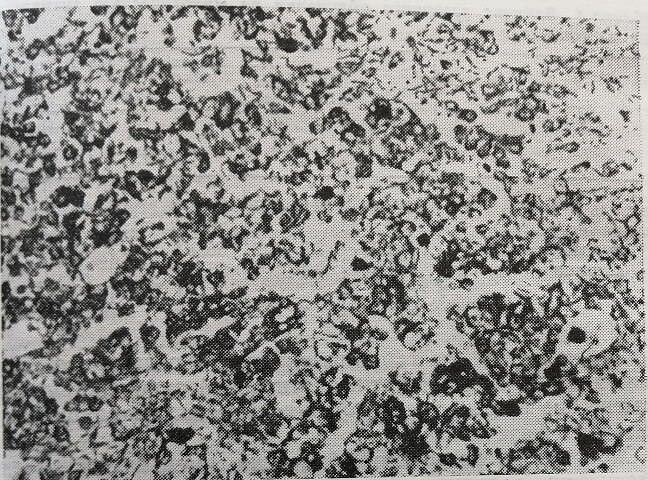
Рис. 18. Печень 20-дневного зародыша крысы, подвергавшейся влиянию лазера (с противоположной стороны). Незначительное нарастание содержания РНК в цитоплазме гепатоцитов (по сравнению с контролем). Окраска по Элквисту. Микрофото. Об. 20, ок. 10
Влияние излучения гелий-неонового лазера на митотическую активность эмбриональных клеток
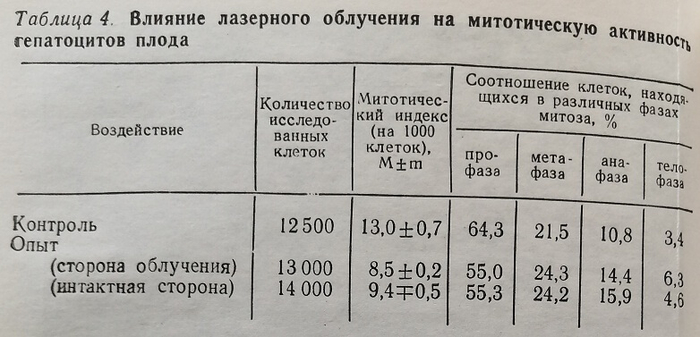
Действие лазерного излучения на митотическую активность исследовали на печеночных клетках плодов 20-го дня беременности. Определили митотический индекс (количество делящихся клеток на 1000 исследованных), а также соотношение клеток, находящихся в различных фазах митоза. Всего изучено 61000 клеток в опыте и 39 500 – в контроле. Результаты исследований представлены в табл. 4.
Как видно из таблицы, под действием излучения гелий- неонового лазера происходит уменьшение количества делящихся клеток в печени эмбриона: митотический индекс гепатоцитов после облучения был в пределах (8,5±0,2) % и (9,4±0,5) %, тогда как в контроле этот показатель составлял (13,0±0,7) %, разница статистически достоверна, Р<0,001. Причем следует отметить, что антимитотический эффект лазерного облучения, равно как и эмбриолетальный, был выражен примерно одинаково с облученной (в гепатоцитах плодов, извлеченных из правого рога матки) и с интактной стороны (левого рога матки); различия показателей митотических индексов с обеих сторон статистически недостоверны (Р>0,05). Учитывая это, можно полагать, что антимитотическое влияние лазерного облучения на эмбриональные клетки, как и эмбриолетальная активность, реализуются в организме опосредованно через общие изменения
гомеостаза.Из данных той же таблицы следует, что лазерное облучение хотя и обладает антимитотической активностью, тем не менее не изменяет соотношения клеток, находящихся в различных фазах митоза.
Способность лазерного облучения уменьшать уровень митотически делящихся клеток зародышей крыс за счет равномерного уменьшения числа клеток, находящихся на разных фазах митоза, свидетельствует о том, что эмбриональные клетки, по-видимому, одинаково чувствительны в разных фазах митотического цикла к действию агента. С другой стороны, однозначность изменений клеточного деления у зародышей и проявления эмбриолетального действия исследуемого фактора указывают на то, что в механизме реализации эмбриолетального действия возможное значение имеет антимитотическая активность облучения, а также на важную роль изменений гормонального баланса (гиперэстрогении) в генезе антимитотического и эмбриолетального действия лазерного облучения. В пользу такого предположения свидетельствуют данные о том, что эстрогены обладают антимитотическим эффектом и способны в больших дозах вызывать повреждения хромосом (И. А. Алов, 1964; О. И. Епифанова, 1965).
Следовательно, можно предположить, что изменения деления клеток зародышей и эмбриогенеза в целом под влиянием лазерного света являются результатом нарушения гормонального баланса в организме беременной и могут быть отнесены к категории неспецифических ответных реакций на отклонения его гомеостаза.
Изучение комбинированного действия излучения гелий- неонового лазера и некоторых химических тератогенов на эмбриогенез
Известно, что на плод чаще действует не один, а несколько повреждающих факторов внешней среды.
По мнению М. Runner (1967), возможны 4 варианта взаимодействия тератогенов: а) эффект комбинированного действия меньше, чем активность каждого агента в отдельности; б) комбинация оказывает такой же эффект, как и воздействие отдельных агентов; в) результат равен сумме действий отдельных тератогенов; г) эффект комбинированного действия превышает эту сумму. Исходя из этих положений, необходимо было выяснить вопрос о влиянии лазерного излучения (которое само по себе лишено тератогенной активности) на повреждающую активность химических тератогенов. Выяснению этого вопроса была посвящена 2-я серия опытов. В качестве тератогенов мы избрали вещества с хорошо изученной в эксперименте на белых крысах повреждающей эмбриогенез активностью (хлоридин и меркапто-пурин).
Результаты этой серии исследований отражены в табл. 5, 6.
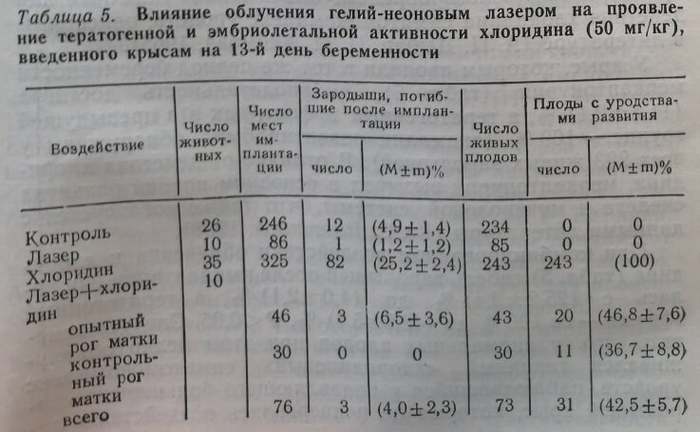
После воздействия хлоридина (табл. 5) в дозе 50 мг/кг в период активного органогенеза гибель зародышей достигла (25,2±2,4) %, а тератогенный эффект отмечен в 100 % случаев (все 243 извлеченных живыми плода имели аномалии развития). При этом наиболее характерны были повреждения центральной нервной системы (микроцефалия, менин-гоцеле, анэнцефалия, гидроцефалия, недоразвитие коры больших полушарий головного мозга), скелета (микромелия, эктро-, брахи- и синдактилия, фокомелия, гипогнатия, расщелина твердого нёба, нарушение процессов оссификации грудины, ребер, лицевого черепа, плюсневых и пястных костей), мочеполовой системы (гидронефроз, гидроуретер, крипторхизм). Таким образом, наблюдался типичный для действия хлоридина симптомокомплекс уродств, описанный в литературе.
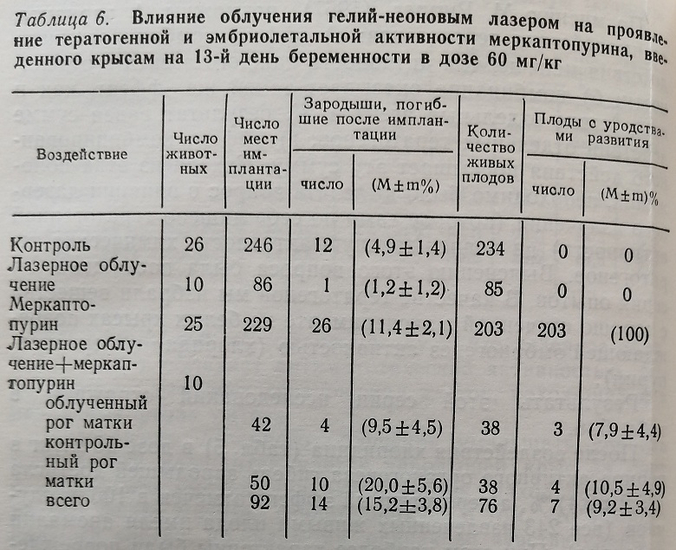
У крыс, которым вводили в тот же период беременности меркаптопурин (табл. 6), эмбриолетальность достигла (11,4±2,1) %, а тератогенный эффект, как и в предыдущей группе, 100 % (аномалии развития были обнаружены у всех 203 живых зародышей). В отличие от действия хлоридина, меркаптопурин вызывал в основном пороки развития скелета и мочеполовой системы, что также согласуется с данными литературы (Ю. С. Вишняков, 1968).
При комбинированном воздействии облучения и хлоридина (табл. 5) гибель зародышей после имплантации снижалась с (25,2±2,4) % до (4,0±2,1) %, а тератогенный эффект – со 100 % ДО (42,5±5,7) %, Р<0,05. Следует отметить, что у аномальных плодов при этом редко обнаруживался типичный «хлоридиновый» симптомокомплекс УРОДСТВ наблюдавшийся у подавляющего большинства зародышей крыс, которые не подвергались воздействию лазерного облучения. Вместе с тем, значительно чаще после облучения встречались единичные пороки развития, например, расщелина твердого нёба в заднем отделе или только укорочение хвоста при отсутствии каких-либо других аномалий развития, характерных для этого тератогена, то есть «хлоридиновые» поражения у плодов носили как бы редуцированный характер.
Эмбриолетальная активность меркаптопурина в условиях облучения существенно не изменялась (различия между показателями постимплантационной эмбриолетальности у животных опытной и контрольной групп статистически не достоверны, Р>0,05 (см. табл. 6). Тем не менее тератогенная активность этого препарата снижалась еще более значительно: аномалии наблюдались лишь у (9,2 ±3,4) % плодов, тогда как в группе необлученных животных, получавших меркаптопурин, они наблюдались у всех 100 % живых зародышей. При этом лишь у одного плода были обнаружены множественные пороки развития, в остальных случаях наблюдались единичные или системные пороки (например, укорочение хвоста, эктро- или синдактилия). Очевидно, что при действии меркаптопурина, как и при действии хлоридина, в условиях облучения наблюдалось уменьшение тяжести аномалий развития плодов.
Таким образом, результаты опытов показали, что излучение гелий-неонового лазера в определенном режиме воздействия значительно уменьшает эмбриотоксическое и тератогенное действие хлоридина и меркаптопурина. При этом отмечена выраженная антитератогенная активность облучения.
Согласно данным литературы, аналогичными свойствами обладают некоторые химические препараты, а именно: димексид, этоний, инсулин, пентоксил и др. По мнению ряда авторов, в меха- низме тератогенеза важное значение имеют индуцированные нарушения морфофункционального состояния лизосом эмбриональных клеток. Эти клеточные органеллы принимают участие в реализации механизма гибели клеток, имеющего важное значение как для процессов нормального морфогенеза, так и его нарушений.
Вполне возможно, что отсутствие тератогенной активности у ряда химических агентов при действии лазерного света связано с влиянием последнего на морфофункциональное состояние лизосом зародышевых клеток. Это предположение подтверждают данные о высокой чувствительности
мембранных структур клетки.
Как известно, исследованные нами тератогены (хлоридин и меркаптопурин), напротив, вызывают значительную стабилизацию мембран лизосом (И. Р, Бариляк, А. М. Забара, 1979) и при этом повышают активность лизосомных ферментов деполимерного действия, в частности кислой ДНКазы (И. Р. Бариляк, Л. П. Калиновская, 1977, 1979), Стабилизация мембраны органеллы приводит к ее хрупкости, генерализованным разрывам и выходу активных ферментов в гиалоплазму (И. Р. Бариляк, Л. П. Калиновская, 1980), с чем, по мнению авторов, и связана антимитотическая ицитогенетическая активность тератогенов и их влияние на внутриутробное развитие плода.
Таким образом, вполне возможен выбор средств, обладающих антитератогенными свойствами, которые дестабилизируют мембрану лизосом и не изменяют активности их ферментов (И. Р. Бариляк, 1976). Именно таким действием обладают инсулин, этоний, димексид, пентоксил. Возможно, что таков же механизм антитератогенной активности облучения гелий-неоновым лазером.