Люминесцентный анализ для исследования аналитов
Среди оптических методов измерения концентраций аналитов в клинической лабораторной практике большое место занимает измерение света, излучаемого молекулами исследуемых веществ. Испускание света молекулой после ее возбуждения в результате поглощения энергии в любой форме, в том числе вслед за избирательным поглощением света, называется люминесценцией.

Испускаемый молекулами свет несет энергию, высвобождаемую при переходе электронов из возбужденного (метастабильно- го) состояния в невозбужденное.
Среди процессов испускания света при комнатной температуре различают:
- флюоресценцию как частный случай люминесценции, при этом молекула находится в возбужденном состоянии очень недолго, излучение следует непосредственно за поглощением возбуждающего света;
- фосфоресценцию, когда молекула долго находится в метастабильном состоянии, время между поглощением возбуждающего света и эмиссией может длиться в течение многих часов;
- хемилюминесценцию, когда источником энергии служит химическая реакция;
- электрохемилюминесценцию – испускание света молекулами веществ, перешедших в возбужденное состояние в результате электрохимических процессов;
- биолюминесценцию – частный случай хемилюминесценции, имеющей биологическое происхождение свечения. Этот вид люминесценции присущ живым организмам, в которых выделение световой энергии излучения происходит в окислительных процессах, катализируемых люциферазами.
Флюоресценция
Фотоны испускаются в результате биологически обоснованных реакций, которые характеризуются образованием очень высокого кванта световой энергии. Возвращение в исходное (невозбужденное) состояние может происходить различными способами, один из которых флюоресценция, т.е. испускание молекулой света.
Флюоресцирующая молекула может непосредственно поглощать квант возбуждающего света, но ее «накачка» энергией может быть и опосредованной, когда свет поглощается соседней,
иногда многокомпонентной, молекулярной структурой, а то затем передается флюорофору.
Большинство традиционно используемых в лабораторной аналитике флюоресцирующих веществ – это карбоциклические органические красители.
Меру потери энергии называют «сдвигом Стокса», он определяет разницу между максимальными длинами волн возбуждающего и испускаемого света, которая для органических веществ обычно измеряется десятками нанометров. Время между возбуждением флюресцирующей органической молекулы и испусканием ею света занимает около одной стомиллионной доли секунды. Другое дело – флюоресценция лантанидов, здесь оно на пять порядков дольше – около 1 мс, сдвиг Стокса также сильнее выражен, достигая сотен нанометров.
Фосфоресценция
Она характеризуется большей по сравнению с флюоресценцией величиной сдвига Стокса и временем запаздывания испускания света – от 1 с-3 до нескольких часов.
Вещества, способные флюоресцировать, называются флюорофорами, их используют в клинической химии и лабораторной диагностике для количественного определения концентрации флюоресцирующего продукта по интенсивности его свечения и для того, чтобы метить различные компоненты биоматериала (как вещества, так и клетки), делая их доступными для исследования.
Интенсивность флюоресценции прямо пропорциональна концентрации флюорофора и интенсивности возбуждающего света. Ее величину обычно выражают в относительных единицах. Фактически прибор (флюорометр) улавливает лишь малую часть общей эмиссии флюоресценции, которая зависит от светосилы прибора (ширины щели), чувствительности детектора, эффективности монохроматора. Результаты измерения флюоресценции выражают в единицах концентрации, при использовании калибровки прибора по исследуемому веществу либо по специальному эталону, который в химическом отношении может не иметь ничего общего с исследуемым аналитом, но обладать такой же флюоресценцией.
Преимущества флюоресценции заключаются в простоте измерения, высокой специфичности и чувствительности. К недостаткам относятся зависимость результата от многих факторов, что сказывается на линейности калибровочных графиков. Сюда относится насыщение флюоресценции (эффект внутреннего тушения), побочные эффекты, вызванные рассеиванием, неспецифической флюоресценцией растворителя, матриксом пробы. Эффект внутреннего тушения состоит в потере интенсивности возбуждения при прохождении света через раствор из-за его абсорбции.
Некоторые кварцевые стекла и пластинки содержат материалы. поглощающие ультрафиолетовый свет или флюоресцирующие. Помехой также является тушение флюоресценции из-за взаимодействия флюорофора с раствором, что приводит к потере энергии.
Пробы сыворотки и мочи содержат много веществ, способных флюоресцировать, поэтому матрикс (основа) пробы может быть источником неспецифической флюоресценции, например, обусловленной присутствием белка или билирубина. Свет рассеивается также большими молекулами белка и липопротеидными комплексами. Неспецифическое свечение фона – основная причина, лимитирующая чувствительность флюорометрических методов исследования.
Эффект флюоресценции используют в основном для определения флюоресцентных меток – веществ, специально добавляемых в аналитическую систему, которые химически ничего общего с аналитом не имеют, например акридин оранжевый, метилум-беллиферон, пропидиум йодид, этидиум бромид, родамин, флюоресцеин – 5-изотиоцианат (FITS) и др. Для каждого из этих соединений характерны собственные длины волн света возбуждения и света излучения. Метки могут быть молекулярные, когда метят определенные молекулы, и клеточные, когда метят исследуемые клетки или определенные участки на их поверхности. Менее распространен подход, когда в результате химических превращений молекула аналита превращается во флюоресцирующее соединение.
Поляризация флюоресценции
При прохождении через кристаллическую решетку (поляризатор) волны света ориентируются в одной плоскости, такой свет называется поляризованным. В силу броуновского движения молекулы в растворе не только непрерывно перемешиваются, перемещаясь в пространстве, но и хаотически вращаются. Время, за которое молекулы успевают равномерно распределиться в пространстве, называется временем релаксации. Соответственно говорят и о времени вращательной релаксации, как о том промежутке времени, который необходим для того, чтобы первоначально одинаково ориентированные молекулы оказались равномерно повернутыми в разные стороны. Для больших молекул этот промежуток времени длиннее, чем для маленьких.
Если время вращательной релаксации велико по сравнению со временем между поглощением кванта света и его эмиссией (затухания флюоресценции), то молекула флюорофора не успевает повернуться и свет эмиссии будет поляризован в той же плоскости, что и возбуждающий свет. Если молекула небольшого размера, то она вращается быстро и за время между поглощением света и его эмиссией успевает повернуться. Соответственно свет флюоресценции не будет поляризован в той же плоскости, что свет возбуждения, а будет деполяризованным. Таким способом можно оценить размеры молекулы. Этот эффект используют при выполнении гомогенных иммуноисследований.
Затухание энергии излучения
Принцип метода основан на прямо пропорциональной зависимости между измеряемой интенсивностью флюоресценции раствора, содержащего флюорофор, и абсорбции света этим раствором. Если абсорбция раствора более нуля, интенсивность флюоресценции будет затухать. Если в ходе реакции аналита с реактивом образуется хромоген, то он будет увеличивать светопоглощение и тем самым гасить интенсивность флюоресценции флюорофора. Чем больше аналита в биожидкости, тем больше образуется хромогена, и, следовательно, выше светопоглощение и больше затухание флюоресценции.
Флюоресценция с разрешением во времени
Чувствительность флюоресцентных методов в значительной степени зависит от помех, вызванных тем, что свет возбуждения примешивается к свету эмиссии, а также неспецифической флюоресценции исследуемого биологического объекта. Если сдвиг Стокса (т.е. различие в длинах волн света возбуждения и эмиссии) велик, помехи меньше, потому, что удается «уйти» от света возбуждения флюоресценции и потому что у неспецифической флюоресценции сдвиг Стокса мал. Помехи можно уменьшить и, используя временную задержку (разрешение во времени), возбуждать флюоресценцию короткими импульсами света, а измерять ее через некоторое время, когда возбуждающий импульс уже угас. Технически это осуществимо только при условии, что время флюоресценции флюорофора велико. На этом основана флюоресценция с разрешением во времени (ФРВ). Флюоресцентные метки для ФРВ – лантаниды – обладают чувствительностью и избирательностью намного более высокими, чем у органических красителей, например флюоресцентна. По чувствительности они приближаются к радиоактивным меткам.
Измеряя флюоресценцию на разных длинах волн и через разные промежутки времени после освещения импульсом возбуждающего света, можно одновременно количественно определять несколько флюорофоров этой группы. Это позволяет использовать двойные метки, например одновременно пометить и измерять концентрации и антигена, и антитела, что значительно повышает точность определения.
Принцип ФРВ используют в некоторых анализаторах (например, Delfia фирмы «Wallac», Финляндия, или Kryptor фирмы «CIS Diagnostics»). Принцип связывания флюорофора с биологическими макромолекулами используется в иммунофлюоресцентном анализе (метка флюорофором антитела), в проточной иммуноцито-флюорометрии (метка флюорофором лимфоцитов и определение их подклассов с помощью меченых моноклональных антител), в флюоресцентном иммуноферментном анализе, в флюоресцентном иммуноанализе с использованием микрочастиц.
Хемилюминесценция
Свечение молекул, перешедших в возбужденное состояние в результате химической реакции, называется хемилюминесценцией. Чаще всего ее вызывают, окисляя определенные органические вещества перекисью водорода, гипохлоритом, молекулярным кислородом. Специальная форма хемилюминесценции биологического материала, когда каталитический белок, например люцифераза, повышает эффективность люминесцентной реакции, называется биолюминесценцией. Чувствительность определения с помощью биолюминесценции выше, чем при прямом флюоресцентном исследовании.
Принцип хемилюминесцентной детекции реализуется в вариантах хемилюминесцентных методик и хемилюминесцентной детекции ферментных меток в иммунохимических исследованиях. Основными хемилюминесцентными метками служат сульфонамиды и эфиры акридина, инициаторами их свечения выступает смесь пероксида водорода и гидроксида натрия. Регистрируются вспышки длительностью до 5 с, предел детекции эфира акридина 0,5 аттомоль (5-10-18). Хемилюминесцентная детекция ферментных методик чувствительнее и удобнее колориметрической или флюоресцентной детекции.
При хемилюминесцентном исследовании активности пероксидазы хрена используют комбинацию «люминол + окислитель + + усилитель». В качестве последнего применяют ароматические амины, арилбороновые кислоты, гидроксиацетанимиды, гидрокси-бензотиазолы, нафтолы, фенолы, тиофенолы.
Активность щелочной фосфатазы также может быть исследована хемилюминесцентным методом. В качестве субстрата используют адаматил-1,2-диоксиэтанарилфосфатные соединения. Порог определения щелочной фосфатазы при этом 1 цептимоль (602 молекулы фермента). Свечение длительное – более 30-60 мин.
В хемилюминесцентном варианте методики определения глюкозоксидазы используют смесь изолюминола и пероксидазы для определения пероксида водорода, образующегося под действием фермента на глюкозу.
Еще одним вариантом является электрохемилюминесценция, представляющая собой процесс возникновения свечения, при котором высокореактивные соединения, способные испускать свет, образуются из стабильных предшественников на поверхности электрода, к которому приложен положительный потенциал. Для этого можно использовать соединения рутения, осмия, рения и других элементов. В электрохемилюминесцентном методе, который реализуется на приборах Elecsys («Roche Diagnostics», Швейцария), в качестве метки применяется комплекс, который способен сопрягаться с аминогруппами белков, гаптенов и нуклеиновых кислот.
Бипиридиловые лиганды могут легко преобразовываться в форму активных хемилюминесцентных соединений. Моноклональные антитела, меченные рутением, сопрягаются с исследуемым антигеном, который захвачен другими моноклональными антителами, связанными с биотином и за счет стрептавидина прочно связанными с магнитными шариками диаметром 2,8 мкм. Под влиянием магнита магнитные частицы с иммунным комплексом, меченным рутением, привлекаются в зону контакта с рабочим электродом, в результате чего развивается электрохемилюминесцентная реакция, интенсивность которой регистрируется фотоумножителем.
Последовательность происходящих на поверхности положительного электрода процессов такова: окисляющийся под влиянием заряда электрода трипропиламин (ТПА) высвобождает протон и становится нестабильным радикалом, который в свою очередь, отдавая электрон образовавшемуся при контакте с электродом трехвалентному рутениевому бипиридилу, переводит его в возбужденную форму, способную, испустив фотон света с длиной волны 620 нм, возвратиться в исходное стабильное состояние. Таким образом, происходит хемилюминесцентная реакция, инициируемая электрическим зарядом электрода, что и дало название этому методу.
Приборы и оборудование для люминесцентного анализа
Приборы для измерения концентрации веществ по интенсивности флюоресценции называются флюорометрами. Приборы, в которых выделение спектрального интервала происходит с помощью щелей, линз или зеркал, а диспергирующими элементами служат призмы и дифракционные решетки, монохроматоры различного типа, называются спектрофлюорометрами. Для измерения люминесценции используют люминометры.
Любой прибор для измерения флюоресценции состоит из четырех компонентов: источника возбуждающего света; кюветы для измерения флюоресценции пробы; устройства, регистрирующего флюоресценцию – детектора; светофильтров или монохроматора для выделения длин волн возбуждающего и эмиттированного света.
Спектры абсорбции и, следовательно, возбуждения флюоресценции большинства флюоресцирующих веществ лежат в области 300-550 нм. Это позволяет использовать в качестве источников света в флюорометрах яркие лампы с широким спектром. Вольфрамово-галогеновые лампы применяют для измерений в видимой и ультрафиолетовой областях спектра. Они служат в течение длительного времени (2000-3000 ч до замены). Ртутные вакуумные лампы имеют прозрачные кварцевые колбы и возбуждают свет с длиной волны 254 нм или могут быть покрыты белым фосфором, который излучает свет с постоянным спектром от 300 до 405 нм. Дуговая ксеноновая лампа излучает постоянный свет в пределах 200-700 нм и может использоваться для получения как спектров возбуждения, так и флюоресценции.
Как и для фотометров, кюветы для флюорометров могут быть изготовлены из стекла, кварца оптической чистоты и пластмасс.
Поскольку свет флюоресценции рассеивается во все стороны, возможны различные варианты конструкций приборов. Чаще всего фотодатчик флюорометра (рис. 1.8) расположен под прямым углом к направлению возбуждающего света, что уменьшает засветки, снижающие чувствительность определения. Устройство прибора для анализа поляризации флюоресценции представлено на рис. 1.9.
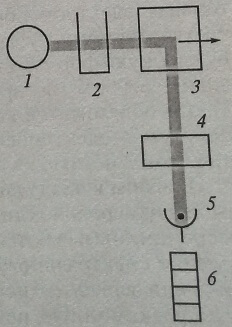
Рис. 1.8. Схема устройства флюорометра: 1 – источник света возбуждения; 2 – монохроматор (светофильтр) света возбуждения; 3 – кювета с исследуемым раствором; 4 – монохроматор (светофильтр) света флюоресценции; 5 – детектор; 6 – измерительный прибор
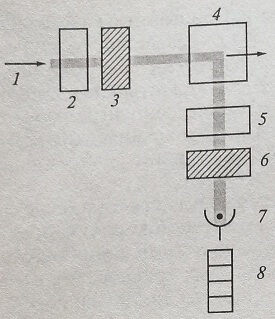
Рис. 1.9. Схема устройства анализатора поляризации флуоресценции: 1 – источник света возбуждения; 2 – монохроматор света возбуждения; 3 – поляризатор света возбуждения; 4 – кювета с исследуемым раствором; 5 – монохроматор света флюоресценции; 6 – поляризатор света флюоресценции; 7 – детектор; 8 – измерительный прибор
В люминометрах отсутствует необходимость возбуждения свето-излучения. Поэтому свет, излученный исследуемой средой, как правило, проходит через светофильтр, пропускающий поток излученной световой энергии в определенной полосе длин волн, и попадает в фотоприемник. Возможна как горизонтальная, так и вертикальная флюорометрия и люминометрия, двух-лучевое измерение.
Современные флюорометры, спектрофлюорометры и люминометры представляют собой анализаторы, которые в зависимости от устройства предназначены для ручного, полуавтоматического и автоматического выполнения различных методов люминесцентного анализа. Практически все они оснащены микропроцессорами, встроенными компьютерами, принтерами или имеют возможность подсоединения к персональному компьютеру и принтеру. Они часто оснащены также дозаторами реактивов, устройствами для термостатирования (инкубаторами) при проведении реакции и термостатированными кюветными отделениями, в том числе и при измерениях в планшетах.
Среди флюорометров выделяют приборы специального назначения для определения концентрации отдельных компонентов, например отечественный флюорометр ЗОНД для определения концентрации альбумина в сыворотке крови с одним флюорохромом и суммарной концентрации холестерина и триглицеридов – с другим, а также универсальные приборы для определения различных компонентов. Отечественный анализатор ФЛУОРАТ 02 АБЛФ сочетает в себе, в сущности, три прибора — фотометр, флюорометр и люминометр, а при оснащении проточной кюветой может быть использован в качестве флюорометрического детектора при высокоэффективной жидкостной хроматографии. Комбинация различных принципов измерений в одном приборе (одно- и двухлучевое измерение флюоресценции, выбор диаметра луча, вертикальная флюорометрия с направлением луча в кювету снизу или сверху, флюорометрия с разрешением во времени и пр.) применяется во многих моделях планшетных полуавтоматических анализаторов для различных видов люминесцентного анализа в иммунохимических и других исследованиях.
Области применения в клинической лабораторной диагностике
Методы люминесцентного анализа широко применяют в различных областях клинической лабораторной диагностики вследствие высокой чувствительности и специфичности. Основанные на флюоресцентном анализе, они применяются для определения различных аналитов в скрининге и диагностике различных заболеваний, а также наблюдении за их течением и эффективностью лечения.
Различные виды флюорометрии и люминометрии и разработанные для них наборы биохимических и иммунохимических реактивов применяют для определения концентрации альбумина, триглицеридов и холестерина в сыворотке крови, катехоламинов, продуктов их биосинтеза и обмена, гистамина, гистидина, серотонина и его метаболита – 5-оксииндолилуксусной кислоты, стероидов и их метаболитов, порфиринов, витаминов, аминокислот, меди и других микроэлементов, различных токсических веществ и продуктов их распада в организме, лекарств, наркотиков, исследовании цитотоксичности, для определения ДНК, РНК, экспрессии ДНК, захвата кальция, фагоцитоза, генной инженерии, подсчета бактерий в микробиологических исследованиях, обнаружения и дифференциации вирусов, факторов роста, компонентов комплемента, для количественного определения продуктов ПЦР, в исследованиях, основанных на анализе АТФ.
Спектр патологических состояний, для выявления, диагностики, выбора лечения которых могут быть применены флюоро- метрические и другие люминесцентные методы, чрезвычайно велик. Это – дифференциальная диагностика гипертоний, выявление опухолей, происходящих из клеток хромафинной ткани и симпатической нервной системы – феохромоцитом, симпатобластом, ганглионевром, диагностика карциноида, детского церебрального паралича, порфирий, различных генетических заболеваний, включая их неонатальный скрининг. Флюорометрические детекторы используют в различных системах для хроматографического анализа и, в частности, для высокопроизводительной жидкостной хроматографии, на анализаторах для определения гормонов, опухолевых маркеров, лекарств, антибиотиков, наркотиков и других препаратов, в диагностике токсикоманий.




