Определение pH: колориметрические и электрометрические методы
Определение pH любого раствора может быть проведено с помощью колориметрических или электрометрических методов.
Колориметрические методы
В основе колориметрических методов лежит свойство индикаторов изменять окраску между известными значениями концентрации водородных ионов.
1. Приблизительный метод с двухцветными индикаторами. Зная интервал перехода двухцветных индикаторов по Серенсеиу или Кларк-Лубсу можно легко получить приблизительные значения рн. В фарфоровую чашку наливают две капли одного из индикаторов, затем добавляют несколько капель исследуемой жидкости. Значение pH определяется учитывая, что известному интервалу pH соответствует определенная окраска индикатора.
2. Метод с универсальными индикаторами. В небольшую фарфоровую чашку вливают около 5 мл исследуемого раствора, затем добавляют 5 капель универсального индикатора, или продолжают добавлять индикатор до тех пор, пока окраска жидкости остается неизменной. Значение pH устанавливается по окраске раствора соответственно указаниям, приведённым в таблице IV или окраска жидкости сопоставляется с цветами на шкале, сопровождающей бутылку с индикатором, причем читается соответствующее значение pH. Сравнение следует проводить немедленно, поскольку оттенок жидкости изменяется вследствие наличия атмосферной углекислоты. Погрешность этого метода равна приблизительно pH 0,5.
3. Метод с индикаторной бумажкой. Индикаторная бумажка смачивается в исследуемой жидкости, вследствие чего она принимает различный цвет в зависимости от pH жидкости. Вслед за этим цвет бумаги сравнивается с цветами на шкале сопровождающей пакетик с индикаторной бумагой.
4. Метод с индикаторами и буферными растворами (Кларки Лубе; Мак Ильвейи Сервисен). Принцип определения основан на сравнении окраски между раствором в котором определяется значение pH и буферным раствором с известным значением pH. В оба раствора добавляют одинаковое количество индикатора, имеющего вираж в интервале, в котором находится искомое значение pH. Применяемые для сравнения эталоны содержат буферные растворы с известным значением pH и индикатора, подходящего для каждой области значения pH.
а) Приготовление эталонов для сравнения. В ряд пробирок одинаковой толщины, диаметра и из того же стекла вливают по 10 мл буферного раствора со значением pH, увеличивающимся постепенно через каждые 0,2 единицы, затем добавляют по 1 мл индикаторного раствора. На каждую пробирку наклеиваются этикетки с указанием соответствующего значения pH. Пробирки герметически запаиваются над пламенем или закупориваются парафинированной резиновой пробкой. Таким образом получают 6 серий эталонов (таблица XIII). Для серий I–V используются буферные растворы цитрат-фосфат (Мак Ильвейн, таблица IX), а для VI серии – буферные растворы борат (Кларк и Лубе, таблица VII).
б) Определение pH. К 10 мл вполне прозрачного исследуемого раствора (если жидкость сильно окрашена или концентрирована, ее разбавляют кипяченой и охлажденной бидистиллированной водой) добавляют 1 мл индикаторного раствора, затем сравнивают с серией эталонов до нахождения окраски, соответствующей цвету исследуемого раствора.
Для сравнения используется деревянный брусок с 4 отверстиями, в который с одной стороны вводится пробирка с исследуемой жидкостью -h индикатор, а позади нее – пробирка с дистиллированной водой. С другой стороны устанавливается эталон для сравнения, а позади него – пробирка с исследуемым раствором. Таким образом компенсируется собственный цвет или мутность исследуемого раствора.
а) Исследуемый раствор + индикатор а) Эталон для сравнения
б) Дистиллированная вода б) Исследуемый раствор
5. Метод с одноцветными индикаторами по Михаэлису. В принципе одноцветными индикаторами являются такие, окраска которых изменяется от бесцветной до какого-либо цвета в определенном интервале значений pH. Так, например, фенолфталеин, бесцветный в кислом или нейтральном растворе становится красным в щелочном растворе. Эти индикаторы являются весьма слабыми кислотами, диссоциирующие в водном растворе в той или иной мере в анионы, окрашенные в желтый цвет и в водородные ионы.
Недиссоциированный индикатор диссоциированный индикатор +H+. Практически максимальное диссоциирование достигается в растворе 0,01 н., в котором, следовательно, и индикатор достигает окраски максимальной интенсивности.
Числитель этого соотношения увеличивается, если в водный раствор такого индикатора ввести вещество, выделяющее ионы водорода. Это означает, что увеличивается также и значение К, и для того, чтобы это предотвратить, необходимо увеличить знаменатель, т.е. количество недиссоциированного индикатора. Если же наоборот, ввести вещество, выделяющее ионы ОН , на основании закона действия масс, индикатор диссоциирует, вследствие чего в растворе появляются ионы Н+ и таким образом окраска раствора будет более интенсивной.
Если в раствор с неизвестным значением pH добавить количество А индикатора, вираж которого происходит от бесцветности до окраски в интервале, в котором находится искомое значение pH, индикатор принимает известную окраску, соответствующую количеству диссоциированного индикатора.
В растворе карбоната натрия ОД н. все индикаторы, указанные в таблице XIV, полностью диссоциированы, в то время как в кислых растворах со значением pH менее 2,8 они совершенно не диссоциированы. Разумеется, что а-динитрофенол в водном растворе не диссоциирован при pH ® и полностью диссоциирует при pH = 4,5, причем желтый раствор является наиболее интенсивным. (3-динитрофенол в водном растворе также не диссоциирован при pH = 4,5 и полностью диссоциирует при pH = 5,5. То же самое можно казать и о водных растворах нитрофенолов.
Таким образом получаются 4 серии эталонов, состоящих из монохроматической гаммы, идущей от безцветности до ярко-желтой окраски, pH которых находится в пределах от 2,8 до 8,4. На каждой пробирке наклеивается затем этикетка с Указанием соответствующего значения pH, после чего пробирки герметически запаиваются над пламенем или закупориваются парафинированной резинкой или пробкой. Эти серии эталонов сохраняются в темноте.
Определение pH. Сначала проводится ориентировочное определение с помощью лакмусовой бумажки для того, чтобы уточнить интервал необходимого pH, соответственно индикатор, который нужно применить.
К 6 мл совершенно прозрачного исследуемого раствора добавляют 1 мл индикаторного раствора, затем сравнивают с серией эталонов, до выявления цвета соответствующего окраске исследуемого раствора.
Примечания. Все реактивы и индикаторы, применяемые для колориметрических методов, калибруются электрометрическими методами.
Растворы применяемые для определения pH должны быть приготовлены с использованием бидистиллированной воды, кипяченой в течение 10 минут и охлажденной, не находившейся в контакте с атмосферной углекислотой.
Электрометрический метод
Для определения pH с помощью этого метода используются так называемые потенциометры. Ниже приводим схематическое описание только принципа работы этих приборов, поскольку подробности их применения указаны в пояснениях прилагаемых к каждому прибору. Схематически потенциометр состоит из компенсационной схемы (рис. 1). Ас представляет собой источник тока, (аккумулятор напряжения в 1 вольт. Обычно это простой элемент Вестона). Длина моста АВ составляет 1 м, и, следовательно, на каждый сантиметр приходится перепад потенциала в 1/100 в = 0,01 вольт. D представляет собой гальванический элемент, состоящий из раствора, pH которого подлежит определению, и системы электродов. Определение pH сводится измерению электродвижущей силы этого гальванического элемента по сравнению с известной электродвижущей силой элемента Ас. Момент, когда обе электродвижущие силы одинаковы, указывается гальванометром С, используемом в качестве «нулевого прибора». По АВ, до тех пор, пока подвижной контакт С передвигается по мосту стрелка гальванометра не займет нулевое положение.
Если в нулевом положении гальванометра подвижной контакт С находится на расстоянии 65 см от точки А, электродвижущая сила элемента С составит: 0,01 в х65см = 0,065 в. Зная электродвижущую силу (Е), можно высчитать значение pH при помощи известной формулы pH.
Техника определения. Компенсационная установка подключается к источнику тока, после чего, вращая кнопку, подвижной контакт С перемещается до тех пор, пока стрелка гальванометра не останется в нулевом положении. В измерительный сосуд вливают 2–3 мл раствора, pH которого необходимо определить, затем добавляется щепотка кингидрона, таким образом, чтобы нерастворившимся осталось едва видимое количество. Раствор взбалтывается в течение нескольких секунд, вставляются пробки с термометром и соответствующий электрод и затем электрод сравнения (каломель) подключается к отрицательному полюсу, а измерительный электрод (кингидрон) – к положительному. Затем компенсация производится снова, перемещая подвижной контакт С до тех пор, пока стрелка гальванометра не остановится в нулевом положении. Делается отсчет электродвижущей силы Е (или непосредственно значения pH) и температуры, при которой производилось определение. После этого значение pH корректируется для температуры 18 при помощи приложенной к прибору диаграммы.
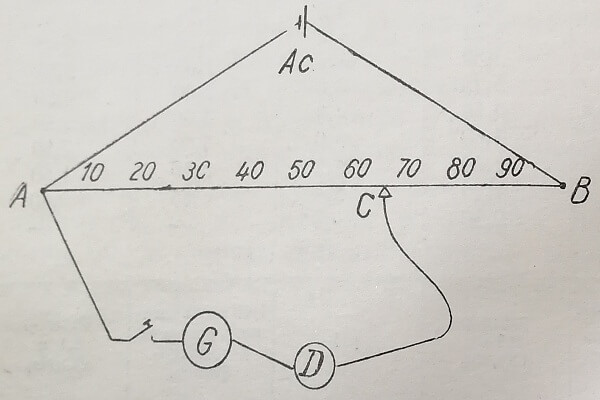
Рис. 1. Схема компенсационного монтажа для определения pH.
Таким образом, были созданы новые дисциплины, среди которых следует отметить медицинскую физику. Нет никакого сомнения в том, что эта последняя научная отрасль имеет преобладающую роль среди дисциплин, способствовавших достижению крупных успехов в биологии.
В течение целого ряда лет, химические методы исследования в биологии были всемерно усовершенствованы и обновлены, что обусловило разработку особо точных способов идентификации и определения компонентов, входящих в состав живого вещества. Такого рода методы были приспособлены либо для проведения обычных дозировок, осуществляемых для патологических продуктов, либо для более тонких определений, применяемых главным образом при наиболее полном анализе того или иного биологического препарата. Эта последняя группа методов, в связи природой и преследуемой целью, нуждается в более дифференциронной аппаратуре и более многочисленных операциях – обстоятельства, которой мере ограничивающие их применение в практике.
Среди специальных биохимических методов, применяемых в настоящее время в биологическом исследовании, в настоящей главе будут описаны метрические и спектрометрические методы, хроматографический анализ и электрофорез. Благодаря особому характеру аналитических методов с применением радиоактивных изотопов, эти последние способы не могут быть описаны в рамках настоящей работы.