Хроматографический анализ биохимических препаратов
В 1906 году русский ботаник Цвет разработал метод селективной адсорбции, с помощью которого удалось фракционировать сырой хлорофил. Метод состоит в пропускании растворенного в петролейном эфире или бензоле препарата через колонну, содержащую адсорбенты (мел, окись алюминия, сахар), селективно удерживающие различные компоненты, располагающиеся послойно. Затем каждый слой растворялся в определенном растворителе и таким образом достигалось разделение компонентов (элюция).
Дифференцированная адсорбция с последующей элюцией адсорбированного материала – метод разработанный Цветом – лежит в основе «хроматографического анализа». Ныне этот способ широко применяется в биологии для выделения компонентов из исследуемого раствора.
Явление адсорбции соответствует способности некоторых твердых тел допускать прилипание на их поверхности молекул, присутствующих в растворе, с которыми они находятся в контакте. Это явление основано на поверхностном химическом соединении, по-видимому за счет связей типа Ван дер Ваальса.
Активированный уголь можно получить обугливанием в точно определенных условиях некоторых растений (так например, уголь типа «норит» получается в результате обугливания виноградной лозы).
Во время операции, находящиеся в растении минеральные соли подвергаются преобразованию, придающему им определенную ориентацию на поверхности угля, причем однако они не теряют свою растворимость.
Одним из часто применяемых адсорбентов является алюминий, в виде гидратного геля, – осадок, обладающий значительной адсорбционной способностью, главным образом в связи с небольшими размерами зерен. Метод получения этого адсорбента был разработан Вильдштеттером (1919).
В 600 мл дистиллированной воды растворяют 22 г кристаллизованного сульфата аммония. Раствор нагревают до 63°С и добавляют 100 мл 10% аммиачного раствора (свежеприготовленнного разбавлением 20% раствора аммиака равным объемом дистиллированной воды). В то же время в 150 мл дистиллированной воды растворяют при нагревании (58°), 76,7 г аммиачных квасцов А12 (NH4)2 (S04)4-24 НаО. Квасцовый раствор вливается затем в исходный раствор; перемешивают медленно(10минут),непрерывно взбалтывая, поддерживая температуру 63°С.
Таким образом получают 900 мл жидкости молочного цвета, однако содержащей значительное количество электролитов. Для удаления последних жидкость подвергается продолжительному центрифугированию, затем осадок снова переносят в 750 мл дистиллированной воды, содержащей 5 мл концентрированного аммиака. После образования взвеси осадок снова центрифугируется, надосадочная жидкость удавляется, а центрифугат переводят в аммиачную воду. Промывание повторяется три – четыре раза. Когда осадок уже не содержит электролитов, он становится гелеобразным с выраженной тенденцией к осаждению. После этого его переводят в 90 мл дистиллироващюй воды и оставляют в течение двух недель при комнатной температуре для «созревания». Таким образом приготовленный гель обладает наиболее высокой активностью.
Адсорбционный процесс отличается целым рядом особенностей, изученных Фрейндлихом. Так, например, адсорбция того или иного вещества зависит от поверхности адсорбента. Один и тот же адсорбент может адсорбировать несколько веществ; эти вещества могут взаимоменяться, в зависимости от их сродства по отношению к адсорбенту. В комплексных биологических средах адсорбция в основном проявляется на молекуле отличающейся наибольшим молекулярным весом и характеризующейся наиболее высокой реакционной способностью. Подобными веществами являются те, которые имеют наибольшую электрическую плотность.
Изменяя электрическую плотность адсорбированного вещества, можно осуществить его адсорбцию, процесс известный под названием «элюции».
Элюция обычно не может быть проведена только с помощью воды. Для ее осуществления необходимо изменить pH среды, что влечет за собой изменение электрической плотности адсорбированного вещества. Так, например, для элюции адсорбированных белков вполне достаточно работать в слегка щелочной среде, используя буферные фосфатные среды. Элюция происходит тем легче, чем ниже температура, при которой имел место контакт с адсорбентом и чем короче период контакта.
Адсорбированные вещества могут быть замещены даже посредством какого-либо другого вещества, обладающего аналогичными химическими свойствами, если это последнее обладает более высокой валентностью. И наоборот, адсорбированное тело не может быть элюировано с помощью вещества меньшей валентности. Когда оба вещества характеризуются идентичными функциями и валентностью, замещение осуществляется веществом, находящимся в более высокой концентрации.
Для проведения хроматографических анализов существуют два способа: хроматография на колонке и хроматография на бумаге. В то время как хромотография на колонке широко применяется для выделения вещества растворимого в органических растворителях, хроматография на бумаге используется для отделения водорастворимых веществ (Смирнова и Чулкова).
Хроматография на колонке
В основе хроматографии на колонке лежит принцип селективного процесса адсорбции определенного вещества на другом инертном веществе. В основном в качестве адсорбента можно использовать любой порошкообразный материал, который обладает достаточной адсорбирующей способностью в отношении выделяемого вещества. Кроме того, адсорбент не должен вступать в реакцию с удерживаемыми им веществами и не должен растворяться в используемом для элюции растворителе.
Наиболее часто применяемые адсорбенты приведены в таблице XX (по Менье).
В настоящее время в качестве адсорбентов широко используются ионообменные смолы. В таблице XXI указаны некоторые из наиболее часто применяемых ионообменных смол и целлюлоз.
Для проведения адсорбции адсорбент, подходящий для данного определения, равномерно уплотняется в применяемой для адсорбции трубке. Эта последняя может быть представлена обычной стеклянной трубкой (Цвет)8. В настоящее время предпочитают более сложное приспособление, состоящее из пористой трубки с достаточно малым внутренним диаметром, вводимой в другую стеклянную трубку.
Адсорбент вводится либо внутрь пористой трубки, либо вне ее, причем анализируемый раствор вливается в незанятое адсорбентом пространство. Таким образом, компоненты раствора диффундируют через стенки пористой трубки и вступают в контакт с частицами инертного вещества. Из пространства, в котором находится адсорбент, жидкость выходит через его нижнюю часть, где расположен пористый фильтр (или ватный тампон), удерживающий твердые частицы и регулирующий быстроту стока. По мере того, как компоненты раствора вступают в контакт с частицами инертного вещества, имеет место их селективная адсорбция. Наиболее быстро адсорбирующиеся компоненты расслаиваются в первую очередь, после чего происходит расслоение труднее адсорбируемых веществ.
Вся система адсорбционной колонки вводится в пробку колбы Китасато. Таким образом создается возможность сбора фильтруемого раствора, а также вакуумное регулирование скорости фильтрации.
Подвергаемый адсорбции препарат предварительно подлежит соответствующей обработке, с целью как можно более полного удаления остальных компонентов, отделение которых не производится. Так, например, если целью осуществляемой хроматограммы является отделение липидных компонентов в каком-либо препарате, этот последний подвергается спиртной экстракции, вызывающей осаждение белков и полисахаридов, причем одновременно отделяются связанные липиды. Затем экстракция продолжается эфиром и, наконец, хлороформом. Таким образом, экстрагированные липидные вещества собираются вместе, растворяются в подходящем растворителе и этот раствор (содержащий весьма незначительнное количество примесей, состоящих из белковых или глюцидных макромолекул) подвергается адсорбции на колонке.
Адсорбирующая фильтрация производится следующим образом.
В пространство, в котором находится уплотненный адсорбент, накапывают небольшую часть анализируемого раствора, сколько необходимо для пропитки адсорбента. Затем жидкость вводится в свободное пространство, и таким образом начинается фильтрация. Благодаря медленной фильтрации жидкости образуются зоны расслаивания выделенных компонентов. Однако, если фильтрация происходит слишком медленно, жидкость может испариться (а в случае бензола может иметь место даже его замораживание). Во избежание этих неудобств, фильтрацию можно ускорить, применяя положительное или отрицательное давление.
После того как весь раствор прошел через колонку, добавляют еще некоторый объем растворителя, чем ускоряется выделение расслоенных зон. Если это промывание производится в достаточно обильном количестве (количество растворителя должно быть в 3–5 раз больше количества исходной жидкости), практически можно достигнуть полного отделения слоев. Если эти последние имеют различную окраску, в подобных условиях их наблюдение не представляет каких-либо затруднений. Эта операция известна под названием« проявления хроматограммы».
В случае, когда разделенные соединения оказываются бесцветными, для идентификации слоев могут быть использованы различные методы. Один из этих методов состоит в освещении колонки ультра-фиолетовыми лучами, в результате чего происходит флуоресценция определенных адсорбированных соединений (Каррер). Можно применить также цветные реакции, причем сильно разбавленный реактив пропускается в небольших количествах через колонку.
В качестве элюирующих веществ могут быть использованы обычные растворители, к которым добавляется 1–2% метанола, этанола или пиридина. Элюцию можно произвести даже применяя только чистый этанол.
Для произведения элюции колонка адсорбирующего вещества извлекается из трубки (посредством давления, сушки и др.) с особой тщательностью, для того, чтобы ее не повредить. Затем, с помощью тонкого шпателя колонка разделяется соответственно линиям разграничения между слоями, причем каждый слой переносится в сосуд (центрифугальную пробирку), заполненный элюантом. Взбалтывается, оставляется на промежуток времени достаточный для десорбции, затем центрифугируется, причем удаляется инертный адсорбент.
В случае, когда расслоенные зоны не различаются достаточно четко, можно произвести ряд последовательных экстракций всей колонки с помощью различных смесей растворителей, к которым добавляются возрастающие концентрации элюанта (спирты, пиридин). Затем, каждая экстракционная смесь сохраняется и исследуется отдельно.
Метод хроматографии на колонке довольно часто применяется в биохимии, главным образом для контроля лекарственных средств, пищевых продуктов и др. Он является быстрым и простым способом для оценки степени чистоты того или иного продукта, а также способствует идентифицированию двух разных продуктов. Хроматографический метод на колонке дает возможность также произвести химический анализ витаминов А и Е.
Для наглядности, приводится последовательность операций проводимых в ходе хроматографического анализа в колонке, например, определения токоферола в кровяной сыворотке.
Принцип метода состоит в задержании на колонке кислой глины, каротеноидных пигментов, лецитинов и стероидов, экстрагированных вместе с токоферолом из сыворотки. Затем, отфильтрованный токоферол дозируется восстановлением с помощью феррицианида железа.
Для определения, 10 мл свежей кровяной сыворотки переводятся в колбу и взбалтываются с 50 г безводного Na2S04. Затем, смесь обрабатывается 30 мл хлороформа, при механическом перемешивании в течение 10 мин и фильтруется. Нерастворимый осадок снова экстрагируется хлороформом. Оба полученные фильтрата переводятся в колбу емкостью в 125 мл, растворитель выпаривается, а экстракт повторно растворяется в 50 мл бензола.
Одновременно достаточное количество глины обрабатывается в течение одного часа с орошением одинаковым объемом концентрированной НС1, затем промывается до полного удаления следов кислоты. После этого, подвергается сушке при 60 градусов Цельсия и сохраняется в эксикаторе с хлористым кальцием.
Таким образом обработанным глинистым порошком, посредством уплотнения заполняется адсорбционная трубка размерами 140x10 мм. Затем, вводится бензольный раствор и производится медленное хроматографирование. Содержавшая раствор колба промывается 20 мл бензола, который добавляется в фильтр. В заключение колонка промывается еще 30 мл чистого бензола.
Все отфильтрованные жидкости собираются в одну общую колбу, затем бензол выпаривается на водяной бане. В осадок добавляется небольшое количество хлороформа (3 мл) и переводится в мерную колбу на 5 мл. Объем доводится до метки хлороформом, которым смываются остатки осадка.
Определение токоферола восстановлением феррицианидом железа производится на 0,5 мл этого последнего раствора. В присутствии токоферола получается зелено-коричневая окраска.
Применение ионообменных смол для разделения биохимических компонентов из биологических препаратов, является в настоящее время широко используемым методом биохимического исследования.
Ионообменные смолы представляют собой разветвленные полимеры с большим молекулярным весом, практически нерастворимые в воде или органических растворителях, содержащие ионные группы (катионы или анионы), обратимо изменяющиеся за счет удержания ионов с обратным знаком из растворов, с которыми они находятся в контакте. Благодаря этим свойствам ионообменные смолы применяются для очистки и разделения компонентов из биологических препаратов, причем принцип их применения аналогичен описанному для обычно используемых адсорбентов в хроматографии на колонке.
До их введения в колонку, обычно, ионообменные смолы выдерживают в дистиллированной воде в течение 1–2 часов. Наполнение колонки (высота которой должна быть примерно в 10–20 раз больше диаметра) осуществляется с особой тщательностью для того, чтобы не допустить образования воздушных пузырьков. Затем смолы в колонке последовательно промываются разбавленной кислотой, горячей дистилированной водой, разбавленной щелочью и затем снова горячей дистиллированной водой.
В случае наличия окрашенных примесей можно с успехом применять промывание органическими растворителями.
Аналогичная обработка производится для регенерации смол, после их использования в качестве адсорбентов.
После того, как смола в колонке была подвергнута соответствующему промыванию (к концу деионизированной дистиллированной водой), медленно добавляется исследуемый раствор. После пропускания этого раствора, примерно 1% общей емкости колонки может быть использован для проявления. Затем, после предварительного промывания дистиллированной водой можно приступить к дифференцированной элюции адсорбированных компонентов.
В качестве примера приводятся несколько способов разделения ряда аминокислот с помощью ионообменных смол.
В основе принципа этого метода лежат изоэлектрические точки аминокислот:
- кислые аминокислоты с изоэлектрической точкой при pH 2,77–3,22 (аспартиновая кислота, глютаминовая кислота и моноамино-дикарбоновые кислоты);
- нейтральные аминокислоты, с изоэлектричечской точкой при pH 5,6–6,3 (серин, треонин, пролин, гидроксипролин, глицин, аланин, валин, лейцин, изолейцин, метионин);
- основные аминокислоты, с изоэлектрической точкой при pH 7,59–10,76 (гистидин, лизин, гидроксилизин, аргинин).
Отдельную группу аминокислот образуют ароматические аминокислоты (фенилаланин, тирозин, триптофан), которые можно селективно разделить с помощью активированного угля или посредством сильно кислых катионовых смол.
Раствор содержащий смесь подвергаемых разделению аминокислот обычно приготовляют в 5% уксусной кислоте. Этот раствор пропускается через ряд состоящий из трех колонок:
- колонка с активированным углем, предварительно обработанным 5% уксусной кислотой;
- колонка с карбоксиловой катионовой смолой (КВ и КМ, СССР; Амберлит IRC-50, США; Леватит CNO, ФРГ; Микион – МКМ, ВНР; Вофатит CN, ГДР; Зео-Карб 216-226, Англия), предварительно массивно обработанная (10–15 циклов) НС1 1 н и NaOH 0,5 ни промытая 20% уксусной кислотой;
- колонка с сульфонированной катионвой смолой (CS–1,РНР); КУ, СССР; Амберлит IR или Довекс 30–50 (США).
В первой колонке (активированный уголь) удерживаются ароматические аминокислоты. После промывания этой колонки 5% уксусной кислотой и затем 20% уксусной кислотой ароматические аминокислоты элюируются 20% раствором фенола в уксусной кислоте.
Во второй колонке (карбоксиловые катионовые смолы) задерживаются основные аминокислоты. После промывания эти последние элюируются раствором НС1 1 н.
Нейтральные аминокислоты, удерживаемые на последней колонке вместе с дикарбоновыми кислотами, элюируются НС1 1 н. Этот элюант выпаривается досуха, снова добавляется вода и затем его пропускают через колонку анионовой смолы (ПЕК, СССР; Амберлит IR-45 или Довекс-3, США), с которой – посредством обработки водой – элюируются нейтральные аминокислоты, а с помощью обработки НС1 н. элюируются дикарбоновые кислоты.
Разделение глютаминовой кислоты и аспартиповой кислоты (дикарбоновые аминокислоты) осуществляется пропуская аминокислотный раствор через колонку содержащую Амберлит IR– 4В, Довекс – 50–Х8 лии 50–Х4 (пропускающую основные и нейтральные аминокислоты). Последующая обработка колонки 0,05% уксусной кислотой селективно элюирует глютаминовую кислоту.
Разделение основных аминокислот осуществляется посредством катионовых смол. После гидролиза с орошением протеина при применении НС1 6 н., гидролизат обесцвечивается активированным углем, а избыток НС1 удаляется выпариванием. После этого, раствор пропускается через колонку со смолой Амберлит IR–4В (удерживающую дикарбоновые аминокислоты) и затем через колонку со смолой Амберлит-100 (удерживающую основные аминокислоты и пропускающую нейтральные аминокислоты). Элюцию можно произвести с помощью разбавленного щелочного (аммиачного) раствора.
Хроматография на бумаге
Метод основан на различной растворимости веществ, находящихся в смеси в известном растворителе (Пустовалов)2. Каплю смеси наносят на полоску фильтровальной бумаги, примерно на расстоянии 10 см от одного из концов. На той же линии наносят несколько других капель из растворов известных (контрольных) веществ, наличие которых в смеси предполагается. После высушивания, один конец фильтровальной бумаги вводится в кювету (стеклянную, фарфоровую, пластмассовую), содержащую растворитель. За счет капиллярности этот раствор пропитывает фильтровальную бумагу. Вся система вводится в закрытую камеру, в которой выделяются пары растворителя, образуя, таким образом, атмосферу благоприятную для равномерной и достаточно быстрой пропитки фильтровальной бумаги.
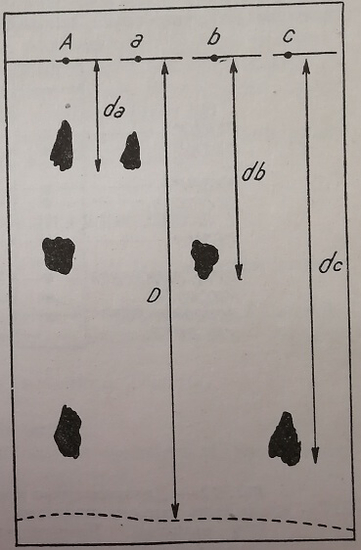
Когда уровень растворителя достиг находящихся на фильтровальной бумаге капель (образец и контрольные образцы), соответствующие вещества начинают перемещаться вместе с растворителем. Однако, скорость их передвижения не равна скорости растворителя, а прямо пропорциональна степени растворимости каждого вещества в используемом растворителе. Таким образом, когда растворитель прошел расстояние D, каждое увлекаемое вещество прошло меньшее расстояние (d), в зависимости от степени его растворимости. Соотношение d/D, обозначаемое символом rf, характеризует увлекаемое вещество. Это соотношение не зависит от значения D, а также от концентрации определяемого вещества. Все же, по еще неизвестным причинам значение rf какого-либо вещества, даже тогда, когда работают в одинаковых условиях, может отличался от одной хроматограммы до другой. Поэтому для каждой хроматограммы необходимо пользоваться контрольными образцами.
После того как орошение хроматограммы заканчивается (растворитель перемещается почти до противоположного конца фильтровальной бумаги) бумагу вынимают из хроматографировочной камеры и высушивают (при температуре лаборатории или в сушильном шкафу 100°С). После сушки бумага опрыскивается окрашивающим реактивом, специфичным для определяемых веществ. Контакт с этим реактивом (обычно сушка в горячем воздухе) ведет к появлению характерного окрашенного пятна на месте, в которое перешло исследуемое вещество, т.е. на расстоянии d от точки, в которой находилась капля раствора. Эта операция соответствует проявлению хроматограммы. Измеряя значения rf различных пятен образца и сравнивая их со значением rf пятен контрольных образцов, можно идентифицировать компоненты анализируемого препарата (рис. 11).
Рис. 11. Хроматограмма на бумаге смеси, состоящей из трех компонентов
Помимо непосредственной идентификации посредством проявления хроматограммы, можно также использовать идентификацию химическим способом.
Для этого на полоску фильтровальной бумаги наносят две капли пробы на расстоянии 3–4 см одна от другой.
Хроматограмма орошается соответствующим растворителем, высушивается и затем разрезается пополам вдоль линии, разделяющей обе капли пробы. Одна из этих двух разрезанных частей проявляется и затем, прикладывая ее к непроявленной части, можно идентифицировать на этой последней уровень содержащихся в ней пятен.
На этом растворе проводится затем химическое идентифицирование вещества, наличие которого предполагается на этом уровне.
Метод элюции дает возможность провести количественное определение разделенных хроматографированием компонентов.
Для повышения чуствительности метода можно прибегнуть к двухмерной хроматографии (рис. 12). Этот способ состоит в орошении той же фильтровальной бумаги, производимом дважды последовательно в прямоугольных направлениях, используя каждый раз другой растворитель. В подобных случаях рекомендуется проводить параллельно две другие контрольные хроматограммы, причем каждая из них подвергается только одному орошению одним из растворителей.

Рис. 12. Двухразмерная хроматограмма смеси аминокислот. Растворитель первого орошения: фенол насыщенный аммиачной водой (1% аммиака). Растворитель второго орошения: м-бутанол 4 части + ледяная уксусная кислота 1 часть + вода 5 частей.
Для успешного осуществления хроматограммы необходимо учитывать ряд условий, которым должна соответствовать как бумага, так и используемые растворы.
Фильтровальную бумагу следует выбирать в зависимости от применяемого растворителя, так как необходимо, чтобы скорость пропитывании (орошения) была невысокой. Среди типов фильтровальной бумаги лучше всего соответствующих этим требованиях следует считать: Ватманн № 1, Дюрье № 12, Ватманн № 2 и 4, Шлейхер и Шюлль № 597 и др. растворители (подвижная фаза). Для выбора растворителя не существует каких-либо общих правил. Для получения соответствующих результатов экспериментально испытываются несколько имеющихся в распоряжении растворителей. При этом однако следует отметить, что наибольшая часть применяемых растворителей не смешивается с водой характеризующейся гидроксильными функциями. В этом направлении следует особо отметить н-бутиловый спирт, применяемый в весьма широком масштабе. Перед применением растворители насыщаются водой – операция производимая в разделительной воронке. Часто, для того, чтобы увеличить возможность насыщения, к растворителю добавляется промежуточное вещество (например, уксусная кислота).
Растворы, анализируемые хроматографическим способом, могут быть самого разнообразного происхождения. Однако, они не должны содержать значительное количество солей (менее 1 %), так как присутствие ионов изменяет значение rf дозируемых веществ. Удаление ионов из растворов, когда разбавление не может обеспечить достаточное снижение концентрации может быть проведено посредством диализа. По мере возможности эти примеси должны быть предварительно удалены.
Анализируемые растворы наносят на фильтровальную бумагу в виде небольших капель (0,03–0,05 мл), которые должны содержать от 5 до 150 микрограммов анализируемого вещества.
Разумеется, что используемые в хроматографии проявители должны быть специфичными для анализируемых веществ. Большинство проявителей – это реактивы, с помощью которых получаются цветные реакции. Вместе с тем применяются и другие, более тонкие методы, как например: флуоресценция в свете Вуда, фотографическая запись поглощения фильтруемого излучения, радиоактивные меченые индикаторы и др.
Что касается проявителей, для каждой группы веществ, анализируемых хроматографическим способом, имеются специальные указания.
Хроматографический анализ пуриновых и пиримидиновых оснований
Анализ можно произвести непосредственно на растворах содержащих эти вещества в свободном состоянии. В случае, когда необходимо проанализировать компоненты нуклеиновых кислот, их следует предварительно подвергнуть гидролизу.
Шаргафф 1 выделяет аденин и гуанин, находящиеся в нуклеиновых кислотах, гидролизируя эти последние в H2S04 н. в течение 1 часа при 100 °С (орошение). Выделение пиримидинов нуждается однако в более энергичном гидролизе, производимом в концентрированной муравьиной кислоте. Для этого, приблизительно 15 мг дезоксирибонуклеиновой кислоты переводятся в ампулу, в которую добавляют 0,5 мл 98% муравьиной кислоты. Ампула запаивается и подогревается в течение получаса в шкафу отрегулированном на 175°С. После охлаждения ампула осторожно открывается и затем в течение нескольких минут ее выдерживают в бане с кипящей водой, увлекая пары муравьиной кислоты воздушным потоком. После того как гидролизат полностью испаряется, остаток снова растворяется в 0,5 мл НС1 н. для хроматографирования.
В случае рибонуклеиновой кислоты рекомендуется проведение щелочного гидролиза (аммиак pH 13,5), в течение 6–8 дней, при 30–45°С. После гидролиза для хроматографирования pH раствора доводится до 5.
Для гидролиза обеих нуклеиновых кислот можно также использовать с хорошими результатами хлорную кислоту 12 н а.
Растворители, применяемые для орошения пуриновых и питмидиновых оснований приводятся ниже:
- хинолин 3 части коллидин 1 часть;
- фенол 8,5 частей + изопропанол 0,5 частей, + муравьиная кислота 0,1 части + вода 1 часть;
- изопропанол 65 частей + соляная кислота 15 частей + вода 20 частей;
- н-бутанол 5 частей + соляная кислота 1 часть - вода 4 части (особенно для пиримидиновых оснований);
- н-бутанол 4 части - морфолин 0,2 части + диэтиленгликол 0,3 части + вода 4,5 части (для орошения пуриновых оснований).
Для проявления хроматограмм с пуриновыми и пиримидиновыми основаниями, Вишер и Шаргафф опрыскивают фильтровальную бумагу раствором Ag(N03)2 0,25 м в HNOs 0,5 м. Этот реактив преобразует пуриновые и пиримидиновые основания в ртутные производные черного цвета. Избыток реактива следует промыть затем сернистым аммонием.
Для проявления нуклеотидов (и других фосфатов, как например, фосфатов сахаров) можно использовать реактив молибденовой кислоты 2: смешиваются 5 мл раствора НС104 (содержащего 1,61 г) и 10 мл НС1 н., с 25 мл 4% раствора молибдата аммония и 60 мл воды. Орошенная и высушенная хроматограмма обрызгивается реактивом, подогревается 7 минут при 85°С (для гидролиза органических фосфатов) и затем подвергается действию паров H2S в течение 5–10 минут. Там, где находятся фосфаты, появляются синие пятна.
Для проявления пентоз в нуклеозидах для опрыскивания можно использовать 2% раствор м-фенилендиамина в 70% этаноле; после подогревания 5–10 минут при 105 °С появляются коричневые пятна.
Дезоксирибонуклеозиды могут быть обнаружены посредством солянокислого цистеина (0,5% раствор в H2S04 3 н.); после опрыскивания и подогревания в течение 5–10 минут при 85°С появляются розовые пятна.
Более быстрый метод проявления разработали Маркгем и Смит3. Он основан на селективной абсорбции ультрафиолетового спектра (2540 К) пуриновых и пиримидиновых оснований. Метод состоит в прикрытии хроматограммы светочувствительной бумагой, вкладывании этой системы между двумя кварцовыми пластинками и облучении ультрафиолетовыми лучами, отфильтрованными на 2540 А. После проявления светочувствительная бумага даст черный фон с белыми пятнами, указывающими на присутствие пуриновых и пиримидиновых хроматографированных оснований (рис. 13).
В случае метода Маркгема нельзя использовать фенол или коллидин для орошения, так как эти вещества поглощают ультрафиолетовые лучи с длиной волны‘около 2600 А. Поэтому рекомендуется смесь: трет– бутанод 700 мл + концентрированная соляная кислота 132 мл # вода 168 мл.
Хроматографическое микроопределение пуриновых и пиримидиновых оснований. С помощью метода проявления по Маркгему распределение пятен образуемых пуриновыми и пиримидиновыми основаниями на хроматограмме, может быть легко установлено. Соответствующие пятна вырезываются и подвергаются элюции, а именно каждое пятно в 4 мл НС1 0,1 н. в течение 12–16 часов. Параллельно поступают таким же образом с пятнами контрольных образцов.
В этих условиях можно получить 96% рекуперацию используемого для орошения вещества.
После элюции растворы спектрофотометрируются (аппарат Бекмана; кюветки 1 см толщины; нулевой пункт аппарата отрегулирован на кювете, содержащей НС1 0,1 н.).
Проверка интенсивности абсорбции на контрольных образцах, приготовленных посредством орошения, вырезывания и элюции (см. выше), является обязательной, так как используемая хроматографическая бумага может вовлечь в элюат некоторые вещества обладающие аналогичной поглотительной способностью.
Максимальными уровнями абсорбции (в ангстремах) и погашения (е) контрольных растворов с концентрациями 10 у/мл, в описанных условиях (растворитель НС1 0,1 н., спектрофотометрические кюветы 1 см толщины) являются следующие:
Гуанин: 2 500 А; е = 0,73; тимин: 2 650 А; е = 0,63;
Аденин: 2 600 А; е = 0,96; цитозин 2 750 А; е = 0,95;
Урацил: 2 600 А; е = 0,705; 5-метил-цитозин 2 830 А; е = 0,785.
Обычно получаемые результаты выражаются в количестве, молекул оснований, имеющихся в растворе на каждые 100 атомов, присутствующего Р.
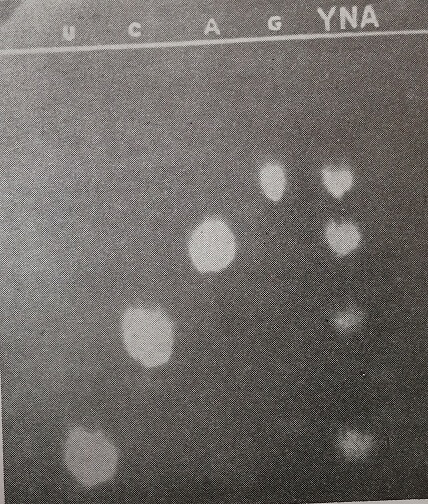
Рис. 13. Хроматограмма гидролизата рибонуклеиновой кислоты, полученной из дрожжей (YNA): U—урацил, с—цитозин, а-аденин; G — гуанин. Хроматограмма была получена сенсибилизировавшем в ультрафиотетовых лучах фотографической бумаги, покрытой фильтровальной бумагой, на которой происходило орошение. Растворитель: изопропанол 65 частей + концентрированная соляная кислота 1S частей.
Хроматографический анализ водорастворимых органических кислот
Хроматография на бумаге дает возможность идентифицировать значительное количество нелетучих водорастворимых органических кислот Таковыми являются: аконитовая, адипиновая, лимонная, гликоловая, фумариновая, молочная, малеиновая, яблочная, малоновая, щавелевая, янтарная, винная и др. кислоты.
Применяемая техника включает обычно производимые операции, однако необходимо, чтобы биологический препарат был подвергнут предварительной очистке. Белки удаляются осаждением, а липиды экстрагированием органическими растворителями. Кроме того, необходимо также удаление глюцидов (осаждение спиртом в случае полиозидов), если они присутствуют в избыточном количестве. Глюциды вместе с катионами способными образовывать на хроматограмме основные пятна, удаляются посредством абсорбции препарата на колонке с ионообменными смолами (см. выше: хроматографический анализ белковых веществ).
В качестве растворителей могут быть использованы следующие смеси:
- изопропанол 7 частей + аммиак 0,5 частей + вода 2,5 частей;
- 100% этанол 8 частей*+ аммиак 0,5 части + вода 1,5 части;
- 100% этанол 4 части + изопропанол 4 части + аммиак 0,5 части + вода 1,5 части.
Весьма важно, чтобы орошение производилось в кислой атмосфере. Для этого, на дно хроматографической камеры ставится достаточно широкий кристаллизатор, в который наливают какую-либо летучую кислоту (муравьиную кислоту) вместе с растворителем, увлекающим за собой эту летучую кислоту (этилбензоат, метилбензоат, ментол и др.).
В качестве проявителей применяются индикаторы pH, причем предпочтение отдается двухцветным индикаторам. Если хроматограмма опрыскивается бромкрезолом синим, пятна отделяемых органических кислот имеют желтый цвет на синем фоне.
Фосфорные эфиры, вещества играющие весьма важную роль в биохимических процессах, также могут быть разделены и идентифицированы посредством хроматографии на бумаге. В отличие от анализа водорастворимых органических кислот необходимо принять ряд мер предосторожности в отношении предварительной очистки препарата, а также орошения.
Поскольку фосфорные сложные эфиры осаждаются в присутствии двухвалентных ионов, эти последние следует удалить предварительным промыванием хроматографической бумаги кислотой.
В качестве растворителей необходимо использовать смешивающиеся с водой фазы смесей, а орошение проводить непрерывным потоком, так как сложные фосфорные эфиры весьма слабо растворяются в несмешивающихся с водой растворителях и мигрируют с этими последними исключительно трудно. Ниже приводится ряд смесей используемых для непрерывного орошения хроматограмм сложных фосфорных эфиров:
- метанол 8 частей + 88% муравьиная кислота 1,5 части + вода 0,5 части;
- этилацетат 10 частей + пиридин 4,5 части + вода 10 частей;
- пропанол 6 частей + аммиак 3 части + вода 1 часть;
- этилацетат 3 части + ледяная уксусная кислота 3 части + 1 часть;
- этилацетат 6 частей.
Замещение воды формамидом (смесь д) имеет преимущество, что обладает свойством полярного растворителя, позволяя' в то же время лучше разграничить пятна сложных фосфорных эфиров.
Проявление сложных фосфорных эфиров может быть произведено молибденовым реактивом, описанным при хроматографическом анализе пуриновых и пиримидиновых оснований.
Хроматографический анализ витаминов
В течение последних лет хроматографический анализ был с успехом применен также для определения витаминов.
Для этой цели используются следующие растворители:
- н-бутанол 4 части + ледяная уксусная кислота 1 часть + вода 5 частей;
- н-бутанол 100 частей + аммиак 2 части + вода 18 частей (растворитель используемый для орошения никотиновых производных);
- н-бутанол 2 части + пропанол 2 части + вода 1 часть;
- изопропанол 1 часть + пиридин 1 часть + вода 1 часть;
- вода насыщенная изоамиловым спиртом (для флавиновых производных);
- ацетон 8 частей + вода 2 части; или ацетон 6 частей + вода 4 части (для орошения никотиновых производных и фосфопиридиннуклеотидов);
- буферный фосфат (0,1 м. pH 6,8) 4 части + насыщенный сульфат аммония), к которому добавляют 2% пропанола 6 частей (для орошения дифосфопиридиннуклеотида и трифосфопиридиннуклеотида).
Для проявления раздельных витаминовых пятен применяется абсорбция в ультрафиолетовом спектре (2600 А), специфичная для никотиновых производных или желтая флуоросценция в свете Вуда, специфичная для флавинов и их производных.
Хроматографический анализ стеролов
Для хроматографического анализа стеролов можно использовать следующие растворители:
- метанол 4 части 4- нефть (фракция дистиллируемая при 80– 100°С) 5 частей + вода 1 часть;
- метанол 7 частей Н- нефть 5 частей + бензол 5 частей + вода 3 части;
- метанол 1 часть + бензол 2 части + вода 1 часть.
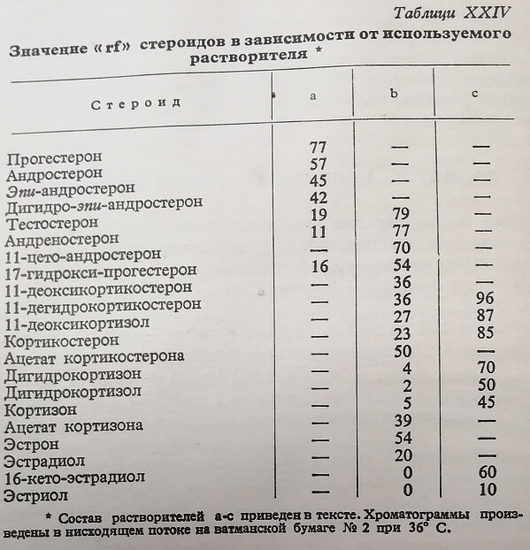
В таблице XXIV приводятся значения rf различных стероидов в зависимости от используемого растворителя.
Проявители стеролов являются специфичными для отдельных групп. Так, например, соединения содержащие кето-метиленовые группы проявляются реактивом Циммермана: 1 объем 2% этанолового раствора.
После опрыскивания хроматограммы, 17-кетостероиды дают устойчивые пурпурные пятна, а 3-кетоны и 20-кетоны дают соответственно синие и коричневые пятна.
Восстановительные стероиды (а-кетолы) выявляются с помощь» восстанавливающихся соединений; например, обесцвечивание или образование коричневых пятен с щелочным Ag N03. Хорошим просителем является смесь из 1 объема хлористого трифенилтетразола (0,2 в воде), 10 объемов NaOH (7% в воде) и 10 объемов метанола; а-кетолы дают красные пятна, образуемые формазаном.
Эстрогены обрабатываемые дымящей H2S04, дают характерную флуоросценцию в ультрафиолетовом спектре.