Цитогенетические последствия лазерного облучения
Тот факт, что излучение гелий-неонового лазера, как показали описанные выше результаты проведенных нами двух серий опытов, не оказывает тератогенного влияния и даже обладает антитератогенным действием, еще не значит, что этот фактор заведомо лишен мутагенного действия. Известно, что между тератогенной и цитогенетической активностью далеко не всегда существует параллелизм. Некоторые внешнесредовые агенты, как, например, вирус гриппа, 2-меркап-тобензимидазол и другие, способны индуцировать хромосомные аберрации, хотя и лишены тератогенной активности. Исходя из этого, нам представлялось необходимым исследовать цитогенетические последствия излучения гелий-неонового лазера Целесообразность таких экспериментов становится очевидной если учесть, что данные по изучению цитогенетического действия лазерного излучения на клетки животного и человека крайне немногочисленны и носят фрагментарный характер. Они проводились на культуре клеток китайского хомяка (при облучении неодимовым лазером, А, 265 нм) и эмбрионов человека.
Авторы обнаружили изменение митотической активности, увеличение выхода хромосомных аберраций. Степень выраженности цитогенетических эффектов зависела от мощности, экспозиционной дозы, длины волны излучения.
Исследования цитогенетической активности излучения гелий-неоновых лазеров на животных клетках не проводились. Наряду с этим уже имеются сообщения о возможностях использования гелий-неонового лазерного излучения для индукции мутагенеза у растений.
Цитогенетическая активность лазерного облучения была изучена нами в клетках костного мозга крыс после прицельного трехкратного облучения внутренней поверхности бедра животного в области проекции диафиза бедренной кости концентрированным потоком излучения ЛГ-75 (ППМ 25 мВт/см2) по 5 мин ежедневно. Через 48 ч после курсового воздействия животных умерщвляли бескровным методом путем перерывания спинного мозга; препараты костного мозга готовили по методу С. Е. Ford, J. Н. Hamerton (1956). Производили цитогенетический анализ метафазных пластинок, используя соответствующие методы (Н. П. Бочков и соавт., 1972).
Произведено исследование хромосом клеток костного мозга у 10 опытных и 12 интактных животных. У каждой крысы учитывали по 50-150 метафазных пластинок. Всего проанализировано 562 метафазные пластинки на препаратах у животных опытной и 1012 – у животных контрольной групп. В кариотипе крыс при изучении большинства препаратов животных опытной и контрольной групп определяли нормальное диплоидное число хромосом, равное 42.
При анализе результатов исследований учитывали как структурные нарушения хромосом (хроматоидного и хромосомного типов), так и числовые изменения (анеуплоидия, полиплоидия).
В связи с тем что некоторые исследования оценивают пробелы (щели) как возможную предпатологию структурных аберраций хромосом (Н. Y. Evans, 1966), их учитывали данном исследовании отдельно.
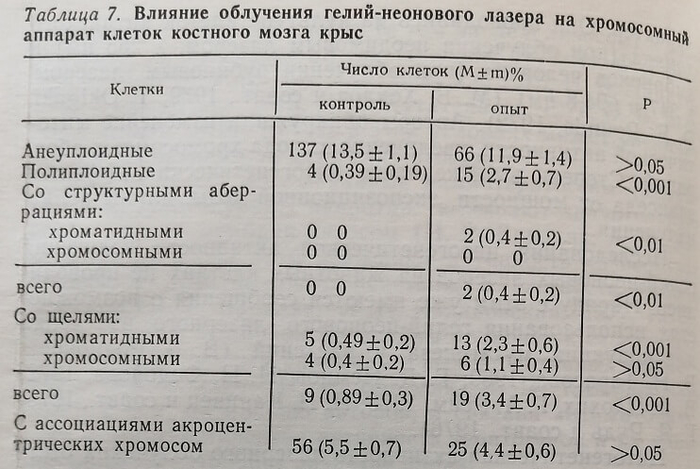
Результаты, полученные в этой серии исследований, представлены в табл. 7.
Облучение гелий-неоновым лазером не способствовало увеличению анеуплоидии: количество анеуплоидных клеток в контроле и опыте находилось примерно на том же уровне, соответственно (13,5±1,1) % и (11,9±1,4) %, разница статистически недостоверна, Р>0,05. Анеуплоидия в обеих группах исследований была представлена лишь гипоплоидными наборами хромосом. Гиперплоидных клеток мы не наблюдали ни в опыте, ни в контроле. Поскольку источником гипоплоидии может быть не только нерасхождение хромосом (как при гиперплоидии), но и утрата их, что может быть связано прежде всего с методическими приемами приготовления препаратов (Н. П. Бочков, В. М. Козлов, 1966), число истинных гипоплоидных клеток в какой-то мере должно коррелировать с числом клеток с гиперплоидным набором хромосом. В связи с отсутствием последних в условиях эксперимента, а также отсутствием существенной разницы в количестве гипоплоидных наборов в опыте и контроле мы также склонны расценивать гипоплоидию как артефакт методики.
У облученных животных по сравнению с животными контрольной группы достоверно увеличилось количество полиплоидных клеток, соответственно (2,7±0,7) % и (0,39± ±0 19) % РС0 001. Наряду с этим в опыте также были обнаружены единичные случаи структурных аберраций хромосом, составившие (0,4 ±0,2) %, тогда как у животных контрольной группы они не наблюдались (данные статистически достоверны: Р<0,01).
Структурные аберрации были представлены в виде терминальных ацентрических фрагментов хроматидного типа. Перестройки хромосомного типа в условиях эксперимента не наблюдались. Как известно, воздействие на клетки, находящиеся в предсинтетической стадии, приводит к образованию лишь хромосомных аберраций, на клетки, находящиеся в синтетической стадии, хромосомных и хроматидных, а в постсинтетической стадии – хроматидных аберраций (Н. П. Бочков, 1974). Последнее, по-видимому, имело место в условиях эксперимента.
Следует отметить, что, наряду с появлением хроматидных аберраций, при облучении у животных более чем в 4 раза увеличилось количество клеток со щелями (хроматидного типа). У животных контрольной группы они составляли (0,49±0,2) %, опытной – (2,3±0,6) %, разница статистически достоверна, Р<0,005. Как и фрагменты; щели обнаруживались лишь в терминальных отделах хроматид, что, по-видимому, позволяет их расценивать как раннее проявление потенциального цитогенетического эффекта исследуемого фактора.
В препаратах животных опытной и контрольной групп обнаруживали также ассоциации малых и больших акроцентрических хромосом, соответственно в (4,4 ±0,6) % и (5,5±0,7)% препаратов – разница статистически недостоверна, Р>0,05.
Таким образом, свет гелий-неонового лазера проявляет определенную, хотя и слабо выраженную цитогенетическую активность. Цитогенетическая активность лазерного излучения, наблюдаемая в условиях наших опытов, могла быть связана либо с непосредственным его влиянием на наследственную активность клеток, либо, что нам представляется более вероятным, она опосредована общими изменениями в организме, и прежде всего гормональными сдвигами. Как уже отмечалось, согласно данным литературы и результатам проведенных опытов, многократное облучение гелий-неоновым лазерным потоком оказывает выраженный эстрогенный эффект.
Кроме того известно, что при гиперэстрогении возникают глубокие изменения в структуре веретена деления, астросферы и хромосом – отмечается слипание их в метафазе или рассеивание в цитоплазме, то есть происходит нарушение образования экваториальной пластинки. Эти изменения впоследствии индуцируют полиплоидию, структурные аберрации хромосом, анеуплоидию.
Аналогичные изменения хромосомного аппарата имели место и при воздействии малыми дозами сероуглерода и сероводорода (И. Р. Бариляк, И. А. Васильева, 1974), что авторы также связывают с опосредованным действием агентов через эндокринную систему и прежде всего с нарушением в организме баланса половых гормонов, сопровождающимся гиперэстрогенией. Поэтому можно считать весьма вероятным, что цитогенетический эффект светового потока гелий-неонового лазера реализуется опосредованно путем изменений гормонального баланса в организме.
Следовательно, согласно экспериментальным данным, излучение гелий-неонового лазера обладает определенной цитогенетической активностью, которая проявляется увеличением полиплоидии, частоты хроматидных аберраций и хроматидных щелей. Эффект индуцированного мутагенеза в соматических клетках, по-видимому, реализуется путем воздействия на клетки, находящиеся в постсинтетической стадии.
В связи с тем, что индуцированные структурные аберрации хромосом наблюдались лишь в единичных соматических клетках экспериментальных животных, можно полагать, что исследуемый нами фактор относится к группе слабых мутагенов и опасность повреждения генома человека при его воздействии незначительна.