Автоматизация биохимических исследований
По степени участия в аналитическом процессе человека средства лабораторного анализа подразделяют на несколько групп: для ручных методов, в которых все аналитические процедуры выполняют вручную; механизированных методов, в которых отдельные этапы аналитических процедур (например, этап дозирования проб и реагентов, этап измерения оптической плотности и др.) могут оснащаться узкоцелевыми автоматизированными устройствами, и, перенося пробы последовательно от одного устройства к другому, лабораторный работник объединяет эти устройства в полуавтоматическую аналитическую систему, полностью автоматизированных методов.
В полностью автоматизированной системе – автоанализаторе – исследуемая проба перемещается по непрерывному пути, подобному производственному конвейеру, вдоль ряда автоматизированных устройств, выполняющих свой этап анализа и представляющих собой блоки единого аналитического прибора. При работе с такими приборами человек выполняет функцию управления.
Первые автоанализаторы были созданы в 1950-е гг., когда практически параллельно были выдвинуты идеи автоматизации лабораторных тестов путем измерения аналитов в потоке исследуемой биожидкости: для гематологических исследований на основе проточного кондуктометрического метода цитометрии, т.е. подсчета числа клеток крови и измерения их объема, а для биохимических исследований — путем последовательного анализа проб биоматериала в постоянном потоке жидкости, представляющей смесь пробы с реагентами в системе капиллярных трубок.
Если в дальнейшем развитии производства гематологических автоматических анализаторов кондуктометрический принцип (хотя и дополненный некоторыми другими способами измерения свойств клеточных элементов) сохранился как основной до настоящего времени, конструирование биохимических анализаторов развивалось и по другим направлениям.
Концепция проточного биохимического анализатора была реализована не только в одноканальном варианте, где пробы анализировались лишь в отношении одного компонента, но и в виде многоканальных (2-, 6-, 12-канальных) последовательных, проточных автоматических анализаторов, позволявших исследовать одну и ту же пробу параллельно по нескольким параметрам.
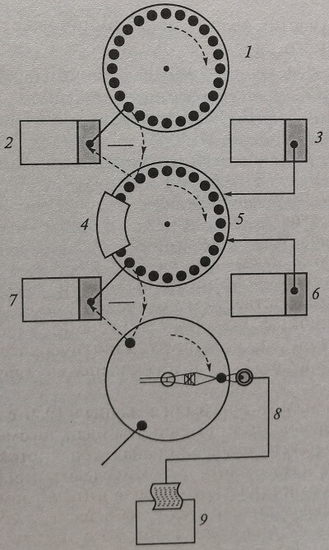
В дискретных анализаторах, в которых каждую пробу помещают в отдельную емкость, куда затем поступают необходимые для реакции реагенты (рис. 8.1), указанная концепция была реализована во многих вариантах, и стала основной в действующем парке лабораторных автоматических анализаторов.
Рис. 8.1. Принципиальная схема устройства автоматического биохимического анализатора дискретного типа: 1 – пробоподготовка; 2 – перенос пробы в реакционные сосуды и добавление реагента; 3 – добавление реагента 2; 4 – смешивание; 5 – инкубирование; 6 – добавление реактива 3; 7 – перенос пробы для измерения в кювету фотометра; 8 – фотометрия; 9 – расчет и распечатка результатов
Концепция центрифужного анализатора совместила в себя последовательность, дискретность и параллельность анализа одновременно, поскольку в отдельные радиальные бороздки дискатора одновременно вносились пробы, реагенты для выполнения одного и того же анализа, проводившегося параллельно в процессе вращения ротора.
Важным свойством многих современных автоматических анализаторов является селективность, т.е. способность выполнять для каждой исследуемой пробы те анализы, которые введены соответствующей командой, а также возможность выполнения вне очереди экстренно необходимых исследований (свободный доступ).
Отдельные блоки автоматизированных аналитических систем для клинико-биохимических исследований выполняют следующие операции:
- идентификация образца биоматериала;
- обработка образца;
- перенос образца и его распределение;
- удаление белка и других интерферентов;
- отмеривание пробы, ее перенос и распределение;
- хранение реагентов;
- отмеривание реагентов, их распределение;
- фаза химической реакции;
- измерение результата реакции;
- обработка сигнала и хранение данных.
Идентификация образца биоматериала необходима для безусловного опознания его на всех этапах аналитического процесса и отнесения полученного результата анализа к обследуемому пациенту. Каждому образцу присваивается порядковый номер, который кодируется тем или иным образом, принятым в данной лаборатории. Этот код должен быть нанесен на пробирку с образцом.
Наиболее распространен штриховой код. Определенные сочетания штриховых линий соответствуют порядковым номерам образцов. Метки со штрих-кодами можно заготавливать заранее и присваивать образцам по мере поступления их в лабораторию. Наряду с этим существует возможность изготовления меток с помощью ручных печатающих устройств непосредственно в месте взятия материала у пациента.
Штрих-кодами могут маркироваться упаковки реагентов, используемых в аналитическом процессе. Заложенная в них информация считывается предназначенными для этого устройствами («световыми карандашами», лазерными штрих-ридерами).
В настоящее время существует несколько систем штрих-кодов, и поэтому необходимо удостовериться в соответствии возможностей ридера по отношению к штрих-коду, используемому производителем маркированных пробирок и упаковок реагентов. Среди вариантов способов идентификации – пробирки с колпачками разного цвета для дифференциации различных видов образцов (с гепарином, теми или иными консервантами), код образца может быть нанесен на колпачок; контейнеры с кодами, нанесенными непосредственно на стенку пробирки; недавно предложенный «матричный код», который позволяет уплотнить закодированную информацию и может быть нанесен на различные части контейнера с образцом; специальные держатели для пробирок с вмонтированными в них электронными запоминающими устройствами, куда при взятии образца у пациента заносят всю необходимую информацию, включая паспортные данные, локализацию пациента в лечебном учреждении и назначенную врачом программу лабораторных исследований. Считывающие устройства для «матричного кода», электронных чипов отличаются своим устройством от лазерных штрих-ридеров.
Необходимость предварительной обработки образца до начала анализа существует для аналитов, которые обычно исследуют в плазме или сыворотке крови. Автоматизация центрифугирования образцов крови непосредственно в моноблочном анализаторе затруднительна, хотя и реализована в некоторых вариантах анализаторов. Чаще применяют способы быстрой обработки образцов крови до их введения в анализатор. При исследованиях в цельной крови этап обработки образцов не нужен.
Детали устройств для тех или иных операций с образцами (как и на последующих этапах – с пробами биоматериалов) представляют собой роботизированные аналоги приспособлений, используемых при ручном выполнении анализов.
Поступившие в анализатор образцы в приборах некоторых конструкций затем подвергаются сортировке, т. е. группировке по виду исследований, которые должны быть выполнены с содержащимся в них материалом. Это необходимо в многопараметровых анализаторах. Для такой сортировки в конструкцию анализатора включают соответствующее устройство, обладающее способностью распознавать информацию, содержащуюся в кодах пробирок с образцами, и распределять пробирки по видам исследований. Такие сортирующие устройства (сортеры) могут быть как самостоятельным лабораторным прибором, так и одним из компонентов аналитической системы. Сортеры могут быть различной пропускной способности – от нескольких десятков до тысяч пробирок в час.
Поступившие в автоматический анализатор образцы биоматериалов перемещаются внутри прибора, чтобы оказаться в зоне действия тех или иных устройств, выполняющих процедуры, необходимые для обработки, дозирования и распределения проб образца. Это перемещение осуществляется за счет продвижения конвейерной цепи, кассет с пробирками или вращения диска в отдельных ячейках или секциях которых находятся пробирки содержащие образцы (рис. 8.2). При различных конструктивных решениях в анализаторах можно размещать от нескольких десятков до сотен образцов. Поскольку процесс передвижения образцов занимает некоторое время, для предотвращения испарения жидкости из сосудов, содержащих образцы, их закрывают колпачками. При достижении пробиркой с образцом зоны распределения образца на отдельные порции колпачок снимается соответствующим роботизированным устройством.
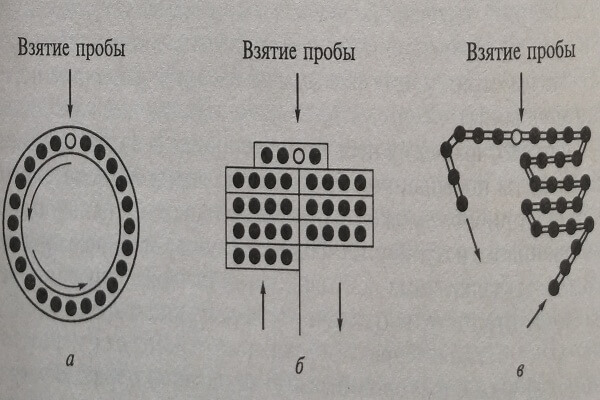
Рис. 8.2. Схемы вариантов устройств для размещения и перемещения пробирок с образцами биоматериалов в автоматических биохимических анализаторах дискретного типа: а – вращающийся диск с пробирками; б – перемещение кассет с пробирками; в – цепь с пробирками
Из пробирки, в которой образец был доставлен в лабораторию, должны быть взяты порции сыворотки или плазмы для выполнения отдельных анализов. При этом используют пробирки небольшого объема, рассчитанные на размещение в них необходимого для анализа количества исследуемой жидкости и реагентов. Их конструкция должна способствовать минимизации так называемого «мертвого» объема, т. е. избыточного количества жидкости, нужного лишь для того, чтобы взятое для измерения результата анализа количество жидкости было не меньше требуемого. Эти «вторичные» пробирки могут быть многоразового пользования, что требует их мытья; одноразовыми, что требует их утилизации после употребления; они могут формироваться непосредственно в приборе по мере необходимости. Материал, из которого изготовлены эти сосуды, не должен содержать компонентов, способных влиять на ход реакции.
Операции сортировки образцов, откупоривания пробирок и дозирования отдельных порций образца (аликвот) могут быть объединены в одном комплексе, представляющем собой самостоятельный прибор, готовящий пробы для нескольких анализаторов. В этом приборе поступивший в лабораторию образец биоматериала идентифицируется с пациентом в соответствии со штриховым кодом, нанесенным на контейнер с образцом, с вакуумных пробирок снимаются крышки, из образца отбирается материал для предварительной обработки.
Пробы автоматически загружаются во встроенную в прибор центрифугу с охлаждением, подвергаются центрифугированию. Проверяется объем пробы и качество биоматериала на наличие желтушной окраски, гемолиза и липемии. Автоматически кодируются штриховым кодом и размещаются в пробонакопителе вторичные пробирки, в которые дозируется автоматическими пипетками необходимое количество обработанной пробы из первичных пробирок. Пробы сортируют, т. е. собирают в кассеты по видам исследований, готовят для переноса на автоанализаторы.
В зависимости от рабочей нагрузки лаборатории можно применять автоматические устройства для подготовки проб различной производительности. Такие рабочие ячейки способны обработать от 300 до 1 700 первичных пробирок с пробами за один час; на борт устройства можно одновременно загрузить до 1000 пробирок или 32 микропланшета. Считывающее приспособление может распознавать до 256 штрих-кодов в течение 90 с.
В тех случаях, когда зона первичной обработки образцов в помещении лаборатории отдалена от анализаторов, перемещение рассортированных и распределенных по видам исследований проб биоматериалов можно проводить не только вручную, но и по стационарной конвейерной линии, и с помощью специальных роботов. Следует учитывать, что для получения надежного результата проба должна находиться в контакте с электродом примерно 20-30 с. Этот интервал времени определяет скорость работы аналитического канала, оснащенного ионоселективными электродами.
Реже в автоматических анализаторах используется кулонометрия (система с серебряным электродом для измерения хлоридов) и кондуктометрия (система с золотым электродом для измерения азота мочевины).
Для предотвращения неблагоприятного воздействия на лабильные аналиты повышенной температуры и ультрафиолетового излучения в приборах может быть обеспечено охлаждение образцов, размещение их в пробирках из затемненного материала и т.д.
В тех случаях, когда белки и другие интерферирующие вещества могут отрицательно повлиять на результаты анализов, в анализаторах могут быть предусмотрены устройства для диализа биоматериала через полупроницаемую мембрану или хроматографические колонки с использованием гель-фильтрации или ионообменников. В приборах, использующих средства «сухой химии», освобождение от интерферентов достигается за счет соответствующих компонентов многослойных аналитических элементов или с помощью фильтрующих мембран на диагностических полосках.
Точное дозирование порций образца, взятых для проведения определенного анализа (проб), достигается с помощью дозирующих устройств типа шприцев или автоматических пипеток в приборах дискретного типа, а в проточных анализаторах – за счет трубок со строго определенным внутренним диаметром, в которые биоматериал и реагенты подаются перистальтическим насосом, причем пробы отделяются в этом потоке одна от другой с пузырьками воздуха.
Скорость продвижения анализируемой жидкости должна соответствовать скорости осуществления реакции, составляющей суть аналитического процесса. Пузырьки воздуха обеспечивают также уменьшение опасности взаимного загрязнения проб (переноса) очищая внутренность стенок трубки от остатков предыдущей пробы. Такую же роль играет добавление в поток жидкости поверхностно-активного вещества – детергента.
В дискретных анализаторах дозирующие устройства должны быть не только отъюстированы в отношении дозируемых объемов пробы и реагентов, но и точно запрограммированы на промежутки времени, необходимые для осуществления аналитических процедур в рабочем цикле прибора. Обычно в приборах, рассчитанных на один вид исследований, дозаторы имеют фиксированные объемы дозирования, тогда как в многопараметровых селективных анализаторах дозаторы должны перенастраиваться на различные объемы дозирования по вводимым командам или по заданным программам.
Для обеспечения непрерывности работы автоанализаторов соответствующими объемами реактивов, предотвращения их порчи хранение реагентов во многих из них осуществляется в холодильниках, встроенных в анализаторы. Наряду с соображениями сохранности реактивов, не меньшее значение имеет и их рациональное использование. Хранимая партия реактивов должна соответствовать расчетной потребности в них с учетом ожидаемого количества анализов. В наибольшей степени это относится к реактивам короткого срока хранения. Естественно, что предпочтение оказывают системам, рассчитанным на минимальные объемы проб и, соответственно, потребляемых для их исследования реактивов.
Применение средств «сухой химии» в полностью автоматизированных системах, например для биохимического исследования мочи, существенно влияет на конструкцию автоматического анализатора, поскольку при этом отпадает необходимость в устройствах для дозирования реактивов, их охлаждения и т. п.
Фаза химической реакции в автоматических анализаторах конструктивно обеспечена по-разному. Необходимое для протекания реакции перемешивание материала пробы с реактивами в проточных анализаторах осуществляется при прохождении жидкости через спиралевидный участок трубок. При необходимости для реакции с более высокой температурой этот участок размещают в водяной бане с требуемым уровнем температуры, а протяженность этого участка определяется скоростью протекания жидкости в сопоставлении с временем, необходимым для полного завершения реакции.
В дискретных анализаторах реакция может проходить в сосуде, в который была дозирована проба и введены растворы реактивов, либо в специальной реакционной камере.
Перемешивание пробы с реактивами осуществляется различными способами: за счет быстрого впрыскивания реактивов в сосуд с пробой, путем вибрации, использования механических мешалок, магнитного перемешивания и т.п.
Нагрев и термостатирование смеси пробы с реагентами осуществляется с помощью суховоздушной или водяной бани, специального нагревателя.
Оригинальное решение проблемы подачи реагентов было применено в автоматическом анализаторе «АСА» фирмы «DuPont», где использовались готовые наборы реагентов в таблетированной форме для отдельных видов анализов, упакованные в специальные пластиковые контейнеры, выполняющие последовательно также роль реакционных сосудов, в которые вводили растворитель для реактивов и пробу биоматериала, и роль кювет при фотометрическом измерении результатов реакции.
В центрифужном анализаторе смешивание пробы с реактивами и перемещение смеси от центра ротора к измерительной ячейке, расположенной на периферии, происходит в радиальных углублениях ротора под действием центробежной силы при его вращении с переменной скоростью, а нагрев обеспечивается с помощью воздушной бани или электрического нагревателя, размещенного непосредственно на роторе.
Измерение результатов анализов можно выполнять в том же сосуде, где проходила реакция или в специальной измерительной кювете, в которую прореагировавшая смесь переносится током жидкости (проточный анализатор), при вращении (центрифужный анализатор) или отбирается специальным устройством. Чаще всего используют фотометры или спектрофотометры для измерения светопоглощения прореагировавшей смеси, которое может сопоставляться с результатами измерения холостой пробы, с калибровочным материалом. В других видах исследований можно измерять флюоресценцию, хемилюминесценцию, поляризацию флюоресценции, светорассеяние, электрохимические характеристики и т.д.
Для исключения интерференции различных эндогенных и экзогенных компонентов можно использовать бихроматическое (на двух длинах волн) и полихроматическое (на 3-16 длинах волн света) измерение поглощения света продуктами реакции. В случае применения в анализаторе средств «сухой химии» для детекции и измерения результатов используют отражательный фотометр.
При электрохимической детекции применяют чаще всего ион-селективные электроды, в некоторых случаях, сопряженные с закрепленным ферментом (определение электролитов, глюкозы, мочевины). Измерительное устройство может быть основано на применении биосенсора или микрочипа.
Обработка сигнала, поступающего от детектора, происходит в микропроцессоре или компьютере, встроенном в анализатор или сопряженном с ним. При этом в программу закладывается не только преобразование сигнала в цифровую форму, но и сложный расчет результатов с учетом данных калибровки прибора, показаний холостой пробы и т.д. В современных аналитических приборах микропроцессоры выполняют обширный перечень функций: текущий контроль за функционированием отдельных блоков прибора; статистическую обработку результатов исследований; расчет средней арифметической, среднего квадратического отклонения, коэффициента вариации; распечатку контрольных карт с одновременной интерпретацией результатов; накопление данных, полученных при исследовании проб пациентов; объединение результатов различных исследований,выполненных для одного пациента, и пр.