Ферменты как объекты клинико-лабораторных исследований
Свойства ферментов
Ферменты (энзимы) – это белки, способные ускорять течение биохимических реакций. Они вырабатываются клетками организма, из которых попадают в его жидкие среды — плазму, мочу, пищеварительные соки – либо в результате физиологических процессов, либо как следствие заболевания. Каждый орган вырабатывает определенный набор ферментов, увеличение, снижение их содержания или исчезновение в биожидкостях служит характерным признаком повреждения органа. На этом основано использование определения ферментов в клинической лабораторной диагностике.
Как катализаторы ферменты обладают следующими свойствами: они действуют в мельчайших количествах; выходят из реакции неизмененными; при увеличении активности не влияют на состояние равновесия реакции, а лишь ускоряют его установление.
Ферменты обладают всеми свойствами, характерными для белков. Большое значение имеет лабильность структуры фермента (белка). Ее изменение или денатурация ведет к потере ферментативной активности. Кроме того, стабильность ферментов зависит от температуры, концентрации водородных ионов (pH) и концентрации буфера. Белки являются поливалентными электролитами и содержат способные к ионизации группы. Ионизационное состояние влияет на активность фермента и зависит от pH. Будучи электролитами, белки перемещаются в электрическом поле: положительно заряженные молекулы движутся к катоду, отрицательно заряженные – к аноду. Чем выше заряд, тем быстрее движение молекулы. Вследствие этого смесь белков с различными зарядами можно разделить электрофоретически, что и применяется при разделении изоферментов.
Изоферменты – ферменты, катализирующие одну и ту же реакцию, различающиеся величиной молекулярной массы, составом аминокислот, электрофоретической подвижностью, термо-
стабильностью, оптимумом pH, субстратной специфичностью, действием на них активаторов и ингибиторов и иммунологическими характеристиками.
Различные формы ферментов могут различаться по органу, в котором преимущественно синтезируются (печень, сердце, мозг и др.) по частям клетки (митохондрии, цитоплазма и т.п.), а также по генной структуре индивидуума.
К ферментам, существующим в виде различных форм, относятся креатинкиназа, аспартатаминотрансфераза, лактатдегидрогеназа, малатдегидрогеназа, щелочная фосфатаза и др.
Под количеством фермента следует понимать концентрацию специфического белка, а под активностью – его способность ускорять течение биохимической реакции. Для большинства ферментов по определяемой активности можно судить и об их количестве. Но есть и такие ферменты, специфические изменения которых отражает только массовая концентрация, например креатинкиназа и ее изофермент MB.
Комиссия по ферментам Международного биохимического союза установила, что единицу каталитической активности фермента можно определить как количество фермента, которое катализирует превращение 1 мкмоль субстрата в 1 мин. Эта единица называется международной единицей, ME, или IU (International Unit). В системе СИ единицей каталитической активности фермента является катал (кат), который соответствует количеству фермента, превращающему 1 моль субстрата за 1 с. При этом объемная активность фермента выражается как МЕ/л или кат/л, или кат/м3 и носит название концентрации каталитической активности, или каталитической концентрации, в отличие от удельной активности, которая выражается в МЕ/мг белка. В случае определения массовой концентрации фермента, например креатинкиназы MB, ее выражают в мкг/л, используя иммунохимические методы (радиоиммунологический анализ или иммуноэнзимометрические тесты).
Вещество (вещества), которое подвергается воздействию ферментов (ферментации) называется субстратом (субстратами), образующееся вещество – продуктом. Скорость ферментативной реакции зависит не только от количества фермента, но и от многих других условий, в которых протекает эта реакция (pH среды; температуры; присутствующих солей; модификаторов – ускорителей реакции (активаторов); веществ, тормозящих реакцию – ингибиторов; концентрации субстратов; продуктов реакции). Для точного выполнения анализа ферментов необходима стандартизация и оптимизация всех условий выполнения исследования, при которых исследуемый фермент проявляет максимальную активность. Тогда неизбежные небольшие отклонения в повседневной работе будут сказываться на результатах в минимальной степени.
Активность фермента определяют путем измерения превращения субстрата в единицу времени при строго определенных и контролируемых условиях опыта. Эти условия выбирают, основываясь на данных кинетики ферментативных реакций – науки об их скоростях.
Основное положение кинетики ферментативных реакций заключается в том, что эти реакции протекают в два этапа (рис. 3.1), Первоначально фермент взаимодействует с субстратом (субстратами), который присоединяется к определенному месту молекулы фермента — активному центру:
E+S-> ES^Е+ Р.
При этом образуется фермент-субстратный комплекс, который затем распадается с образованием продукта (продуктов) реакции. Освободившийся фермент может затем снова участвовать в реакции.
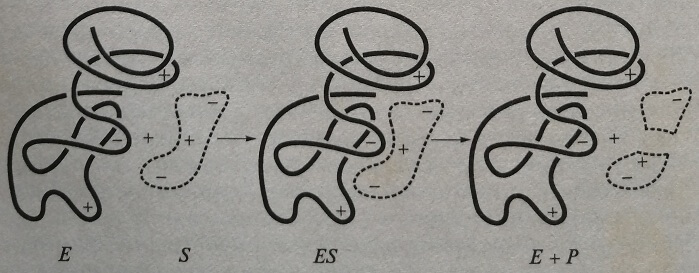
Рис. 3.1. Механизм действия фермента: Е — фермент; S — субстрат; ES — фермент-субстратный активный комплекс, (Е + Р) — продукт реакции
Высокую каталитическую активность ферментов, благодаря которой реакции в живой клетке ускоряются во много раз, можно объяснить высокой субстратной специфичностью ферментов. Различают абсолютную субстратную специфичность ферментов, т.е. их способность катализировать расщепление лишь одного вида соединений (например, мочевина — единственный природный субстрат для уреазы; пируваткиназа способствует переносу фосфатной группы только между фосфоенолпируватом и АДФ). Некоторые ферменты проявляют групповую субстратную специфичность, т.е. эти ферменты способны катализировать аналогичное превращение близких по строению соединений. Например, гексокиназа способна переносить фосфатную группу от АТФ не только на D-глюкозу, но с той же скоростью и на D-фруктозу, D-маннозу, 2-дезокси-0-глюкозу, но не проявляет аналогичной каталитической активности в отношении D-галактозы и других гексоз и пентоз; липаза гидролизует липиды различного состава.
Некоторые ферменты не проявляют специфичности в отношении субстрата. Например, щелочная фосфатаза катализирует реакцию гидролиза эфиров ортофосфорной кислоты, причем специфична в отношении однозамещенных производных ортофосфата (4-нитрофенилфосфат, фенолфталеинмонофосфат, тимол-фталеинмонофосфат и др.). Двух- и трехзамещенные производные гидролизу не подвергаются.
Многие ферменты проявляют стереоспецифичность, т.е. способны катализировать превращения лишь определенных стереоизомеров (например, аминокислот L-ряда, но не D-ряда, D-изо- форм моносахаридов, но не L-изоформ). Использование каталитических свойств ферментов в отношении определенных специфических субстратов лежит в основе применяемых в клинической лабораторной диагностике методов исследования их активности в биоматериалах человека. Субстраты бывают природного происхождения и синтетические. Чаще всего используют синтетические субстраты. Выбор субстрата очень важен, так как субстраты гидролизуются с различной скоростью.
Оптимальная концентрация субстрата зависит от pH и температуры, при которой проводят реакцию. Природные субстраты для некоторых ферментов остаются неизвестными до настоящего времени. Так, нативный субстрат для у-глутамилтрансферазы неизвестен. В наборах реактивов для определения активности этого фермента используют синтетические субстраты.
Особую группу составляют хромогенные субстраты. Будучи соединены с некоторыми ионами, аминокислотами, полипептидами, сахаридами, эти соединения имеют низкую величину оптической плотности, иногда практически бесцветны. Под действием ферментов они гидролизуются с образованием Окрашенных соединений, таких, как 4-нитроанилин, 4-нитрофенол, 5-амино-2-нитробензойная кислота. Когда окрашенное соединение высвобождается из хромогенного субстрата в реакционную смесь, светопоглощение этой смеси увеличивается и может быть оценено фотометрически. Таким образом, можно получить количественный результат, характеризующий активность фермента. Хромогенные субстраты используют для определения концентрации некоторых ферментов, компонентов системы гемостаза, ионов, которые активируют фермент, входящий в состав рабочего реактива (например, для определения натрия, калия, хлоридов).
Показатель pH и вид буфера оказывают большое влияние на определение активности фермента. Для каждого фермента существует оптимальное значение pH, при котором его активность самая большая, именно в этих условиях она и должна быть измерена. Определение активности фермента проводят в буферных раствоpax – смесях слабых кислот и солеи, которые способны обеспечивать стабильное значение pH. Буферный раствор, в которое проводят определение ферментативной активности, должен быть выбран так, чтобы его максимальная буферная емкость по возможности точно совпадала с оптимумом действия ферментов Оптимум pH зависит от многих факторов: вида буфера, вида и концентрации субстрата, присутствия активаторов, ингибиторов реакции, т.е. в известной степени, от среды, в которой протекает реакция.
Влияние вида буфера для некоторых ферментов очень велико. Так, для щелочной фосфатазы можно выделить три группы буферов: инертные (карбонатный, барбиталовый); буферы, ингибирующие активность фермента (глициновый, пропиламиновый); активирующие буферы (2-метил-2-амино-пропанол-1, или АМП-буфер, диэтаноламиновый – ДЭА, N-метилглюкаминовый буфер). Активность щелочной фосфатазы в этих буферах с субстратом 4-нитрофенилфосфатом при одной и той же температуре будет возрастать в такой последовательности: глициновый буфер < < АМП < ДЭА < N-метилглюкаминовый буфер.
Активирующие буферы относятся к так называемым трансформирующим, или трансфосфорилирующим,. буферам, которые в отличие от других обладают свойством акцептировать ион фосфата и таким образом удалять один из продуктов реакции из реакционной смеси, освобождать активный центр фермента и ускорять ферментативную реакцию. Понятно, что в зависимости от вида буфера конечные результаты активности щелочной фосфатазы будут различны, а следовательно, и значения активности фермента у здоровых людей также будут зависеть от состава буфера. Так, при определении у здоровых взрослых людей с субстратом 4-нитрофенилфосфатом при температуре 37 °С активность щелочной фосфатазы с буфером АМП у женщин составляла 27–93 МЕ/л, у мужчин 34–88 МЕ/л, с буфером ДЭА – соответственно 80- 306 МЕ/л и 60-306 МЕ/л.
Кроме того, известно, что вещества – активаторы ферментативной реакции проявляют свои активирующие свойства в буферах определенного состава, а в других буферах – не проявляют. Это уже в течение многих лет используют для повышения чувствительности методов определения активности аминотрансфераз (АсАТ и АлАТ). Так, при использовании фосфатного и трис-буфера в кинетических определениях активности аминотрансфераз на основе оптического теста Варбурга без активаторов результаты практически совпадают (при соблюдении одинаковых прочих условий: субстрат, кофакторы, температура и т.д.). Но такой активатор реакции, как витамин В6 (пиридоксальфосфат), проявляет свои активирующие свойства лишь в трис-буфере и не проявляет их в фосфатном буфере.
При проведении внутрилабораторного контроля качества с контрольным материалом следует сопоставлять свои результаты, полученные в нем, с величинами, указанными в паспорте к контрольному материалу (контрольной сыворотке) именно для того метода определения активности фермента, который совпадает с используемым. При этом важное значение имеет и применяемый буфер.
Активность фермента в большой степени зависит от температуры. Температура должна быть точно фиксирована. Существует представление о «температурном оптимуме» при определении активности ферментов. В здоровом организме человека фермент функционирует при температуре 36-37 °С. При любой избранной температуре должен быть обеспечен строгий контроль за ее постоянством в пределах ±0,1 °С. Каждый Температурный режим имеет свои преимущества и неудобства. Определение при температуре 37 °С имеет то преимущество, что такие условия ближе всего к физиологическим. Однако некоторые ферменты при этой температуре, хотя и медленно, но все же инактивируются. Чем выше температура, тем быстрее идет реакция, иногда ее скорость настолько велика, что трудноизмерима.
Соблюдение и знание температуры, при которой выполнено измерение ферментативной активности, важно как для лабораторных работников, так и для клиницистов. Активность ферментов с повышением температуры увеличивается, следовательно, увеличиваются референтные величины активности их в сыворотке у здоровых людей и результаты в контрольных материалах, что необходимо принимать во внимание при повседневной работе. Так, например, при определении АсАТ в сыворотке крови УФ-тестом с фосфатным буфером активность ее у здоровых женщин при температуре 30 °С менее 21,0 МЕ/л, при 37 °С менее 32,0 МЕ/л, у мужчин соответственно менее 25,0 МЕ/л и менее 38,0 МЕ/л. Для сопоставления результатов, полученных при различных температурных условиях, существуют коэффициенты перевода. В некоторых моделях высокопроизводительных автоанализаторов, быстро и точно выполняющих кинетические методы микроанализа ферментов, обеспечено термостатирование при температурах 25, 30, 37 °С.
Обеспечение термостатирования при температуре 25 °С в анализаторах представляет большую сложность, особенно для работы в жарком климате. Для поддержания температуры на различных этапах анализа необходимо исследуемый материал, реактивы, измерительную кювету прогреть до заданной температуры. В большинстве лабораторий определение активности ферментов проводится при температуре 37 °С. В настоящее время условия выполнения референтных методов определения активности ферментов тоже оптимизированы для измерения при температуре 37 °С.
К модификаторам действия ферментов относятся активаторы и ингибиторы их активности. Активаторы – это, во-первых, кофакторы и коферменты, а во-вторых, собственно активаторы.
Кофакторы – соединения небелковой природы, в присутствии которых проявляется активность ферментов благодаря их участию в конформации активного центра. В роли кофакторов могут высту. пать ионы металлов, например ионы Mg2+(фосфогидролазы, фос. фотраисферазы); Fe2+, Fe3+ (цитохромы, пероксидаза, каталаза), Мп2+ (аргиназа, фосфотрансферазы), Cu2+, Си+ (цитохромоксида- за), К+(пируватфосфокиназа), Na+(AT<t>a3a) или сложные орга- нические соединения.
Коферменты — органические соединения небелковой природы с относительно низким молекулярным весом по сравнению с белком фермента. Они выполняют специфические функции, как, например, перенос водорода (НАД или НАДФ в реакциях с участием гидрогеназ), перенос ацильных групп (кофермент А(КоА) в реакциях синтеза и разложения жирных кислот), изомеризацию (уридиндифосфат в реакции превращения глюкозы в галактозу).
В группу коферментов различного химического строения входят глутатион, производные витаминов В6, В1, фолиевой кислоты, биотин, нуклеотиды и нуклеозиды (НАД, НАДН, АТФ, КоА) и др. При выполнении определения коферменты добавляют в достаточном количестве, чтобы их недостаток не явился лимитирующим фактором реакции.
Собственно активаторы — вещества, препятствующие разрушению фермента или переводящие его из неактивной формы в активную. Это органические вещества — желчные кислоты, активирующие панкреатическую липазу, тиоловые соединения, например N-ацетилцистеин (NAC), препятствующие окислительной инактивации креатинкиназы, минеральные соли и кислоты, специальные ферменты – энтерокиназа в реакции превращения трипсиногена в трипсин.
Иногда активацию фермента обеспечивает не один, а несколько ионов. Одни и те же ионы в различной концентрации могут быть активаторами и ингибиторами для одних и тех же ферментов или для различных ферментов (например, Zn активирует глицил- лейцинпептидазу, алкогольдегидрогеназу, карбоксипептидазу, но тормозит активность креатинкиназы).
Вещества, подавляющие активность ферментов, называются ингибиторами. Так, йодуксусная кислота тормозит ферментативные реакции углеводного обмена. По механизму реакции с ферментами ингибиторы подразделяют на две группы: ингибиторы, вступающие с ферментами в обратимую реакцию (конкурентное и неконкурентное торможение), и ингибиторы, реагирующие с ферментом необратимо. К первой группе относятся ионы тяжелых металлов, азид натрия, фторид натрия, дикарбоновые кислоты, ко второй – фосфорорганические соединения (в частности, инсектициды).
Концентрация природных ингибиторов в тканях и плазме незначительна и заметно не влияет на определение активности ферментов. Лишь в моче найдены ингибиторы, мешающие определению, поэтому перед определением ферментов ее подвергают диализу. Известными ингибиторами являются фосфат для фосфатаз, мочевая и аскорбиновая кислоты для пероксидаз. Конкурентные ингибиторы являются аналогами субстрата. Увеличение концентрации субстрата в этом случае ведет к возрастанию скорости реакции.
Неконкурентные ингибиторы образуют комплексы не с самим ферментом, а с соединением фермента с субстратом. При накоплении продукта реакции, являющегося для фермента субстратом в обратной реакции, при достаточной концентрации продукта часть фермента будет связана им, в результате скорость прямой реакции замедлится. Это так называемое ретроингибирование. Поэтому удаление продукта после распада фермент-субстратного комплекса ускоряет и увеличивает ферментативную активность. Этим фактом и объясняется более высокая величина активности щелочной фосфатазы при использовании трансфосфорилирующих буферов (АМП, ДЭА), чем нетрансфосфорил. При разведении сыворотки действие обратимых ингибиторов уменьшается, поэтому измеряемая активность фермента становится выше, чем у неразведенной сыворотки. Тормозят ферментативные реакции и некоторые антикоагулянты.
Необратимое ингибирование связано с образованием вещества, которое не может отделиться от фермента. Большинство необратимых ингибиторов разрушают структуру ферментов. Возможно внесение ингибиторов – остатков поверхностно-активных веществ — детергентов, входящих в состав моющих средств, используемых для мытья лабораторной посуды. Кроме того, известны ингибиторы, образующиеся спонтанно в растворах НАДН и НАДНФ. Поэтому вопросы стабильности растворов этих коферментов имеют чрезвычайно важное значение. Необходимо не только соблюдать сроки хранения реактивов, содержащих эти вещества, но и постоянно следить за их пригодностью, которая характеризуется определенным значением оптической плотности этого реактива, измеренной против воды при длине волны 340 нм и длине оптического пути равной 1 см. Если оптическая плотность реактива меньше значения, нормируемого изготовителем при измерении в указанных им условиях, такой реактив применять нельзя. Для того чтобы правильно оценить полученные результаты, при ручной работе такими методами необходимо предварительно измерять оптическую плотность реактива, а при работе на автоанализаторах нормированное значение оптической плотности реактива должно быть заложено в программу для метода.
Методы определения активности ферментов
Методы, используемые в клинико-диагностических лабораториях, можно подразделить на несколько групп.
Методы, основанные на измерении продукта реакции в ее конечной точке
В качестве примеров можно привести методы определения активности АсАТ, АлАТ и ЛДГ по реакции с 2,4-динитрофе. нилгидразином (метод Райтмана-Френкеля). В них кетокислоты, образующиеся в ходе реакции переаминирования под действием АсАТ (щавелевоуксусная кислота) или АлАТ (пировино-градная кислота) или окисления под действием ЛДГ (пировино-градная кислота), при взаимодействии с 2,4-динитрофенилгид-разином в щелочной среде образуют 2,4-динитрофенилгидразоны. В случае щелочной фосфатазы специфическая реакция с 4-нитрофенилфосфатом останавливается после длительной инкубации раствором щелочи, а в случае у-глутамилтрансферазы – раствором уксусной кислоты. Измеряют оптическую плотность стабильных в течение достаточно длительного времени окрашенных продуктов реакции (2,4-динитрофенилгидразонов, 4-нитрофенола, 4-нитроанилина).
Технология методов обеспечивает такие условия, что реакция инкубации пробы с субстратом развивается в течение достаточно длительного времени (30 мин). В конце ее объем полученной смеси для измерения велик, чтобы провести измерение на обычных фото колориметрах, более простых и дешевых, чем фотометры для измерений в ультрафиолетовой области. Эти методы более просты и доступны лабораториям. Но (это особенно касается АсАТ и АлАТ) отмечается их меньшая специфичность (другие кетокислоты, большой спектр лекарств завышают результаты), низкая чувствительность, меньшая точность, небольшой диапазон измерения активности, необходимость постановки холостой пробы на каждую сыворотку по сравнению с не имеющими этих недостатков кинетическими методами.
Кинетические методы
Эти методы характеризуются тем, что в ходе ферментативной реакции непрерывно или периодически через равные промежутки времени определяют потребление субстрата, кофермента или образование продукта.
Регистрируя изменение сигнала детектора (чаще всего используют фотометрические кинетические методы) в зависимости от времени, чрезвычайно важно установить линейную область этого графика (линейный участок I кривой кинетики на рис. 3.2, и участок II на рис. 3.3).
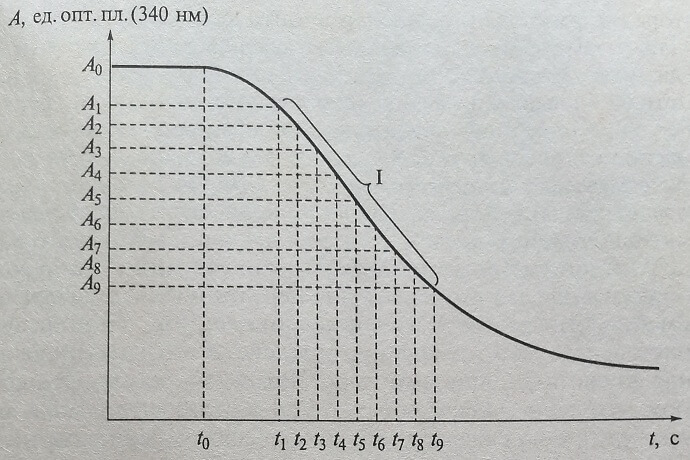
Рис. 3.2. Изменение оптической плотности (А) в зависимости от времени с момента запуска (старта) реакции при определении активности ферментов в методах, основанных на измерении уменьшения оптической плотности (УФ-тест) на фотометре FP-901 (Labsystems, Финляндия)
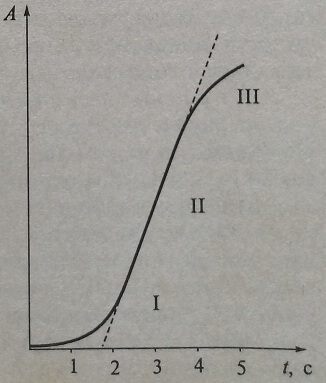
Рис. 3.3. Изменение оптической плотности (А) в зависимости от времени с момента запуска (старта реакции) при определении активности ферментов в методах, основанных на измерении увеличения оптической плотности: I – период задержки (lag phase); II – линейный участок графика, скорость увеличения оптической плотности в равные интервалы времени постоянна и максимальна; III – период истощения субстрата
Важно установить также начало линейной части кривой кинетики реакции после добавления стартового реактива (см. рис. 3.2, А0 – оптическая плотность реакционной смеси до добавления стартового реактива, t0 – момент добавления стартового реактива, (tj - t0) – период задержки выхода изменения оптической плотности на линейный участок – lag phase, delay). В течение этой фазы в реакционной смеси проходят неспецифические реакции, и все компоненты реакционной смеси приходят в состояние равновесия.
На рис. 3.3 периоду lag phase, соответствует участок I, когда так же, как и на отрезке кривой III – при истощении субстрата изменение оптической плотности в равные интервалы времени происходит нелинейно.
В современных кинетических методах определения активности ферментов для измерений избирают ту продолжительность линейной части кривой кинетики реакции, которая обеспечивает достаточную чувствительность, точность результатов и хорошую производительность метода.
В 1933 г. немецкий химик О. Варбург обнаружил эффект высокого светопоглогцения восстановленного никотинамидаденинпиридиндинуклеотида (НАДН) в ультрафиолетовой области спектра (при длине волны 340 нм) и отсутствие этого эффекта у окисленной формы – НАД. Аналогичными свойствами обладают и соли этих соединений – фосфаты. Как в фотометрических, так и флюорометрических методах определения активности ферментов и других аналитов метод известен как оптический тест Варбурга, или УФ-тест.
В зависимости от характера изменения оптической плотности в ходе реакции различают кинетические методы, в которых происходит снижение оптической плотности, например окисление НАДН сопровождается уменьшением оптической плотности в кинетических методах определения активности АсАТ, АлАТ, ЛДГ, основанных на оптическом тесте Варбурга (см. рис. 3.2), и методы, в которых происходит увеличение оптической плотности (определение активности креатинкиназы на основе оптического теста Варбурга, определение активности щелочной фосфатазы с 4-нитрофенилфосфатом, у-глутамилтрансферазы с указанными выше субстратами, а-амилазы с хромогенными субстратами) (см. рис. 3.3). Это обстоятельство имеет значение при программировании методов на фотометрических анализаторах и автоанализаторах, учитывающем направление изменения оптической плотности и все фазы ферментативной реакции.
Фаза задержки в различных методах различна и ее продолжительность относится к обязательно программируемому параметру. При ручном выполнении кинетического метода измерения оптической плотности следует начинать после фазы задержки. Надо знать продолжительность линейной части кинетического графика, в течение которой проводят измерения. Она также обязательно программируется в автоматических и полуавтоматических анализаторах, как и количество измерений оптической плотности за этот период. При этом возможно два варианта программирования:
- в программу вводят общее время реакции и интервал (в секундах), через который должно осуществляться периодическое измерение оптической плотности;
- количество измерений через равные интервалы времени на протяжении общего времени реакции.
Методы измерения начальной скорости реакции
Данные методы используют для измерения активности ферментов в тех случаях, когда скорость реакции изменяется нелинейно. Измерения должны быть проведены лишь в самом начале реакции, при использовании современных быстрых фотометров начальная скорость может быть зарегистрирована в течение нескольких сотен или тысяч миллисекунд. Для правильного определения начальной скорости проводят касательную к кривой реакции в точке t0.
Методы, основанные на измерении оптической плотности в двух точках в линейной части кинетического графика
Первая точка измерения находится в начале линейной части, вторая – через определенное время после измерения первой точки. Это так называемое псевдокинетическое измерение, или метод фиксированного времени.
В зависимости от принципа методы исследования ферментов подразделяют на каталитические методы, без использования НАД(Ф) или с использованием НАДН(Ф). К первым относятся колориметрические методы с применением хромогенных субстратов, флюориметрические методы, титриметричеекие, газометрические, электрохимические, с использованием субстратных электродов; изотопные методы, позволяющие проводить исследования на уровне клетки. Во вторую группу входят методы, основанные на оптическом тесте Варбурга (используют для определения активности более 100 ферментов); колориметрические методы, сопряженные с применением индикаторов, образующих окрашенные соединения; флюорометрические методы и др. Выделяют также некаталитические методы (иммунологические, с применением аффинной хроматографии или титрования активного центра фермента мечеными ингибиторами).
В клинико-диагностических лабораториях каталитическую активность ферментов (каталитическую концентрацию) наиболее часто определяют кинетическими (реже двухточечными) и колориметрическими методами, массовую концентрацию – иммунологическими методами.
Для расчета активности ферментов при работе методами конечной точки вместе с опытными пробами инкубируют калибровочные пробы, содержащие калибровочные растворы с определенной концентрацией образующегося в ходе реакции вещества (например, пирувата при определении АсАТ и АлАТ). Измерив оптическую плотность калибровочных растворов, строят калибровочный график и по нему находят активность фермента в опытной пробе. В случае кинетического определения вычисляют изменение оптической плотности за 1 мин и рассчитывают активность.
В случае применения единиц СИ, поскольку определяемая каталитическая активность фермента намного ниже, используют единицу нанокатал (нкат), либо микрокатал (мккат). Активность фермента в таком случае выражают числом нанокатал (микрокатал), рассчитанных на 1л сыворотки крови или 1 мг белка для ткани, размерность в этом случае – нкат/л или нкат/мг белка. Величина объёмной активности фермента выражается следующим образом:
1 МЕ/л = 16,67 нкат/л, 1 нкат = 0,06 МЕ/л.
В настоящее время для некоторых ферментов (изоферментов креатинкиназы ВВ, MB, у-глутамилтрансферазы, АсАТ, АлАТ, щелочной фосфатазы, простатической кислой фосфатазы, панкреатической a-амилазы, изофермента ЛДГ) разработаны референтные материалы (стандарты), которые можно использовать в повседневной работе и в кинетических методах определения каталитической концентрации ферментов.




