Функциональное исследование печени
Желчная функция
Исследование желчной функции печени можно производить определяя мочевые пигменты (желчные пигменты и соли, уробилин и уробилиноген) или анализируя желчь, полученную посредством зондажа 12–перегной кишки.
Методы определения мочевых пигментов были описаны в соответствующей главе, где были указаны также их патофизиологические изменения.
Дуоденальный тубаж с тестом Мельцер–Лиона производится следующим образом: утром натощак зонд Эйнгорна вводят в 12-типерстную кишку, затем через него впрыскивают 40 мл тепловатого раствора сульфата магния 33%. Спустя 5–10 минут шприцем отсасывают желтую прозрачную жидкость, которую мы назовем желчью А (жидкость из желчного протока), которую собирают отдельно в 2–3 пробирки. Продолжая отсасывать шприцем, после этого, спустя 15–30 минут, собирают 30–40 мл желчи Б (из желчного пузыря), вязкой консистенции и темно-каштанового цвета и, наконец, желчь В (печеночную) желтого цвета и весьма прозрачную.
На этих продуктах наиболее часто производятся следующие определения: физическая характеристика, альбумин, билирубин, уробилин, желчные пигменты и холестерол.
Физиологическая реакция этих трех образцов желчи является щелочной и нейтральной. При инфекциях желчного пузыря реакция желчи Б становится кислой (pH = 4,0–4,8).
Удельный вес желчи А и В обычно изменяется в пределах 1008–1 012, в то время как удельный вес желчи Б выше (1 026–1 032).
Альбумин. В норме желчь не содержит альбумина, который появляется только в случае наличия каменно-желчной болезни и при воспалительных заболеваниях печени. Для определения альбумина добавляется по каплям уксусная кислота 0,4% до нейтрализации (индикатор – лакмусовая бумажка), затем немного хлористого натрия и кипятят. Появление хлопьев свидетельствует о присутствии альбумина.
Билирубин определяется по методам, описанным для анализа крови, после того как желчь была разбавлена соответствующим образов (в 10 или более раз). Синеватый оттенок, получаемый в результате реакции сочетания объясняется избытком кислоты, а желтоватый оттенок – избытком основания. В первом случае воду, в которой разбавляют желчь слегка подщелачивают аммиаком, а во втором случае добавляют небольшое количество соляной кислоты.
Желчь А и В содержит по 25 мг на 100 мл билирубина, а желчь Б – примерно 20-кратное количество.
Билирубин снижается почти вплоть до исчезновения при механической желтухе и значительно увеличивается при гемолитической или хронической желтухе, а также при злокачественной анемии.
Уробилин определяют способом, описанным на стр. 284. В нормальной желчи уробилин отсутствует и значительно увеличивается при инфекционных болезнях желчных путей (при гепатоклеточных желтухах, циррозе печени и др.).
Желчные пигменты определяют сталагмометрическим способом. Сталагмометр Траубе наполняют желчью и высчитывают капли, затем полученное значение сравнивают с числом капель воды, стекающих из сталагмометра в одинаковых условиях. В среднем получается двойное количество капель.
Холестерин определяют методом Григо. Желчь А содержит от «следов» до 250 мг/100 мл холестерола (в среднем 20 мг/100 мл), а желчь Б – от 70 до 450 мг/100 мл (в среднем 200 г /100 мл). В патологических случаях количество холестерола в желчи Б меньше или равно количеству в желчи А.
Протидный обмен. Диспротеинемические тесты
Исследование протидного обмена производят определением небелкового азота, аминокислот и полипептидов в крови, исследование обмена креатина, а также исследованием общих белков и различных белковых фракций. Так как определение этих последних весьма трудоемко и нуждается в более сложной аппаратуре, в клинике это определение довольно часто заменяется рядом тестов диспротеинемии.
Реакция Таката-Ара
Принцип. Ртутная окись, получаемая из хлорной окиси ртути и карбоната натрия, образует коллоидный раствор, устойчивость которого поддерживается сывороточным альбумином, воздействующим в качестве
защитного коллоида. Так как глобулины не обладают этим свойством, то в растворе образуются хлопья, если в данной сыворотке соотношение между белковыми фракциями смещено в сторону глобулинов. Предел флокуляции определяется посредством системы прогрессивных разбавлений.
Реактивы:
- Изотонический раствор NaCl (0,85%).
- Раствор безводного карбоната натрия 10% для анализа.
- Раствор хлорной ртути 0,35% для анализа.
- Раствор основного фуксина 0,02%.
Реактив Таката-Ара приготовляют непосредственно перед употреблением, смешивая равные части раствора хлорной ртути 0,5% (3) и основного фуксина 0,02% (4).
Техника. Нумеруют 8 гемолизных пробирок, которые ставят на штатив, затем в каждую пробирку берут по 1 мл раствора хлористого натрия 0,85% (1). В первую пробирку добавляют 1 мл негемолизированной сыворотки, легко встряхивают, берут 1 мл таким образом разбавленной сыворотки и переводят во вторую пробирку. Из этой последней затем берут 1 мл и переводят в третью пробирку, продолжая операцию таким же образом до последней пробирки, из которой выбрасывают 1 мл. Таким образом мы получаем разбавление: 1/2, 1/4, 1/8, 1/16, 1/32, 1/64 1/128, 1/256. Затем в каждую пробирку добавляют по 0,25 мл карбоната натрия 10% (2) и 30 мл реактива Таката-Ара. Слегка встряхивают, затем оставляют в покое, при комнатной температуре до следующего дня, когда производят расчет, наблюдая за тем, в какой пробирке произошла флокуляция (ане простое помутнение).
В нормальной сыворотке не происходит никакой флокуляции, в крайнем случае, незначительная флокуляция имеет место в одной или двух пробирках (между разбавлениями 1/4 и 1/16). Реакция считается положительной, если очевидная флокуляция наблюдается по меньшей мере в 3 пробирках, первая имея место в 3-ей пробирке или в одной из последующих, и интенсивно-положительной, если флокуляция отмечается в 4 или 5 пробирках. Реакция считается слабо положительной, если флокуляция происходит в двух последующих пробирках.
Оценка теста. Реакция Таката-Ара определяет у-глобулины. С биологической точки зрения она не характеризуется специфичностью. И действительно, оно является положительной как при паренхиматозных поражениях печени, так и при некоторых инфекционных болезнях и острых или хронических воспалениях. Кроме того, эта реакция положительна при новообразованиях. Реакция Таката-Ара не может быть использована в качестве функционального теста печени, так что на практике на ее основе нельзя ставить, например, дифференциальный диагноз между циррозом и раком печени.
Реакция Гросса
Принцип. Определение минимального количества хлорной ртути, необходимого для того, чтобы вызвать флокуляцию сыворотки.
Реактив. Раствор Хайем: точно отвешивают 0,5 г хлорной ртути (сулемы), 5 г. кристаллического сульфата натрия для анализа и 2 г хлористого натрия, который растворяют в 100 мл дистиллированной воды.
Техника. В гемолитическую пробирку берут 1 мл сыворотки, затем добавляют по каплям из пипетки или бюретки раствор Хайем. После добавления каждой капли рассматривают раствор на свету для того, чтобы проверить, не появилась ли тотчас же или после кратковременного ожидания флокуляция, которая вначале может быть обратимой, после чего пробирку слегка встряхивают. Затем продолжают добавление капель и отмечают количество раствора Хайем, при котором с последней, упавшей в сыворотку каплей, в сыворотке образуется тонкое беловатое облако, исчезающее при встряхивании, а также количество, при котором помутнение, охватившее все количество сыворотки, уже не исчезает при встряхивании. Иными словами, отмечают нижний предел флокуляции и необратимую флокуляцию.
Оценка теста. Нижний предел флокуляции или необратимая флокуляция наступает в нормальных условиях при употреблении примерно 1,5 мл раствора Хайем; патологическая флокуляция находится ниже этого значения. В норме необратимая флокуляция наступает примерно при израсходовании 2,5 мл раствора Хайем, в патологических условиях необратимая флокуляция снижается параллельно нижнему пределу флокуляции.
Реакция Гросса более чувствительна, чем реакция Таката-Ара. Она предназначена также для определения у-глобулинов и используется главным образом для дифференциального диагноза между инфекционной и механической желтухой. В первом случае реакция Гросса интенсивно положительна в начале болезни, улучшаясь параллельно благоприятному течению желтухи, в то время как во втором случае, из нормальной в самом начале, она постепенно превращается в патологическую, по мере того, как продление закупорки ведет к разрушению печеночной перенхимы. В основном показания реакции Гросса совпадают с результатом реакции Таката-Ара.
Реакция с сульфатом кадмия
В две гемолитических пробирки берут по 0,4 мл негемолизированной сыворотки, при этом в первую добавляют 0,2 мл раствора сульфата кадмия 0,4%, а во вторую, служащую для контроля – 0,2 мл изотонического раствора NaCl. Отсчет производят немедленно, спустя 1 минуту и 5 минут, используя в качестве фона текст с напечатанными буквами или разлинованную чернилом бумагу.
Реакция является интенсивно положительной, если флокуляция появляется тотчас же или спустя 1 минуту, или положительной при ее проявлении спустя 5 минут. Если через 5 минут наблюдается лишь слабое помутнение, то реакцию считают слабо положительной, а если смесь остается прозрачной – реакция отрицательная.
Тест с сульфатом кадмия связан с повышением у-глобулинов, однако на него влияют также (5-глобулины и снижение альбуминов.
Эта реакция отличается высокой чувствительностью, однако она не специфична для заболеваний печени. Так, например, наряду с циррозами, желтухами и другими заболеваниями печени, она может быть положительной и при хронических нефритах, пневмопатиях, абсцессах, легочных гангренах, эндокардитах, раке легких, активном легочном туберкулезе, ряде инфекционных заболеваний.
Реакция Вельтмана
Принцип. Нормальная сыворотка, разбавленная 50 раз водой, коагулирует при кипячении лишь только если к ней добавляют известное количество электролита (раствор хлористого кальция), изменяющегося в зависимости от нормального или патологического состояния сыворотки.
Реактив. Раствор чистого кристаллического хлористого кальция 9,865%. Раствор соответствует безводному хлористому кальцию 5% и проверяется титрованием азотнокислым серебром 0,1 н. Из этого основного раствора в 12 мерных колб по 100 мл вводят следующие убывающие количества: 1 мл, 0,90 мл, 0,80 мл, 0,70 мл, 0,60 мл, 0,50 мл, 0,45 мл, 0,40 мл, 0, 35 мл, 0,30 мл, 0,20 мл, 0,10 мл и дополняют дистиллированной водой до метки. Таким образом полученные растворы хлористого кальция взбалтывают и сохраняют в бутылках с этикетками, пронумерованными соответственно: 1, 2, 3, 4, 5, 6, 6 1/2, 7, 7 1/2, 8, 9, 10.
Техника. В 12 пробирок, пронумерованных так же как и вышеуказанные, берут по 5 мл раствора, из каждого разбавления хлористого кальция, соответственно порядковым номерам, затем в каждую пробирку добавляют по 0,1 мл негемолизированной сыворотки. Хорошо взбалтывают, затем пробирки погружают на 15 минут в кипящую водяную баню, благодаря чему можно достигнуть необратимой коагуляции.
Производится отсчет последней пробирки, в которой имела место коагуляция. Отсутствие коагуляции или молочнообразная муть без осадка считается отрицательным результатом.
Оценка теста. С нормальной сывороткой коагуляция достигает пробирки 6,6 1/2 или 7. Коагуляция до пробирки номером меньше 6 (обычно между 1 и 4) считается отклонением влево или укорочением полосы коагуляции.
Коагуляция до пробирки с номером выше 7, называется отклонением вправо или удлинением коагуляционной полосы. Сокращение коагуляционной полосы, идущее вплоть до ее полного исчезновения, наблюдается при экссудативных воспалительных процессах: воспаление легких, плеврит, экссудативный легочный туберкулез, гнойные и некротические туморальные процессы, характеризующиеся ростом а- или y-глобулинов. Удлинение коагуляционной полосы наблюдается при фиброзных процессах, гемолитических процессах и при циррозах печени, характеризующихся повышением у-глобулинов. В некоторых патологических случаях безусловной глобулиновой диспротеинемии встречаются коагуляционные полосы нормального вида. Они представляют собой, так называемые, скрытые или немые реакции Вельтмана, в которых антагонистские решающие тенденции уравновешиваются, ведя к нормальному результату.
Реакция с сульфатом цинка или меди
Принцип. Раствор сульфата цинка или сульфата меди осаждаем сыворотки, содержащие повышенное количество у-глобулинов. Парад, предельный рост альбумина ингибирует реакцию, в то время как его снижение ведет к усилению реакции, поскольку альбумин оказывает значительное тормозящее действие на осаждение у-глобулинов.
Реактивы.
- Раствор сульфата цинка 24 мг°/00 в буфера pH = 7,2 (растворяют 280 мг барбитуровой кислоты и 210 мг барбитурата натрия в 1000 мл дистиллированной воды).
- Раствор сульфата меди 0,23 г °/00. Этот раствор разбавляют в 10 раз непосредственно перед употреблением, так как концентрированный раствор при хранении не портится, в то время как способность осаждения разбавленного раствора снижается через несколько дней.
Техника. К 0,05 мл сыворотки добавляют 3 мл реактива (1) или (2). Оставляют в покое на 30 минут, затем мутность отсчитывают на фотометре Пульфриха, используя кювету на 5 мл и синий фильтр на 470 мл. Отсчет производят на черных абсорбционных делениях барабана. Окончательный результат получается вычитая из 100 полученную цифру.
Оценка теста. В случае сульфата цинка тест считается отрицательным для абсорбции в пределах 0–30 и положительным для значений превышающих 30. В случае сульфата меди тест является отрицательным для абсорбции в пределах 0–15 и положительным для значений выше 15.
Тест с сульфатом цинка является положительным при диффузных заболеваниях печени, ревматоидном артрите, остром гломерулонефрите, эритематозной волчанке, скарлатине (по-видимому в связи с образованием антител), язвенном колите и множественной миэломе. Положительность реакции в стадии конвалесценции указывает на рост глобулинов, и следовательно развитие в сторону цирроза, то есть угрожающий прогноз.
Эта проба полезна также для наблюдения за случаями цирроза печени, так как между интенсивностью реакции и развитием цирротического процесса существует известный параллелизм.
Тимоловая реакция
Принцип. Разбавление сыворотки насыщенным раствором тимола, доведенным до pH =7,8 вызывает селективное осаждение параглобулина, получаемого в результате разрушения печеночной паренхимы. Реакция является еще более сильной, если рост глобулинов сопровождается снижением альбуминов.
Реактивы.
- Раствор тимола, доведенный до pH = 7,8: отвешивают 1,38 г диэтилбарбитуровой кислоты, 1,03 г натриевого веронала (диэтилбарбитурат натрия) и 3 г хорошо размельченного в ступке тимола, добавляют 500 мл дистиллированной воды и нагревают до кипения, энергично размешивая для растворения тимола, после чего дают остыть. Так как раствор мутный, добавляют несколько небольших кристаллов тимола в качестве затравки для кристаллизации избытка тимола, затем оставляют в покое до следующего дня, когда фильтруют после предварительного энергичного взбалтывания. Во избежание осаждения тимола раствор сохраняют при температуре от 20 до 25°. Значение pH буферного раствора необходимо тщательно проверить (индикатор – фенол красный) непосредственно перед употреблением и в случае необходимости корректировать, добавляя веронал или натриевый веронал.
- Стандартный раствор кристаллического хлористого бария 1,15%. Из этого стандартного раствора приготовляют следующий основной раствор, дающий опалесценцию, эквивалентную 20 единицам Мак Латана: в мерную колбу на 100 мл берут 3 мл стандартного раствора и добавляют до метки серной кислоты 0,5 н., охлаждая колбу струей воды.
Основной раствор разбавляется затем серной кислотой 0,5 н., согласно схеме, приведенной в таблице XXXVIII, причем получается серия, состоящая из 10 эталонов.
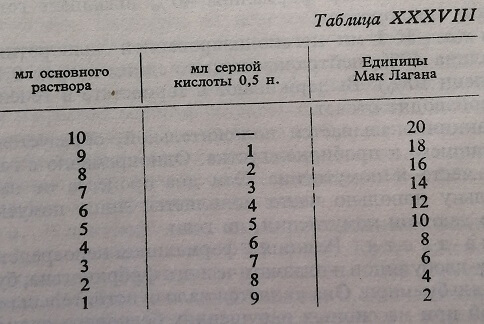
Разбавления приготовляют в серии пробирок из одинакового стекла, толщины и диаметра, причем их используют для построения калибровочной кривой на фотометре Пульфриха, производя отсчет с синим фильтром на 470 М[А и кюветой на 5 мм, используя в качестве контрольного образца смесь, состоящую из 0,1 мл сыворотки и 6 мл изотонического раствора NaCl, причем если не располагают фотометром, пробирки запаиваются на пламени. На эти эталоны наклеивают этикетки, с указанием концентрации в единицах Мак Лагана. Их можно использовать в течение продолжительного времени.
Техника. В пробирку берут 0,1 мл негомолизированной сыворотки, добавляют 6 мл буфера (1). Слегка встряхивают и оставляют в покое на 30 минут, после чего сопоставляют с серией эталонов, которые необходимо предварительно энергично взбалтывать для того, чтобы помутнение было равномерным, определяя соответствующее помутнение в единицах Мак Лагана или производя отсчет оптической плотности на фотометре Пульфриха.
Оценка теста. Реакция является отрицательной в пределах 5–10 единиц Мак Лагана, слабо положительной в пределах 5–10 единиц и положительной – свыше 10 единиц. Тест является положительным при диффузных заболеваниях печени (гепатиты, циррозы), туберкулезе малярии и злокачественном эндокардите.
Относительно небольшая сфера положительности этого теста дает возможность использовать его в качестве функционального теста печени. С его помощью чаще всего можно отдифференцировать гепатическую желтуху от обструктивной, разумеется, если эта последняя не слишком застарела и не достигла стадии, в которой может быть уже поражена и печеночная клетка как таковая. При раке печени, в отличие от цирроза, тимол является отрицательным. Вместе с тем этот тест может служить для дифференциации злокачественного эндокардита от ревматического, при котором он может быть в крайнем случае слабо положительным.
Реакция с формалином
Принцип. Раствор формалина 40% вызывает гелеобразование в патологических сыворотках.
Техника. К 1 мл негемолизированной сыворотки добавляют 2 капли формалина 40%, нейтрализованного едким натром 0,1 н. (индикатор — фенолфталеин 10%). Выдерживают в термостате в течение 3 часов при 37°, затем производят отсчет.
Если реакция оказывается положительной, образуется плотный гель в виде приставшего к пробирке сгустка. Одновременно с гелеобразованием может иметь место и помутнение. Эти два процесса не зависят друг от друга, поскольку довольно часто появляется лишь помутнение. В норме сыворотки не дают ни помутнения, ни гели.
Оценка теста. Реакция с формалином непосредственно связана с повышением у-глобулинов и плазматического фибриногена, будучи связана и со снижением альбуминов. Она является мало чувствительным тестом, будучи положительной при массивных нарушениях белкового равновесия, как это встречается при далеко зашедших циррозах, септицемиях или других инфекционных острых или подострых тяжелых заболеваниях, при некоторых тропических болезнях (Кала-Азар), лейкемиях, нефритах, нефрозах и др.
Реакция с цефалином-холестерином
Принцип реакции находится в связи с ростом у-глобулинов.
Реактив. Экстрагируют 100 мл цефалина и 300 мл холестерола, используя для этого 8 мл эфира. 1 мл эфирного экстракта нагревают с 35 мл дистиллированной воды на водяной бане при 65–70°; затем объем сокращают выпариванием до 30 мл. Оставляют для охлаждения, после чего получается реактив, имеющий вид эмульсии.
Техника. К 0,2 мл сыворотки добавляют 4 мл изотонического раствора NaCl и 1 мл эмульсии и затем оставляют в покое до следующего дня, когда производят отсчет мутности или флокуляции.
Оценка теста. В норме сыворотка нё вызывает какой-либо флокуляции. Несмотря на то, что речь идет о специфическом тесте для печени, он является положительным в 90% случаев при эпидемическом гепатите и отрицательным в 80–85% случаев при механических желтухах. Таким образом, он может быть использован для дифференциального диагноза между этими двумя формами желтухи.
Протромбиновое время (квика)

Принцип. Определение времени коагуляции плазмы в присутствии оптимальных количеств кальция и тромбопластина.
Реактивы.
- Оксалат натрия 0,1 м. Растворяют 1,339 г оксалата натрия в 100 мл дистиллированной воды в мерной колбе.
- Хлористый кальций 0,1 м. Растворяют 0,28 г безводного хлористого кальция в 100 мл дистиллированной воды в мерной колбе.
- Изотонический раствор NaCl.
- Тромбопластин. Очищают от мозговой оболочки и сосудов свежий мозг кролика, хорошо промывают водой, затем растирают в ступке до получения однородной пасты, которую размазывают на дне кристаллизатора и высушивают в термостате при 39°. Полученный порошок сохраняют в герметически закрытых запарафинированных банках. Для употребления приготовляют эмульсию из 0,2 г порошка и 0,3 мл изотонического раствора NaCl. Эту эмульсию можно использовать только, если она вызывает свертывание плазмы здорового человека в течение 18–22 секунд, так как в противном случае ее необходимо заменить.
Техника. В центрифужную пробирку собирают быстро и без стаза 9 мл крови на 1 мл оксалата натрия 0,1 м (1). Кровь смешивают с антикоагулянтом, затем центрифугируют при 1600 – 20С0 об/мин. до полного отделения плазмы. К 0,1 мл плазмы добавляют 0,1 мл свежеприготовленной эмульсии тробмопластина. Пробирку погружают в водяную баню при 37°5, оставляют на 1 минуту, затем быстро добавляют 0,1 мл 0,025 м хлористого кальция (2) и немедленно взбалтывают, одновременно приводя в действие хронометр.
Выдерживают в бане, наблюдая за моментом коагулирования плазмы, выражающимся в образовании плотного сгустка. Хронометр останавливают и отсчитывают необходимое для коагуляции время.
Время свертывания нормальной плазмы составляет 12–22 секунды при 37°5. Оно снижается при заболеваниях печени, пропорционально степени развития болезни. Этот тест является полезным для исследования печени, так как протромбин вырабатывается этим органом.
Оценка диспротеинемических тестов
Большинство диспротеинемических тестов считались вначале функциональными тестами печени. Подобное представление не учитывало то обстоятельство, что печень, несмотря на то, что она является основным местом образования белков, представляет собой лишь один из протеино-образующих органов. Опыт показывает, что диспротеинемические тесты положительны при любом нарушении равновесия белковых фракций, то есть в любом состоянии диспротеинемии. Ныне диспротеинемические тесты считаются специфическими качественными тестами, отражающими моментное равновесие между плазматическими фракциями. Диспротеинемические состояния характеризуются изменением количественных соотношений между белковыми компонентами плазмы, так что достигается новое плазматическое равновесие, отличающееся от нормального. Эти изменения плазматического равновесия – диспротеинемии – наблюдаются при ряде заболеваний весьма разнообразного происхождения. Так, например, при протеинемии могут явиться следствием недостаточного подвоза белка истощение, рвоты, хронический понос и др.) или утраты белков (геморрагии, почечные заболевания: амилоидоз, гломерулонефрит и др.).
Кроме того, диспротеинемии возникают вследствие нарушения процесса синтеза белков (острые токсические или инфекционные гепатиты, хронические гепатиты, циррозы и др.), а также случаи наличия острых воспалительных экссудативных поражений (острый полисуставной ревматизм, плеврит, перикардит, перитонит, пневмония, бронхопневмония, острый холецистит и др.) или хронические, пролиферативные склерогенные (бронхоэктазм, легочные абсцессы, медленный эндокардит; легочный туберкулез) и наконец, при злокачественных опухолях и некоторых болезнях крови (злокачественный лимфогрануломатоз, острый лейкоз и др.). Следовательно, тесты диспротеинемии не отражают характерных явлений какой-либо определенной болезни, а являются положительными при всех заболеваниях, при которых диспротеинемия представляет собой семиологическое проявление болезни. Несмотря на это, рассматриваемые с критической позиции и сопоставляемые с данными, которые можно получить с помощью других средств клинического исследования, они могут дать довольно ценные сведения для постановки диагноза и назначения лечения. Указания, которые получаются с помощью каждого отдельного теста имеют меньшую ценность. При этом, в результате сочетания нескольких тестов, как например Таката-Ара, сульфат кадмия и тимол, можно разработать « групповые тесты», более или менее характерные для определенных групп болезней. Повторное проведение диспротеинемических тестов в течение развития различных заболеваний, как например диффузные поражения печени, дает возможность получить ряд данных, приносящих известную пользу для прогноза. Их отрицательность указывает на прекращение патологического процесса, в то время как усиление некоторых из них, как например тимола, и положительность других, как сульфата цинка, свидетельствует о том, что болезнь развивается в сторону ухудшения или хроницизации, несмотря на наличие ложной картины клинического излечения.
Глюцидный метаболизм
Тест вызванной галактозурии
Принцип: Тест основан на свойстве печени быть единственным органом, способным превращать галактозу в глюкозу, из которой она затем синтезирует глюкоген, в связи с чем наличие поражения печени отражается количественным ростом выделяемой через мочу галактозы.
Реактивы:
- Растворы Фелинга I и II.
- Ферроцианид калия 5%.
Техника. Утром, в день произведения теста, больной остается в постели, а в 8 часов опорожняет пузырь, сохраняя мочу, затем принимает 40 г галактозы, растворенной в 200 мл воды. Затем больной должен находиться на молочном или вегетарианском режиме, причем он должен в последующем лежать в постели. Если эти условия неосуществимы, принимаются во внимание только первые два образца мочи, собранные после приема галактозы. Затем мочу собирают через 2, 4, 10 и 24 часа, в отдельные банки, пронумерованные I, II, III, IV.
а) Установление фактора раствора Фелинга.
В колбу Эрленмейера берут 10 мл раствора Фелинга I, 10 мл раствора Фелинга II и 5 мл ферроцианида калия 5%. Добавляют 20 мл дистиллированной воды, доводят до кипения и титруют стандартным раствором галактозы 5%о (1 мл содержит 5 мг галактозы), поддерживая жидкость все время в состоянии кипения до тех пор, пока внезапно не появится бурая окраска. В основном необходимо израсходовать 9 мл раствора галактозы, то есть 45 мг галактозы. Следовательно, в этом случае, фактор составляет m 0,045.
б) осаждение образцов мочи производят реактивом Куртона.
Определение галактозы. В моче, собранной перед дачей галактозы, производят обычный качественный анализ раствором Фелинга для выявления возможного наличия глюкозы.
В остальных 4 образцах галактозу определяют по способу изложенному при установлении фактора, причем титруют очищенной мочой.
Получаемые результаты умножают на 1,1 для корректирования разбавления, производимого осаждающим веществом.
Оценка теста. Нормальный субъект выделяет менее 6 г/л галактозы в первом образце и менее 1,5 г/л во втором; в остальных двух образцах галактоза отсутствует.
При остром гепатите концентрация галактозы колеблется в пределах 30-70 г/л в первом образце и 15-20 г/л во втором, отсутствуя в последних двух образцах. При хроническом гепатите (циррозе) обнаруживаются последующие количества галактозы: образец I : 8–15 г/л; II – 6–8; III – 4–5 г/л; IV – 0–2 г/л.
Липидный обмен
Исследование липидного обмена производят главным образом определением общего, свободного и этерифицированного холестерола; при этом печень играет в синтезе, этерификации и удалении этого вещества преобладающую роль. При механической желтухе ветре, чаются гиперхолестеролемии, в то время как при гепатитах и некоторых недостаточностях печени наблюдаются гипохолестеролемии.
Соотношение этерифицированный холестерол/нормальный общий холестерол при вне-печеночных заболеваниях значительно снижается при тяжелых формах недостаточности печени. С этой точки зрения снижение этерифицированного холестерола является специфическим тестом недостаточности печени: тест эфиров.
Функция сопряжения (антитоксическая)
Тест с гиппуровой кислотой
Принцип. Тест основан на свойстве печени сопрягать бензойную кислоту с гликоколом, образуя гиппуровую кислоту, выводимую через мочу.
Техника. В 8 часов утра больной опорожняет мочевой пузырь и выбрасывает мочу, затем принимает натощак 6 г бензоата натрия, растворенного в 30 мл воды. Мочу собирают в последующие 4 часа после приема бензоата, замеряют и отмечают объем. Если этот объем превышает 125 мл, его сокращают кипячением, после того как моча была предварительно подкислена ледяной уксусной кислотой. Затем, непрерывно помешивая, добавляют соляную кислоту до тех пор, пока моча не станет кислой при контакте с бумагой Конго (синий цвет). Продолжают помешивать, растирая об стенки стеклянной палочкой еще 3–4 минуты, пока не начнется кристаллизация, затем оставляют в покое на 1 час при комнатной температуре. Белый осадок гиппуровой кислоты фильтруют через воронку Бюхнера с тарированной фильтровальной бумагой, затем сушат в термостате или даже на воздухе, оставив воронку покрытой фильтровальной бумагой до следующего дня.
Взвешивают, и таким образом получают вес гиппуровой кислоты в виде разницы между двумя взвешиваниями.
Оценка теста. Тест отражает ход процессов синтеза в организме вообще и в частности – в печени. Нормальный субъект выделяет 4,0–4,5 г гиппуровой кислоты в течение 4 часов. Значение менее 3,5 г гиппуровой кислоты, выведенных в течение 4 часов, считается патологическим, свидетельствуя о недостаточности печени.
При недостаточности печени, изменения галактозы и гиппуровой кислоты имеют место в обратном направлении: концентрация галактозы увеличивается, а концентрация гиппуровой кислоты снижается.
Экскреторная функция
Тест с бромсульфонфталеином
Принцип: Бромсульфонфталеин выводится из кровотока ретикуло- эндотелиальными клетками печени, а паренхиматозные клетки его выбрасывают в желчь. В случае поражения печеночной паренхимы выведение красителя снижается, вследствие чего он может быть обнаружен в крови в течение более продолжительного промежутка времени.
Реактивы:
- Раствор, получаемый растворением 5 г красителя в 100 мл физиологического раствора фильтруют и стерилизуют при 120° в течение 20 минут. Раствор можно сохранять в течение 2–3 месяцев в темном месте.
- Едкий натр 10%.
Техника. Берут 5 мл венозной крови (образец I), затем больному внутривенно инъецируют по 1 мл стерильного раствора бромсульфон- фталеина на 10 кг веса (в среднем 6 мл). Затем берут по 5 мл крови спустя 3 минуты (образец II) и 45 минут (образец III) после инъекции. Сыворотку отделяют, берут по 1 мл и добавляют к каждому образцу по 4 мл физиологического раствора и 2 капли едкого натра 10%.
Взбалтывают и отсчитывают затухание образца II (Ех ) и III (Е2), сопоставляя с образцом I, используемым в качестве контрольного, на фотометре типа Пульфриха с желтым фильтром на 570 мх и кюветой на 5 мм.
В нормальных условиях удержание красителя спустя 45 минут составляет 5% или меньше. При поражениях печеночной паренхимы краситель удерживается в значительных количествах (6–50%). Значимость теста состоит главным образом в том, что им можно пользоваться для обнаружения поражения почечной паренхимы в случаях с аниктерическим течением.




