Функциональные пробы печени
Постановка сулемово-фуксиновой пробы (реакция Таката-Ара)
Оснащение рабочего места
- Штативы.
- Градуированные пипетки на 1, 2 и 5 мл.
- Капельницы.
- Пробирки.
- Бюретка.
- Основной фуксин.
- Сулема (HgCl2).
- Поваренная соль.
- Углекислый натрий.
- Дистиллированная вода.
Для исследования необходима сыворотка крови.
Сущность пробы
Коллоидная окись ртути (HgO) нарушает коллоидную устойчивость сыворотки крови и вызывает коагуляцию (свертывание) белков. Это составляет сущность реакции.
Для данной пробы используют следующие реактивы:
- Физиологический раствор поваренной соли.
- 10% раствор углекислого натрия. Раствор готовят из предварительно прокаленного и охлажденного углекислого натрия: 10 г безводного углекислого натрия растворяют в небольшом количестве воды в 100-миллплитровой колбочке и доводят водой до метки.
- 0,5% раствор сулемы: 0,5 г химически чистой сулемы растворяют в 70-80 мл дистиллированной воды в колбе на 100 мл при нагревании, затем охлаждают и доливают водой до метки.
- 0,02% раствор фуксина: 0,02 г основного фуксина растворяют дистиллированной водой в мерной колбе на 100 мл.
- Смесь 0,5% раствора сулемы и 0,02% раствора фуксина. Готовят смешением двух названных реактивов в равных объемах непосредственно перед исследованием.
Техника определения
В штатив помещают четыре небольшие пробирки, нумеруют их и в первую наливают 3,5 мл, а в три остальные по 1 мл физиологического раствора. В первую пробирку добавляют 0,5 мл негемолизированной сыворотки и смешивают, после чего из первой пробирки во вторую, из второй в третью, из третьей в четвертую переводят по 1 мл смеси. Из четвертой пробирки выливают 1 мл смеси. Во все четыре пробирки добавляют по одной капле раствора углекислого натрия и взбалтывают.
В отдельной пробирке смешивают взятые в равном объеме 0,5% раствор сулемы и 0,02% раствор основного фуксина и в каждую из четырех опытных пробирок наливают по 0,3 мл приготовленного реактива. Пробирки встряхивают и наблюдают за выпадением осадка, который является показателем положительной реакции.
Учет реакции
Если осадок выпадает сразу, то реакция считается резко положительной ( + + + ), если через 2 часа — положительной ( + + ), если же осадок выпадает в течение 24 часов — слабо положительной (+).
Примечание. Положительной реакция считается в том случае, если осадок образуется в трех последовательных пробирках. Помутнение раствора в расчет не принимается. Отсутствие осадка в пробирках свидетельствует об отрицательной реакции. Постановку реакции Таката — Ара следует проводить при температуре 16-20°.
Постановка сулемовой пробы Гринстеда
Сущность метода такая же, как и реакции Таката—Ара. Для данной пробы используют следующие реактивы:
- 0,1% водный раствор сулемы.
- 0,9% раствор поваренной соли.
Техника определения
В бюретку с делениями по 0,01 мл наливают 0,1% раствор сулемы. В пробирку диаметром приблизительно около 15 мм наливают 0,5 мл свежей исследуемой сыворотки, добавляют 1 мл 0,9 % раствора NaCl и титруют содержимое пробирки 0,1% раствором сулемы по каплям на черном фоне до появления стойкого помутнения. При положительной реакции стойкое помутнение появляется внезапно.
Количество 0,1% раствора сулемы, пошедшей на титрование, учитывают в миллилитрах. В норме на титрование расходуется от 1,5 до 2,2 мл 0,1% раствора сулемы.
Постановка коагуляционной пробы Вельтмана
Оснащение рабочего места
- Штативы.
- Градуированные пипетки на 1, 2 и 5 мл.
- Пробирки.
- Водяная баня.
- Колбочки на 100 мл.
- Хлористый кальций.
Для исследования необходима сыворотка крови.
Сущность пробы
В основу метода положено изменение коллоидной стабильности белков сыворотки под влиянием различных концентраций хлористого кальция при температуре кипения.
Для этой пробы необходимы следующие реактивы.
- 10% раствор СаСЬ: взвешивают 10 г хлористого кальция безводного или 19,8 г кристаллического хлористого кальция и растворяют в 10 мл дистиллированной воды.
- 0,1% раствор СаС12: 1 мл 10% раствора СаС12 наливают в мерную колбу на 100 мл и доливают водой до метки.
Техника исследования
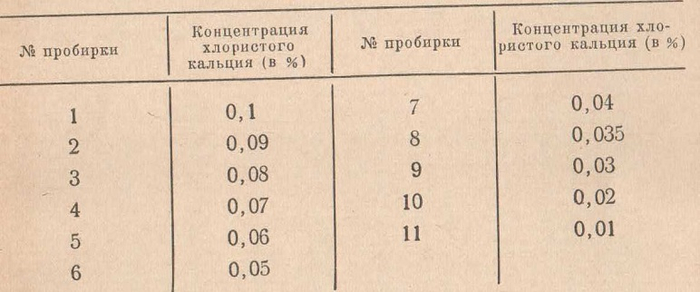
В штатив устанавливают 11 пробирок, нумеруют их, наливают реактивы по следующей схеме: и получают следующее содержание хлористого кальция в процентах:
Пипетка не должна касаться реактива, находящегося в пробирке.
Перемешав содержимое пробирок путем вращения их между ладонями (при этом не следует допускать появления пены), штатив с пробирками помещают точно на 15 минут в кипящую водяную баню. Через 15 минут штатив с пробирками вынимают и тотчас же учитывают результат. Положительной реакция считается при выпадении хлопьев с просветлением жидкости над ними. Помутнение в расчет не принимают (рис. 91).
Рисунок 91. Проба Вельтмана. Тип реакции: нормальный (а), удлиненный (б), укороченнный (в).
Учет реакции производится по числу пробирок с положительной реакцией, которые образуют зону хлопьеобразования - «коагуляционную ленту». В норме выпадение хлопьев (коагуляцию) отмечают в первых шести пробирках. Если хлопья выпадают до шестой пробирки, реакцию считают укороченной (сдвиг влево), при наличии коагуляции в седьмой, восьмой и т. д. пробирках — удлиненной (сдвиг вправо) (см. рис. 91).