Гомогенизация биологических тканей - устройства и способы
В связи с отсутствием теоретической базы гомогенизация тканей до сих пор является недостаточно совершенным методом.
Большинство существующих в настоящее время методов фракционирования не обеспечивают абсолютную сохранность морфологической структуры и активности клеточных компонентов. Компоненты, как и сами клетки тканей, являются гетерогенными, и в связи с этим анализ выделенных фракций дает усредненные данные о их составе. Имеется общее правило: трудность выделения клеточных фракций прямо зависит от содержания в органе соединительной ткани.
Для стандартизации операции гомогенизации тканей большое значение имеет температурный режим забора тканей, а также соблюдение его в процессе гомогенизации. Это одна из трудностей стандартизации условий гомогенизации.
Обязательным является проведение процедуры гомогенизации тканей любым способом при пониженной температуре (около 0°С). Это обусловлено тем, что в большинстве случаев при разрушении тканей и клеток выделяется тепло. Повышение температуры отрицательно влияет на активность ферментов и других биологически активных веществ.
Приготовление гомогенатов тканей и клеток
При изучении метаболических процессов необходимо сохранить морфологическую структуру ткани.
На первом этапе фракционирования органелл клеток (гомогенизации) разрушаются ткани, клеточные стенки и мембраны с освобождением клеточного содержимого. В результате получают гомогенат (суспензию) субклеточных частиц. Затем на втором этапе (разделении) происходит группирование отдельных компонентов гомогената на основании таких их физических свойств, как размер и плотность.
Различные ткани отличаются по хрупкости клеточных органелл и устойчивости клеток к разрушению. Это сказывается на процессе гомогенизации любого биологического материала и приводит к возникновению проблем, решение которых часто сопровождается пробами и ошибками.
Гомогенизация и фракционирование позволяет установить внутриклеточную локализацию метаболических процессов. Как и в проблеме гомогенизации нет объективных критериев для выбора той или иной среды гомогенизации.
Разработаны индивидуальные прописи по сохранению целостности частиц и защите ферментов от инактивации. В их состав входят такие вещества, как ЭДТА, глутатион, бета-меркаптоэтанол и др. Для предохранения частиц от набухания и разрыва пользуются раствором сахарозы, с помощью которого создают необходимое осмотическое давление.
Ядра и хромосомы выделяют с использованием лимонной кислоты. Для выделения ядер применяют также растворы глицерина и этиленгликоля, а для хлоропластов вместо сахарозы — маннит и сорбит.
При выделении ферментов из растительных экстрактов используют поливинилпирролидон. Он образует нерастворимый комплекс с фенолами, которые появляются в процессе гомогенизации и отрицательно влияют на определение активности ферментов.
Иногда в зависимости от специфических объектов исследования для выделения субклеточных органелл применяют неводные среды (смесь органических растворителей различной плотности).
Большое влияние на процесс фракционирования оказывает pH среды. Наиболее оптимальным является pH в пределах 7,4-7,8. Кроме pH для фракционирования имеет значение электролитный состав среды. Под действием высоких концентраций солей в среде изменяется плотность субклеточных структур и увеличивается их агглютинация.
Ионы калия сохраняют более длительно дыхание изолированных митохондрий, а ЭДТА (в концентрации 1 -5 ммоль) способствует целостности митохондриальных и микросомальных структур. Для забуферирования сахарозных растворов чаще всего применяют фосфатный буфер или трисбуферы и др. Подробное описание сред и методов гомогенизации приводится в обзоре V. Allfrey (1959), сведения о буферных растворах — в книге R. М. Dawson, D. С. Elliot, W. Н. Elliot, К. М. Jones (1969).
Способы разрушения клеток
К физическим методам разрушения клеток относятся методы разрушения под действием сил трения между клетками и твердыми веществами и разрушение в жидких средах.
При разрушении клеток с твердыми материалами их растирают с песком или абразивным порошком в ступке при помощи пестика. Указанным методом чаще пользуются для разрушения растительных и бактериальных клеток. Хороших результатов добиваются, продавливая клетки через пресс Хьюза. Клетки перед тем смешивают с абразивными частицами.
Для разрушения бактериальных клеток применяют также метод механического встряхивания суспензии частиц с абразивным порошком с частотой 300-3000 колебаний в минуту при помощи встряхивателя Микля.
Разрушение клеток с помощью высокого давления
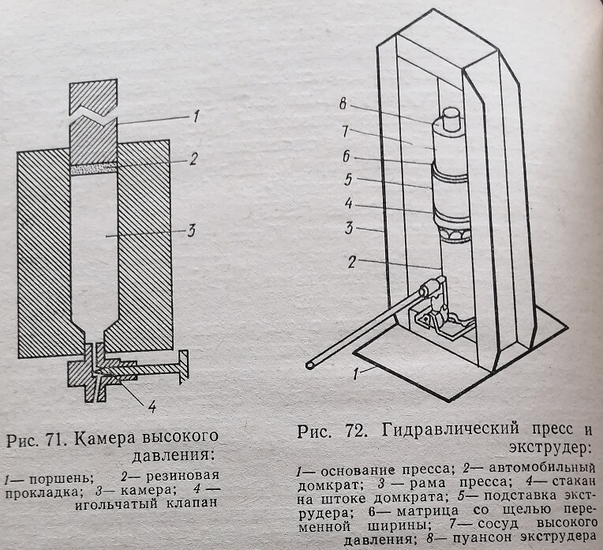
Метод пригоден в основном для разрушения микробных клеток. При этом используют специальные прессы (например, френч-прессы, рис. 71).
С целью разрушения суспензию клеток загружают в камеру 3 при закрытом кране игольчатого клапана 4. При помощи гидравлического пресса создают давление на поршень, затем открывают клапан: в момент открытия клетки лопаются.
Одним из методов деструкции клеток является метод разрушения их в замороженном состоянии, когда ткань продавливается через отверстие. Для реализации указанных методов применяют специальные приборы — экструдеры. На рис. 72 показан один из таких приборов (М. О. Биргep, А. Н. Кузиков, Б. В. Сизов, 1978).
Разрушение с помощью ультразвука
При обработке клеточных суспензий высокочастотными ультразвуковыми колебаниями происходит их разрушение. Полагают, что оно наступает вследствие высокочастотного изменения давления. Недостатком метода является разогревание материала
Разрушение тканей и клеток в жидких средах
Этот метод наиболее широко применяется в биохимических исследовательских лабораториях. Для разрушения клеток, находящихся в виде суспензии, используют блендеры с режущими лопастями, вращающимися с большой скоростью. Процесс ведут в специальном стакане, который для охлаждения помещают в лед. Метод широко применяется для фракционирования клеток.
В настоящее время разработаны различные гомогенизаторы цельных тканей и клеток. Каждый из них имеет определенные преимущества и недостатки.
Лаборатории по своему усмотрению конструируют гомогенизаторы по определенному проекту или пользуются зарубежными далеко не совершенными образцами. На рис. 73 показаны наиболее распространенные в лабораторной практике гомогенизаторы.
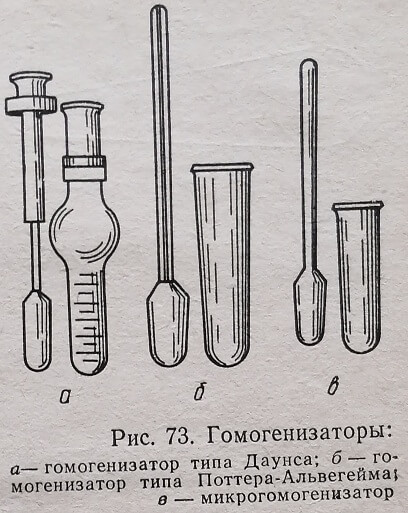
Большинство гомогенизаторов имеют пестик с ручным или механическим приводом, который вращается и движется вверх и вниз в цилиндрическом сосуде (стакане). Пестик и стакан гомогенизаторов изготовляют из стекла или, чаще, из фторопласта. Некоторые конструкции гомогенизаторов описаны в работах D. Е. Hughes, V. R. Cunninghaw (1963), С. F. Emanuel, I. LChaikoff (1957), N. Aldvidge и соавторов (1960).
Подготовленные и взвешенные для гомогенизации кусочки ткани помещают в стакан гомогенизатора и до-
бавляют раствор сахарозы в соотношении с тканью 1:9 (масса, объем). Кусочки ткани сначала осторожно разминают, а затем соединяют пестик с моторчиком и гомогенизируют при 800-1200 об/мин при постоянном движении пестика вверх и вниз. Вся процедура гомогенизации должна проходить на холоде. Для этого стакан гомогенизатора погружают в ледяную ванну. При наличии холодовых комнат гомогенизацию осуществляют в них. Время гомогенизации каждый раз устанавливается эмпирически и зависит от взятой для гомогенизации ткани.
Приведенный способ гомогенизации по сравнению с другими более щадящий.
Другие методы разрушения тканей и клеток
Клетки можно разрушать также методом осмотического шока или переваривания клеточных стенок ферментами.
Для разрушения некоторых видов клеток используют замораживание и оттаивание, автолиз и обработку органическими растворителями.
При любом способе гомогенизации должен применяться морфологический контроль. С этой целью часто используют для окраски клеточных элементов 0,1% раствор кристаллвиолета. Затем подсчитывают неразрушенные клетки на 1000 ядер.
Перед окончательным фракционированием гомогенат должен быть освобожден от неразрушенных клеточных элементов и соединительнотканных волокон. С этой целью его продавливают через слои дарашютного шелка. После этого гомогенат используется для выделения субклеточных структур с помощью различных методов.
В данной главе приводится описание сконструированных нами устройств, разработанных способов, которые позволяют механизировать процесс гомогенизации, интенсифицировать и стандартизировать условия его oсуществления.
Устройство для механизации процесса гомогенизации тканей
Еще не все лаборатории обеспечены заводскими комплектами гомогенизаторов биологических тканей с электрическими моторами, например, марки МШ-2. В связи с этим гомогенизацию тканей для получения клеточных фракций во многих лабораториях проводят вручную в соответствующих гомогенизаторах. Разработанное нами устройство позволяет механизировать процесс гомогенизации (рис. 74).
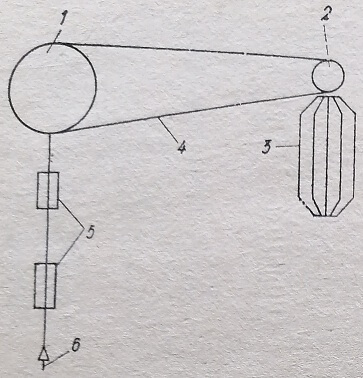
Рис. 74. Устройство для механизации процесса гомогенизации тканей: 1 — ось со шкивом; 2— шкив; 3 — электромотор; 4 — передача; 5 - фиксатор; 6 — муфта с резьбой
Электромотор 3 и ось 1 укрепляют на лабораторном столе. Под пестик подводят стакан гомогенизатора - с помещенной в него тканью и буферным раствором. Включают электромотор в сеть. Происходит вращение оси 4 с соответствующей скоростью. С такой же скоростью вращается пестик гомогенизатора в стакане, который соединен с осью. Исследователь во время вращения пестика только поднимает вверх и опускает вниз стакан гомогенизатора. При необходимости и этот ручной труд можно механизировать с помощью специального приспособления. Необходимой скорости вращения пестика добиваются соответствующим соотношением диаметров шкивов на оси.
Мощность комплектуемого в устройстве электромотора определяется максимальным количеством подлежащих гомогенизации тканей и размерами гомогенизатора. При этом к муфте 6 можно присоединять приводы различных размеров пестиков, а соответственно и стаканов гомогенизаторов.
Усовершенствованные гомогенизаторы тканей для биохимических исследований
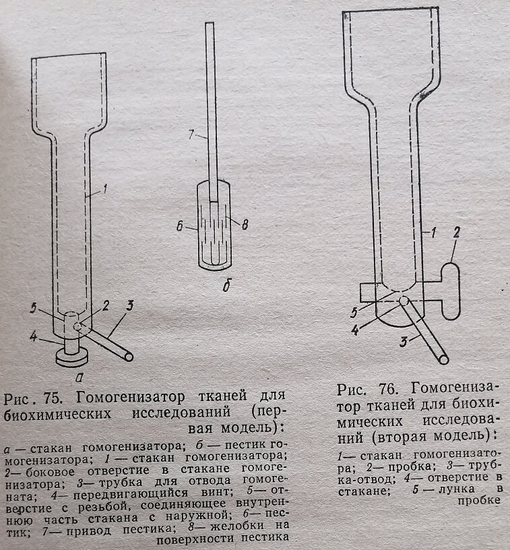
Нами разработаны и сконструированы две модели гомогенизаторов тканей. Первая модель показана на рис. 75. В выполненном стакане гомогенизатора в нижней части делают отверстие 5 с резьбой.По диаметру этого отверстия и в соответствии с имеющейся в нем резьбой изготовляют винт 4. Поверхность концевой части винта является сферической и соответствует таковой в дне стакана. Аналогично делают отверстие 2, в которое вставляют отвод 3. Пестик 6 изготовляют из плексигласа. На его поверхности делают желобки 8, расположение которых показано на рис. 75. Диаметр пестика соответствует диаметру внутренней части стакана гомогенизатора. Он в комплексе со стаканом обеспечивает гомогенизацию ткани. Пестик 6 соединен с приводом 7 посредством резьбы.
Перед гомогенизацией винт 4 ввинчивают до дна внутренней поверхности стакана. Для этого на наружной части винта имеется метка, указывающая это положение. В стакан гомогенизатора вносят ткань и жидкую среду (буферный раствор). Проводят гомогенизацию ткани в соответствии с той или другой методикой. После этого винт 4 вывинчивают ниже отверстия 2 и через отвод 3 выливают гомогенат. Производят ополаскивание гомогенизатора небольшим количеством буфера.Можно и не ополаскивать: практически он количественно вытекает через отвод.
В нижней части стакана гомогенизатора делают поперек сквозное отверстие. К нему пришлифовывают пробку 2. В боковой поверхности пробки 2, выступающей вовнутрь стакана, делают сферическую лунку 5. Ее сферичность соответствует таковой внутренней части стакана и конечной поверхности пестика. Таким образом, пробка своей сферической лункой составляет часть дна стакана гомогенизатора. Под углом в 35-45° к оси стакана в его дне сбоку делают отверстие 4, которое выходит наружу на некотором расстоянии ниже дна стакана. В него ввинчивают отвод 3. Перед началом гомогенизации пробку устанавливают в такое положение, при котором лунка 5 совпадает с дном стакана гомогенизатора. Такая фиксация пробки обозначена меткой на ее наружной стороне. Во внутрь стакана помещают ткань и буферный раствор. После окончания гомогенизации пробку поворачивают в положение, при котором лунка 5 совпадает с отверстием 4. В результате этого внутренняя часть стакана гомогенизатора соединяется с отводом 3. При этом гомогенат самопроизвольно вытекает в подставленный приемник. Этим же путем вытекает ополаскивающий буферный раствор, которого в таких условиях для ополаскивания требуется значительно меньше. Операцию ополаскивания можно исключить: гомогенат практически количественно вытекает через отвод. После этого пробку ставят в предыдущее положение и гомогенизатор вновь готов к эксплуатации. Таким образом, отпадают усилия исследователя на опрокидывание стакана гомогенизатора и его ополаскивание.
Обе модели гомогенизатора нами выполнены из тефлона, но можно их изготовить и из другого подходящего материала, например, из плексигласа или из стекла.
Способ продления срока эксплуатации пестиков в гомогенизаторах тканей и интенсификации процесса гомогенизации
В последнее время гомогенизацию тканей во многих лабораториях проводят в тефлоновых гомогенизаторах. Недостатком их является то, что пестики быстро изнашиваются. Это приводит к нарушению стандартности процесса гомогенизации. Замена изношенных пестиков нерациональна и слишком дорога.
Мы разработали способ и конструкцию пестика, которые позволяют сделать долговечной его эксплуатацию и интенсифицировать процесс гомогенизации. В результате того устраняются вышеуказанные недостатки и достигается большой экономический эффект.
Пестик изготавливают из плексигласа в нескольких экземплярах. С целью интенсификации процесса гомогенизации на поверхности пестика делают продольные желобки (бороздки) соответствующим резцом. Они имеют форму конуса, обращенного основанием вверх, с глубиной 1 мм и шириной 1,5 мм. Расстояние между желобками равняется 3,5-4,0 мм. На концах желобки нисходящие и размещаются по всей круговой поверхности пестика и в его донной части. Они делаются в три поперечных ряда как показано на рис. 75. Длина желобков в каждом ряду приблизительно равняется трети длины пестика. Желобки среднего ряда немного заходят между желобками верхнего и нижнего рядов.
Благодаря наличию таких желобков на поверхности пестика гомогенизирующаяся ткань захватывается и разрывается, а не проскальзывает между стенкой стакана и поверхностью пестика, как в обычных гомогенизаторах.
Для предупреждения нарушения стандартности процесса гомогенизации проработавший некоторое время пестик заменяют другим из изготовленных заранее одинаковых по диаметру экземпляров. Изношенный пестик не выбрасывают, а восстанавливают. С этой целью растворяют определенное количество плексигласа в дихлорэтане или хлороформе. Затем в этот раствор несколько раз окупают изношенный пестик. В результате испарения растворителя на поверхности пестика остается слой растворенного плексигласа. Нанесение слоев плексигласа продолжают до достижения первоначального диаметра пестика. Затем на его поверхности делают желобки по вышеописанной схеме. Такое восстановление пестика возможно многократно.
Многопробный гомогенизатор тканей для биохимических исследований
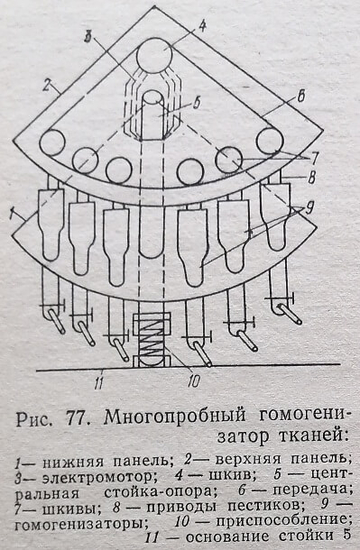
Нами разработан прибор для гомогенизации тканей, который в несколько раз производительнее существующих однопробных гомогенизаторов. Он в какой-то мере может удовлетворять возросшие требования современных исследований (рис. 77).
Изготовляют отдельные детали прибора: стойку 5 с основанием 11, панели 1 и 2, гомогенизаторы 9 и приспособление 10, оси со шкивами 7. Подбирают электромотор 3 со шкивом 4. Соотношение диаметров шкивов 4 и 7 делают таким, чтобы при соединении их передачей шкивы 7 вращались со скоростью 800-1200 об/мин. Мощность электромотора определяется максимальным количеством ткани,подлежащей одновременной гомогенизации во всех шести гомогенизаторах, а также конструктивными размерами последних и пестиков. В панели 1 перпендикулярно поверхности жестко фиксируют гомогенизаторы 9 в панели 1 разработанной нами конструкции (см. рис. 75 и 76). В панели 2 идентично расположению гомогенизаторов 9 в панели 1 перпендикулярно к ее поверхности жестко фиксируют панели 1 и 2 с фиксированными на них гомогенизаторами и пестиками монтируют на стойке 5. При этом панель 2 фиксируется на стойке жестко, а панель 1 — подвижно: она с помощью приспособления 10 (содержащего пружинный механизм) может передвигаться по стойке вверх и вниз.
Для гомогенизации пробки в гомогенизаторах 9 ставят в положение, при котором перекрываются отводы для гомогената. Панель 1 опускают вниз, и в стаканы гомогенизаторов 9 вносят пробы исследуемых тканей и буферный раствор, в котором будет проводиться гомогенизация. Затем панель 1 осторожно поднимают вверх до погружения в гомогенизаторы пестиков. Под влиянием имеющейся в приспособлении 10 пружины панель 1 вместе с гомогенизаторами 9 в конечном рабочем положении оказывает небольшое давление на пестики снизу вверх. Включают электромотор в сеть. Происходит вращение шкива мотора и связанной с ним передачей шкивов 7, а также пестиков, которые соединены с последними. Во время гомогенизации исследователь с помощью приспособления 10 периодически опускает вниз и поднимает вверх панель 1, а вместе с нею и фиксированные в ней гомогенизаторы 9. После окончания операции гомогенизации панель 1 вместе с гомогенизаторами 9 немного опускают до такой степени, чтобы пестики 10-20 с вращались в свободном пространстве стакана гомогенизатора. Это делается с целью максимального освобождения пестиков от остатков гомогената. Мотор выключают. Через отводы в нижней части гомогенизаторов выпускают готовый гомогенат в приемники.
Ополаскивание рабочей части стакана и пестика гомогенизатора производят небольшим количеством буферного раствора. После этого прибор готов для гомогенизации следующих проб исследуемого материала.
Принцип конструкций гомогенизатора позволяет изготовить прибор для одновременной гомогенизации тканей в десяти и даже большем количестве гомогенизаторов.
Гомогенизатор биологических тканей с охлаждением
Недостатком широко распространенных гомогенизаторов биологических тканей является то, что они не имеют устройств для охлаждения стакана и пестика во время работы. Предложенный нами гомогенизатор лишен указанных недостатков (рис. 78).
Рис. 78. Гомогенизатор биологических тканей с охлаждением: а — общий вид стакана гомогенизатора; б— пестик в разрезе; в — цилиндр с фиксирующими вертикальными пластинками; 1 — цилиндр; 2 — фиксирующие пластины; 3 — кожух; 4 — круговой выступ в крышке; 5 — крышка кожуха; 6 — резьба на стакане гомогенизатора; 7 — стакан гомогенизатора; 8 — привод пестика; 9 — пробка; 10 — выступ в пробке 9; 11 — цилиндрическая канавка в пестике 12; 12 — пестик гомогенизатора; 13 — лед
Стакан гомогенизатора 7 изготовляют из тефлона или плексигласа цилиндрической формы с расширением вверху, как показано на рис. 78. Снаружи на расширении стакана делают резьбу 6. Из плексигласа или другого подходящего материала изготовляют крышку 5 кожуха 3. Она имеет вид круга, в центре которого сделано отверстие. Диаметр этого отверстия равен наружному диаметру расширения в стакане гомогенизатора 7. В этом отверстии делают резьбу, которая соответствует резьбе 6 на стакане гомогенизатора. В крышке 5 делают круговой выступ 4 с внутренней резьбой. Наружный диаметр крышки 5 приблизительно на 1,5-2,0 см больше наружного диаметра стакана и гомогенизатора в месте расширения. По внутреннему диаметру кругового выступа 4 крышки 5 изготовляют цилиндрический кожух 3 из плексигласа или другого подходящего, желательно теплоизоляционного, материала. По длине 1 он равен высоте стакана гомогенизатора 7, начиная от расширения и до нижнего конца. По внутреннему диаметру кожуха 3 с небольшим зазором изготовляют цилиндр также из плексигласа или другого материала. Длина его равняется высоте стакана гомогенизатора 7 до расширенной части. К цилиндру изнутри симметрично прикрепляют четыре продольные фиксирующие пластины 2. Ширина их должна быть такой, чтобы в пространственный цилиндр, образующийся ребрами пластин, мог плотно войти стакан гомогенизатора 7 своей рабочей частью, т. е. от конца до расширенной части. Пестик 12 изготовляют из плексигласа или тефлона. Его диаметр и сферическая поверхность соответствуют таковой рабочей части стакана гомогенизатора внутри.
В пестике делают цилиндрическую круговую канавку 11. Ее глубина и ширина должны быть максимальными в объеме пестика, но не нарушать необходимую прочность пестика. В центре пестика с помощью резьбы укрепляют привод 8. Для герметического закрытия канавки 11 сверху делают пробку 9. Она представляет собой круг по диаметру на несколько миллиметров меньше диаметра пестика, на нижней стороне которого имеется круговой выступ 10. По форме и размерам он соответствует таковым цилиндрической канавки 11. На выступе 10 и в цилиндрической канавке 11 вверху делают соответствующего размера резьбу. Резьбу можно и не делать, но тогда выступ 10 подгоняют к канавке 11 так, чтобы при закрытии пробкой канавки создавалась герметичность. Подбирают резиновую прокладку, соответствующую зазору между нижней частью стакана гомогенизатора и дном кожуха 3. На дно кожуха
3 укладывают резиновую прокладку и на нее опускают цилиндр 1. Между ребер фиксирующих пластин 2 опускают стакан гомогенизатора 7. Свободное пространство между стаканом гомогенизатора и фиксирующими пластинами 2 заполняют мелкоизмельченным льдом. Крышку 5 навинчивают на расширенную часть стакана гомогенизатора круговым выступом 4 вниз. Когда крышка достигнет верхнего края кожуха 3 ее навинчивают на Кожух. Навинчивание продолжается до тех пор, пока стакан гомогенизатора не упрется в резиновую прокладку. После этого канавку 11 пестика 12 заполняют мелкоизмельченным льдом 13. Пробкой 9 с помощью выступа 10 герметически закрывают канавку 11 с помощью резьбы или без нее. В стакан гомогенизатора вносят буферный раствор и биологическую ткань, подлежащую гомогенизации. Пестик 12 вводят в стакан гомогенизатора. Пестик 12 посредством привода 8 приводится в движение электромотором. Исследователь, держа в руках кожух 3, перемещает его (а с ним и укрепленный в нем стакан гомогенизатора) вверх и вниз. Происходит гомогенизация ткани. При этом температура буферного раствора и ткани остается практически постоянной, так как выделяющееся тепло от трения поверхностей пестика и стакана гомогенизатора поглощается тающим льдом, находящимся между кожухом 3 и стаканом гомогенизатора и в канавке 11 пестика 12. Тепло от окружающего комнатного воздуха и рук исследователя также не передается на стакан гомогенизатора по причине наличия льда в кожухе.
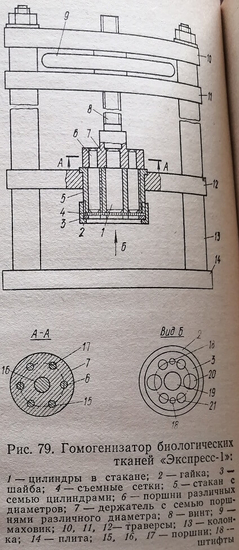
Гомогенизатор биологических тканей «Экспресс-1»
Известный гомогенизатор биологических тканей, в котором используется принцип продавливания тканей через отверстия, имеет ряд недостатков. К ним относятся малая производительность, большая затрата времени на подготовку к последующей эксплуатации. Разработанный нами гомогенизатор лишен указанных недостатков (рис. 79).
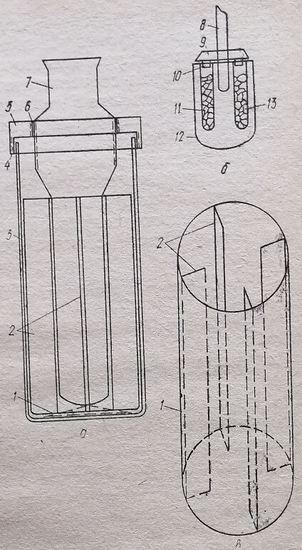
Из нержавеющей стали или другого подходящего материала изготовляют круглый стакан 5 с семью или более сквозными цилиндрами 1 различного диаметра, равномерно расположенными продольно в стакане. При этом цилиндр наибольшего диаметра располагают в центре. У дна каждого цилиндра делают круговой паз для съемных сеток. В дне стакана в промежутках между цилиндрами фиксируют три небольших штифта. Вверху в стакане делают круговой выступ. Соответственно диаметру пазов в дне каждого цилиндра размещают съемные сетки 4, 19, 20, 21, Их изготавливают в виде нескольких комплектов с различными диаметрами отверстий. По диаметру стакана изготавливают шайбу 3 с отверстиями, диаметры которых соответствуют диаметрам цилиндров 1, идентично им расположенных. Кроме того, в шайбе делают отверстия для штифтов 18. Последними шайба фиксируется к стакану. Затем делают накидную гайку 2 с резьбой, соответствующей резьбе на стакане 5 снаружи.
По диаметру стакана изготавливают держатель 7 с семью и более поршнями (в зависимости от количества цилиндров) по диаметрам, соответствующим диаметрам: цилиндров 1 в стакане 5. При этом их расположение в держателе идентично расположению цилиндров в стакане.
Изготовляют маховик 9 с резьбой, соответствующей резьбе на винте 8, и колонку 13 с плитой и траверсами 10, 11, 12. В траверсах 10 и 11 посередине делают отверстие для винта 8, а в траверсе 12 — отверстие по диаметру, равному диаметру стакана 5. Собирают гомогенизатор следующим образом. В пазы цилиндров 1 в дне вставляют сетки 4, 19, 20, 21 и накладывают шайбу 3 так, чтобы отверстия для штифтов и цилиндров совпали. Шайбу фиксируют с помощью накидной гайки 2. Стакан перед этим помещают в отверстие в траверсе 12. В винт 8 с маховиком 9 фиксируют в траверсах 10 и 11. К нему прикрепляют держатель 7. В таком виде гомогенизатор готов к эксплуатации.
Эксплуатация гомогенизатора
Держатель с поршнями с помощью маховика и винта ставят в верхнее положение, при котором имеется доступ к цилиндрам в стакане. Подлежащие гомогенизации ткани, например печени, почек, селезенки, сердца, мышц и др., помещают каждую в отдельный цилиндр стакана. После этого держатель с поршнями Движением винта и маховика опускают донизу. Поршни держателя входят в цилиндры стакана. Под давлением поршней происходит продавливание тканей через сетки в дне каждого цилиндра. Полученный гомогенат собирают в пробоотборники, подставленные под дно стакана. Затем отвинчивают гайку 2. Снимают шайбу 3 и сетки 4. Поднимают держатель с поршнями вверх. Поршни, цилиндры, Сетки и шайбу моют водой и сушат. Затем составные части стакана собирают как описано выше. После этого гомогенизатор вновь готов к эксплуатации. Для ускорения сборки можно закладывать чистые сетки из другого заранее заготовленного комплекта.
Прибор для фильтрования при выделении субклеточных структур
Окончательному выделению и фракционированию субклеточных структур предшествует операция освобождения гомогената ткани от разрушенных клеточных оболочек и других грубодисперсных частей ткани (например, соединительнотканных волокон) . Эту операцию чаще всего выполняют путем фильтрования гомогената через, капроновую, шелковую ткани или марлю (специально обработанную) с помощью лабораторных воронок при атмосферном давлении. Метод является несовершенным, так как фильтры при этом забиваются грубодисперсными частицами и процесс фильтрования идет очень медленно или вообще прекращается. Параллельно с этим происходит потеря (неучитываемая) исследуемого материала. Фильтрование немного улучшается, если гомогенат дважды пропустить через фильтры различной плотности. Но при этом значительно увеличивается трата времени. Кроме того, фильтрование этим способом необходимо проводить в холодовых комнатах, что неэкономично.
А выполнение этой операции при комнатной температуре отрицательно отражается на активности ферментов и других исследуемых биологических веществ вследствие развития аутолитических процессов.
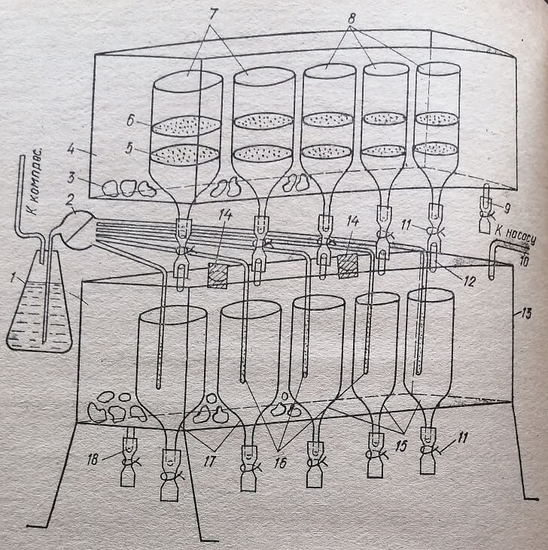
Нами сконструирован прибор для фильтрования при выделении субклеточных структур, с помощью которого устраняются указанные недостатки (рис. 80).
Рис. 80. Прибор для фильтрования при выделении субклеточных структур: 1 — резервуар для дистиллированной воды и сифоном; 2 — многоходовой кран; 3 - кусочки льда; 4 - верхняя открытая камера для установки в ней фильтрующих: сосудов; 5, 6 - подставки под фильтры; 7 — фильтрующие сосуды больших размеров; 8 — фильтрующие сосуды меньших размеров; 9, 18 — спускные штуцера для слива воды, образующейся при таянии льда; 10 — штуцер для соединения камеры 13 с вакуум-насосом; 11 — зажимы; 12 — штуцера камеры; 13, 14 — отверстия с пробками в камере 13 для заполнения ее льдом; 15 — малые сосуды для сбора профильтрованного гомогената; 16 — устройства для мытья сосудов 15 и 17; 17 — большие сосуды для сбора профильтрованного гомогената
Из листового плексигласа склеивают камеру 4, в дне которой делают отверстия для фиксации в них фильтрующих сосудов 7 и 8. Отдельно склеивают камеру 13 без крышки с отверстиями в дне камеры для фиксации сосудов 15 и 17, в которые собирается профильтрованный гомогенат. Фильтрующие сосуды и сосуды для сбора гомогенатафиксируют соответственно в верхней и нижней камерах. Фиксация указанных сосудов, как и штуцеров, осуществляется с помощью резиновой прокладки между сосудом или штуцером и стенкой камеры. В отверстиях крышки камеры 13 фиксируют штуцера 12 и моющие устройства 16. Фиксация их, как и фиксация сосудов, должна быть герметической. Моющие устройства 16 представляют собой трубки малого диаметра (2 мм) из стекла, полиэтилена или полихлорвинила. Внизу они запаяны, а сбоку в той части, которая находится в сосуде, имеют капиллярные отверстия по всей поверхности. Моющие устройства устанавливают посередине сосудов для сбора профильтрованных гомогенатов. Штуцера 12 устанавливают рядом с моющими устройствами на расстоянии 3-5 мм также напротив сосудов для сбора гомогената. После этого крышку герметически приклеивают в камере 13. Крышку можно и не приклеивать. В таком случае между крышкой и камерой укладывают резиновую прокладку и крышку прижимают с помощью зажимов или винтов к торцам камеры. Камера 4 фиксируется над камерой 13 с помощью ножек из плексигласа в соответствующих пазах в камере. С помощью резиновых трубок штуцера 12 соединяют с отростками фильтрующих сосудов 7 и 8. Моющие устройства соединяют резиновыми трубками с многоходовым краном 2, а последний — с резервуаром.
Эксплуатация прибора
Зажимами 11 перекрывают отростки сосудов 17 и 15. С этой целью на отростки надевают кусочки резиновых трубок. На подставку 5 помещают кружочки в несколько слоев одной из тканей (капроновой, шелковой) или марли. На них ставят подставку 6. На нее помещают 1-2 кружка из тех же тканей. Диаметр кружков тканей должен быть немного больше диаметра соответствующих подставок 5 или 6 — настолько, чтобы они загибались. Это делается для предупреждения протекания гомогената между краем фильтра и стенкой сосуда. С этой целью на круг подставки 6 можно одевать резиновую прокладку. После этого штуцер 10 соединяют с вакуум-насосом. Через отверстия 14 заполняют пространство между сосудами 17 и 15 в камере 13 мелкоизмельченным льдом. Пробками герметически закрывают эти отверстия. Льдом заполняют также пространство между фильтрующими сосудами 7 и 8 камеры 4. Гомогенаты, подлежащие фильтрованию, выливают на фильтры на подставках 6 сосудов 7 и 6. При этом в сосудах 7 фильтруют гомогенаты в больших количествах (например, из печени, мышц, опухоли и др.), а в сосудах 8 - гомогенаты в меньших количествах (например, из почек, мозга, селезенки и др.) с помощью вакуум-насоса создают в камере 13 вакуум. Происходит быстрое фильтрование гомогенатов. При этом фильтры на подставках 6 задерживают более грубодисперсные частицы, а фильтры на подставках 5 — все остальные, за исключением взвешенных ядер, митохондрий и других субклеточных структур. Когда в каком-нибудь из фильтрующих сосуд0в фильтрование закончилось, зажимом 11 отсоединяют его от камеры 13. И, таким образом, поочередно отсоединяют другие сосуды, в которых закончилось фильтрование. После окончания фильтрования во всех сосудах отключают вакуум-насос, камеру 13 разгерметизируют, вынув одну из пробок из отверстия 14. Через нижние отростки сосудов 17 и 15 собирают профильтрованные гомогенаты.
Для подготовки прибора к фильтрованию последующих проб гомогената фильтры из тканей снимают с подставок 5 и 6. Сосуды 7 и 8 моют обычным способом дистиллированной водой. Мытье сосудов 77 и 15 осуществляют с помощью устройств 16. Для этого компрессором создают небольшое давление в резервуаре 1 с дистиллированной водой. Многоходовым краном 2 поочередно соединяют резервуар 1 с каждым моющим устройством 16. Вода под давлением вытекает из капилляров устройств в виде душа и моет сосуды 17 и 15. После этого на подставки 5 и 5 помещают другие фильтры из вышеуказанных тканей. И весь процесс начинают сначала как описано выше.
Прибор может применяться также для выполнения многочисленных операций фильтрования различных растворов в любых химических и биохимических лабораториях. С этой целью на подставки 5 и 6 помещают соответствующие фильтры.
Способ и приспособление для уравновешивания пробирок при центрифугировании
При фракционировании субклеточных структур, методом центрифугирования применяют раствор сахарозы в соотношении с тканью 7:1 или 10:1. Если одновременному центрифугированию подлежат различные количества гомогенатов (например, из печени, селезенки, почек, сердца, легких), то уравновесить такие количества гомогенатов не представляется возможным: для уравновешивания нельзя использовать раствор сахарозы и дистиллированную воду. В таком случае нарушатся указанные соотношения. Можно на противовес ставить пробирки с водой, но тогда в два раза увеличивается время на выполнение центрифугирования. Такие же трудности наблюдаются и при уравновешивании пробирок с другими разнородными жидкостями в различных количествах, которые необходимо центрифугировать.
В связи с вышеизложенным нами разработан способ и приспособление (рис. 81) для уравновешивания пробирок с различными количествами гомогенатов или других разнородных жидкостей.
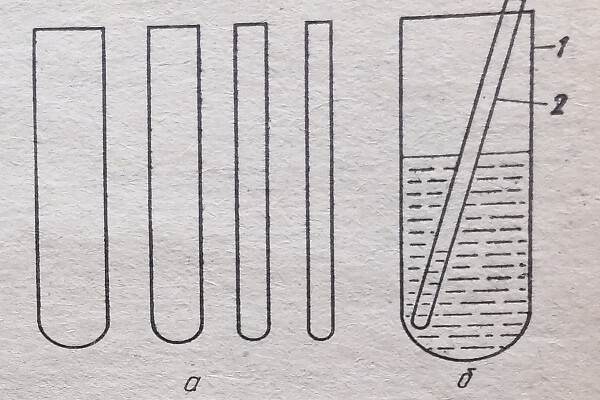
Рис. 81. Приспособление для уравновешивания пробирок при центрифугировании: а - набор пробирок; б — центрифужная пробирка с вставленной в нее дополнительной пробиркой; 1— центрифужная пробирка; 2 — дополнительная пробирка из набора
Сущность способа заключается в следующем. Заранее заготавливают набор дополнительных пробирок путем комплектации готовых полиэтиленовых пробирок или изготовляют их из трубок, запаивая один из концов. Они должны быть различной емкости и массы и по длине немного превышать длину центрифужных пробирок. Затем в центрифужные пробирки вносят гомогенаты из разных тканей или другие разнородные жидкости в различных количествах. Пробирки вставляют в кольца специальных весов. Для уравновешивания дополнительную пробирку (из набора) вставляют в центрифужную пробирку с меньшим количеством жидкости. При этом масса дополнительной пробирки должна быть немного меньше массы недостающего количества жидкости в центрифужной пробирке. Подбор такой пробирки производят эмпирически. В дополнительную пробирку каплями добавляют воду до уравновешивания с центрифужной пробиркой на другой чаше весов. После центрифугирования пробирку с водой вынимают и осадок с центрифугатом обрабатывают согласно методике. Заготовленные пробирки (из набора) перед использованием моют снаружи соответствующим образом.