Колориметрический метод с хлористым трифенил-тетразолем
Определение активности того или иного биологического продукта можно установить с более высокой точностью, чем при использовании метода Тунберга, при меняя производные хлористого трифенилтетразола. Это вещество является акцептором водорода, превращающимся в результате восстановления в трифенилформазан производное окрашенное в красный цвет, нерастворяющееся в воде, но растворяющееся в органических растворителях, благодаря чему можно провести их количественное определение колориметрическим способом.
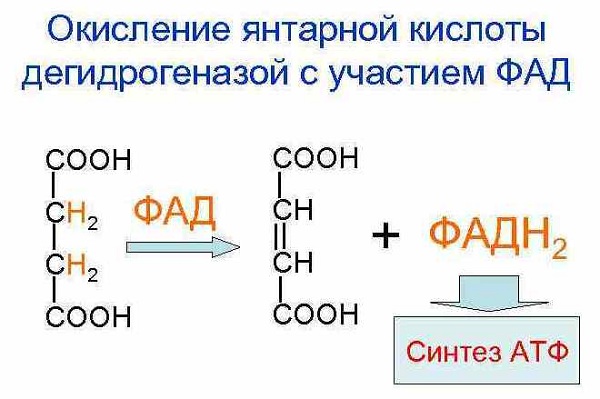
В самом начале этот метод применяли для гистохимических исследований, целью которых являлось определение активности янтарной дегидрогеназы. Для этого срезы свежих тканей, получаемых после замораживания, кладут на предметные стекла и затем покрывают смесью состоящей из равных частей:
- хлористого 2-(п-индофенил) –3–(п-нитрофенил) – 5-фенил-тетразола в водном растворе с концентрацией 1 мг на мл;
- сукцината натрия 0,1 м;
- фосфатного буферного раствора 0,1 м с pH 7,4.
Оставляют на 5 минут при 37°С, затем препарат фотографируют для уточнения места расположения точек реакции. Затем, после высушиваний срезов образовавшуюся тетразоловую соль экстрагируют путем введения в определенный обчем (3,5 мл) этилацетата (диоксаиа или ацетона), посде чего экстрагированную жидкость спектрофотометрируют для установления образовавшегося количества формазана. Затем срезы окрашивают обычным способом и сравнивают под микроскопом со снимком, сделанным после инкубации.
Месробяну и сотрудники применяют метод с трифенилтетразолем для определения дегидрогеназовой активности лейкоцитов. Метод описанный этими авторами можно однако применить для любой клеточной взвеси независимо от типа (специфичности) исследуемой дегидрогеназы. Применяемая авторами реакционная система состоит из:
- 1 мл энзиматического препарата (клеточная взвесь известной концентрации, оцениваемая при сухом весе, общий N или нуклеиновый N); препарат получают взвешиванием в фосфатном буферном растворе 0,1 м с pH 7,4.
- 1 мл раствора 0,2 м (в фосфатном буферном растворе 0,2 м, с pH 7,4), выделяющего водород субстрата, который подвергается исследованию;
- 1 мл водного раствора хлористого 2, 3, 5-трифенилтетразола 0,1%.
Систему встряхивают для смешения, затем инкубируют при 37°С в течение 20 минут.
Параллельно приготовляют образец в аналогичных условиях лишь с тем различием, что энзиматический препарат предварительно инактивируют нагреванием.
По истечении 20 минут выдерживания при 37°, все пробикри быстро охлаждаются в воде со льдом и затем к ним приливают по 5 мл ацетона (диоксана или этилацетата) и встряхивают до полного растворения получаемого формазана. Затем фильтруют через небольшую воронку, а прозрачный фильтрат фотоколориметрируют при 4 920 А.
Из полученного для образца значения вычитают значение полученное при фотоколориметрировании контрольного образца.
Обычно, получаемые результаты выражают в «гамма восстановленной тетразоловой соли», причем восстановление подсчитывают на 1 г исследуемого биологического продукта. Для этого параллельно строят кривую затухания, поступая следующим образом: в ряд пробирок берут точно отмеренные количества хлористого дифенилтетразола (0,5; 1; 2; 10; 12; 15; 20; 25 гамма); затем в каждую пробирку до конечного объема 3 мл добавляют аскорбиновую кислоту 5% в боратном буферном растворе с pH 9,1. Встряхивают и оставляют на 20 минут при комнатной температуре. Образовавшаяся окраска (формазан) увлекается с помощью ацетона (по 5 мл в каждую пробирку), фильтруют, а прозрачный фильтрат фотоколориметрируют при 4 920 А. С помощью полученных результатов строят кривую затухания, которую затем используют для выражения дегидрогеназной активности препарата в «гамма восстановленной соли тетразола».
Для повышения чувствительности метода Пэунеску применяет цианистый натрий (или калий) для блокирования окислений посредством цитохромной системы или – с еще лучшими результатами – проведение реакции в отсутствии молекулярного кислорода. Для этого в пробирки Тунберга вводят:
- 1 мл энзиматического препарата;
- 3 мл фосфатного буферного раствора 0,4 м с pH 7,4;
- 1 мл водного раствора 0,2 м, выделяющего водород субстрата, подвергаемого исследованию (в случае наличия контрольной системы вместо субстрата применяют 1 мл дистиллированной воды).
Пробирки выдерживают в течение 10 минут в водяной бане при 37°С, затем в каждую пробирку добавляют по 0,5 мл водного раствора хлористого (или бромистого) трифенилтетразола 0,1% и тотчас же в пробирках Тунберга осуществляют вакуум. После 15-минутной инкубации пробирки извлекаются из бани, быстро охлаждают и добавляют по 8 мл ацетона. Энергично встряхивают, фильтруют, а образцы фотометрируют (4 920 А), сравнивая с фильтратом контрольного образца.
Полученные значения экстраполируют на кривой, построенной с помощью серии разбавлений формазана, приготовленной в вышеописанных условиях.




