Методы идентификации и определения ряда веществ в биологических препаратах
Идентификация и определение различных веществ непосредственно в биологических препаратах является одной из наиболее часто встречающихся в биохимической практике операций. В связи с этим представляется целесообразным приведение описания обычно применяемых для этой цели методов.
Методы приведенные в настоящей главе дополняют способы применяемые в повседневной практике в аналитических лабораториях, указанные во второй части работы. Кроме того, нижеописанные методы ограничиваются лишь прямыми химическими способами, причем здесь не приводится описание хроматографических, электрофоретических и других методов, изложение которых было дано в специальной главе.
Идентификация устойчивых органических кислот
Иногда весьма важно провести идентификацию ряда органических кислот, – промежуточных метаболитов клетки, – в ряде биологических препаратов (серозный, гнойный или амикробный экссудат, тканевые культуры, культуры микроорганизмов и др.). Поскольку значительная часть этих кислот является неустойчивой (щавелевоуксусная, щавелевоянтарная и др.), их можно идентифицировать лишь применяя ряд специальных методов. Устойчивые органические кислоты, как например, янтарная кислота, молочная кислота и пировиноградная кислота могут быть выявлены в биологических препаратах.
Для этой цели около 20 мл препарата подкисляют добавлением 2– 3 мл H2S04 10% и переводят в разделительную воронку. В пипетку с шариком затем всасывают 25 мл серного эфира и вводят в воронку, в нижнюю часть препарата. Избегают встряхивания, причем экстрагирование должно происходить посредством простого контакта до следующего дня, когда эфирную фазу отделяют в стеклянную чашку. Эфир удаляют отгонкой в вакууме (25–30°С), осадок берут с дистиллированной водой и на соответствующих фракциях этого раствора идентифицируют пировиноградиую, молочную и янтарную кислоту.
Пировиноградную кислоту идентифицируют методом Симона. К 1 мл образца добавляют 0,5 мл уксусной кислоты 45% и 3 мл свежего раствора нитропруссиата натрия 1%. Затем приливают 1,5 мл гидрата аммония (22°С), разбавленного водой. В случае если присутствует пировиноградная кислота, появляется синяя окраска. Для определения пировиноградной кислоты можно применять метод Лу, описанный Бернштейном.
Молочную кислоту идентифицируют накапывая 2 капли исследуемого раствора в 1 мл концентрированной серной кислоты, нагревая смесь в течение 5 минут в водяной бане при 100°С. После охлаждения по стенке пробирки дают стечь 0,3 мл спиртового раствора гваякола 10%, В случае присутствия молочной кислоты на границе раздела между обоими растворами образуется кольцо ярко красного цвета.
Янтарная кислота. Исследуемый раствор подщелачивают гидратом аммония и выпаривают в бане с кипящей водой. Осадок берут с дистиллированной водой и в образовавшийся раствор накапывают 0,2–0,3 мл разбавленного раствора хлорного железа. Если в образце присутствует янтарная кислота, в этих условиях образуется янтарно-феро-аммиачное соединение в виде желатинообразного осадка розовато-желтого цвета, идентифицирование которого не представляет трудности.
Идентификация фенолов и крезолов
Достаточное количество исследуемого препарата (50–400мл) удваивают дистиллированной водой и подкисляют (2–5 мл H2S04), затем подвергают дистилляции до испарения 3/4 объема. Дистиллят подщелачивают до pH 9 (применяя КОН) и снова дистиллируют (5/6 объема). В этом втором дистилляте содержится все количество индола и скатола (которые можно идентифицировать с помощью реактива Эрлиха и п-диметиламинобензальдегида в сильно кислой среде).
Фенолы отделяют из осадка оставшегося от второго дистиллята насыщением этого последнего струей углекислоты и перегонкой до полной вытяжки жидкости. Добавление разбавленного раствора перхлористого железа к дистилляту вызывает появление сине-фиолетовой окраски в случае присутствия фенола.
Крезолы могут быть идентифицированы в дистилляте для фенолов посредством реакции с формалином. К 1 мл дистиллята добавляют 1 мл ледяной уксусной кислоты, 4 капли формалина и 1 мл концентрированной серной кислоты. В этих условиях ортокрезол дает ясную розовую окраску, метакрезол – опалесцентную фиолетовую окраску, а паракрезол – зеленую окраску.
Идентификация ацетоина (ацетилметилкарбинола)
Для этой цели можно применить метод Лемуана, измененный Клюивером, состоящий в добавлении 5 мл перхлористого железа (45°В) к 50 мл препарата, медленной разгонке и рекуперации дистиллята в солянокислом растворе гидроксиламина 20%. Эти операции обеспечивают перемещение, перегонку и фиксацию диацетила. Затем, к гидроксилалдановому раствору добавляют буферный раствор ацетата натрия. Накапывают 5 капель раствора хлористого никеля 10%. Появляется зеленоватая окраска, переходящая при кипячении смеси в синефиолетовый, а затем ярко красный цвет, и в конечном итоге образуется характерный красный осадок. Реакция является положительной даже при 1/10 000 разбавлении ацетоина.
Идентификация спиртов
Анализируемый препарат, предварительно нейтрализованный, подвергают весьма медленной дистилляции (200 мл должны дать отгон около 30 мл в течение 1 часа). На небольшом количестве (1 мл) дистиллята исследуют присутствие спиртовых функций с помощью бихроматного азотного реактива (3 м раствор бихромата калия в азотной кислоте). Для этой цели приготовляют смесь состоящую из равных частей дистиллята и реактива, при этом смесь нагревают до 100°С в водяной бане. Если в течение 2 минут появляется фиолетовая окраска, переходящая в синюю, то присутствие спиртов в растворе является доказанным и, следовательно, можно приступить к их идентификации.
Этиловый спирт: к 2 мл дистиллята добавляют 4 капли NaOH 10% и достаточное количество раствора Люголя для того, чтобы вызвать появление желто-коричневой окраски. Затем добавляют еще 1 каплю едкого натрия, в результате чего окраска исчезает. Смесь охлаждают. Эти операции ведут к образованию йодоформа в случае присутствия этанола в дистилляте. Йодоформ не трудно опознать, благодаря его специфическому запаху. Для большей уверенности раствор оставляют в покое на несколько часов, затем центрифугируют, а в центрифугате наблюдают под микроскопом появление желтых шестиугольных кристаллов йодоформа.
Если реакция отрицательная на этанол, 200 мл дистиллята подвергается окислению при нагреве в присутствии равного количества смеси Джонсона (раствор бихромата калия 3 м. в серной кислоте 10 н. После окисления в смесь барботируют горячие водяные пары, причем эти последние после конденсации в холодильнике улавливаются в соответствующий сосуд. В сосуд вместе с парами увлекаются также продукты окисления: кислоты соответствующие первичным спиртам и кетоны соответствующие вторичным спиртам. В этих условиях метанол дает муравьиную кислоту, пропанол – н-пропионовую кислоту, бутанол – н-масляную кислоту, и т. д. Изопропанол дает ацетон.
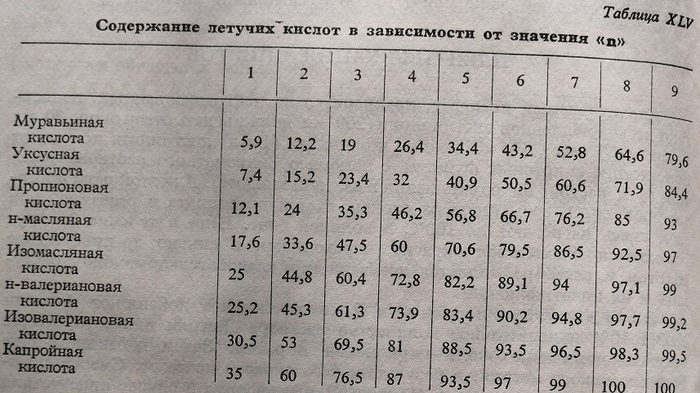
Идентификацию летучих кислот, образовавшихся в результате окисления первичных спиртов, можно производить посредством метода Дюкло. Для этого берут 110 мл окисленного продукта, увлеченного с водяными парами и вводят в перегоночный аппарат. Дистиллят рекуперируют в виде фракций по 10 мл, собираемых раздельно. К первым 10 фракциям добавляют по 2–3 капли индикатора (фенолфталеин) и в каждой из них определяют количество концентрированного раствора гидрата кальция, необходимое для нейтрализации (слабый вираж фенолфталеина).
Отмечают эти цифры (я), а также общее количество (N) известковой воды израсходованной для нейтрализации всех 10 образцов.
Затем каждую цифру п умножают на N/100, а полученные результаты берут из таблицы XLV, в которой приводятся эти значения, определенные опытным путем для каждой кислоты в отдельности.
Аналогичные с вышеприведенной таблицы, составленные также на основании экспериментальных определений, были разработаны для смесей состоящих из двух летучих кислот в различных соотношениях. Разумеется, подобные таблицы более сложны. Пока таблицы для смесей состоящих из трех или четырех подобных кислот, еще не составлены.
Микроопределение липидов в жидких средах
Для этой цели рекомендуется применение гравиметрических методов, так как« окислительные» методы (Блур) не дают точных результатов.
Точно отвешенное количество (2–3 мл исследуемого продукта) вводят в центрифужную пробирку вместе с 15 мл этанола 96%. Трубку выдерживают в течение 10 минут в кипящей водяной бане, непрерывно помешивая. Центрифугируют спиртной раствор, переводят в колбу на 100 мл, Экстрагирование осадка из пробирки повторяют в одинаковых условиях, используя для этого еще 15 мл спирта, а затем еще 15 мл эфира. Экстрагированные жидкости соединяют в общей колбе и выпаривают в вакууме. Осадок берут с 1 мл хлороформа и фильтруют через фильтровальную бумагу весьма малого размера. Колбу с осадком 4 раза споласкивают 0,5 мл хлороформа, причем промывочные жидкости пропускают через исходный фильтр.
Затем производят последнее промывание фильтра, используя для этого 0,5 мл хлороформа. Все фильтраты собирают в предварительно взвешенную стеклянную чашку. Чашку ставят в термостат при 55°С для испарения хлороформа. Эту операцию можно ускорить увлекая пары струей азота или углекислоты. В конечном итоге осадок в чашке обезвоживают в вакууме в присутствии пятиокиси фосфора до постоянного веса и затем взвешивают снова. Разница между вторым взвешиванием и тарой является общим количеством липидов, присутствующих в исходном препарате.
Колориметрическое определение сахаров
По сравнению с титриметрическими методами, колориметрическое определение глюцидов имеет преимущество быстроты и специфичности. Определение гексозаминов этим методом не представляется возможным.
Способ с орцинолом (Серенсен-Хаугаард) применяет в качестве реактива раствор орцинола 2% в H2S04 30%. Если используемый орцинол безводный, то концентрацию раствора снижают до 1,6%. Если орцинол окрашен, то его очищают посредством максимального растворения в горячем хлороформе, фильтрации, выпаривания при нагревании, повторного смешения с хлорформом и красталлизации (образующиеся в хлороформе кристаллы должны быть белыми и иметь точку плавления от 103 до 104°С).
Для определения, 1 мл анализируемого раствора, содержащего не менее 0,025 мг сахаров, смешивают с 2 мл раствора орцинола и 15 мл раствора концентрированной серной кислоты 60% (объемных) для анализа. Одновременно приготовляют контрольный образец без препарата. Пробирки нагревают до 80°С в течение 20 минут, затем охлаждают водой. Яркость получаемой окраски оценивают фотоколориметрически, применяя зеленый фильтр (X = 5200А) или синий фильтр (X = 4700 А).
Способ с карбазолем применяют только в случае, если в исследуемом препарате не присутствует триптофан. В качестве реактивов применяв раствор карбазоля 0,5% в абсолютном спирте. Для определения, 1 мл исследуемого раствора вливают в пробирку в 9 мл концентрированной сер ной кислоты, причем пробирку держат на льду. Затем добавляют 0,3 мл реактива и энергично встряхивают содержимое пробирки. В течение 10 минут держат в кипящей водяной бане, затем охлаждают в воде со льдом. Окраску оценивают фотоколориметрически, применяя зеленый фильтр (X = 5400 А).
Идентификация летучих аминов
Исследуемый препарат доводят до значения pH 8,2, применяя NaOH 0,25 н, затем переводят в дистилляционную колбу (содержащую тальк для гомогенизации и кипячения), нейтрализуют и подвергают весьма медлен» ной дистилляции (30 мл дистиллята – 1 час). В дистилляте присутствие летучих аминов определяется с помощью реактива Несслера, вызывающего появление желтой окраски, с последующим образованием осадка того же цвета. Кроме того, если к дистилляту добавляют равный объем реактива Майера (1 г фенолфталеина, 20 г КОН, 100 мл воды и 10 г Zn в порошке; смесь кипятят до обесцвечения) и нагревают до кипения, затем быстро охлаждают образуется беловатая опалесценция, тотчас же порождающая образование кристаллического осадка.
Идентификация и определение аминокислот
Наиболее простым методом идентификации аминокислот, допускающим распознавание количеств 0,001–0,0001 мг, является способ применяющий реактив с нингидрином (0,2% в безводном ацетоне или бутаноле). Одну каплю исследуемого раствора наводят на фильтровальную бумагу и дают ей испариться. Затем опрыскивают реактивом с нингидрином и помещают в термостат при 80–100°С. После того как фильтровальная бумага высохла, на месте где находилась капля раствора с аминокислотами, появляется синевато-фиолетовое пятно. В случае использования нингидрина 0,1% в безводном хлороформе, реакция протекает немедленно, на холоде.
Цистин и цистеин – аминокислоты содержащие группы SH, можно идентифицировать с помощью солей тетразола или нитро- пруссиата.
Для идентификации посредством 2,3,5-трифени лтетразолхлорида фильтровальную бумагу, на которой была нанесена капля исследуемого раствора, пропитывают раствором трифенплтетразола 0,5% в хлороформе, а затем погружают в раствор NaOH 10% в спирте. Таким образом, на фильтровальной бумаге появляется красное пятно, если образец содержал не менее 0,0003 мг цистина или цистеина.
Реактив с нитропруссиатом, используемый для идентификации групп –SH, приготовляют следующим образом: к 10 мл серной кислоты 2 н. добавляют 3 г нитропруссиата, затем 200 мл метанола и 20 мл концентрированного раствора аммиака. Образующийся тонкий осадок удаляют фильтрованием. Если фильтровальную бумагу, на которой находится анализируемый образец, погружают в этот раствор, то в случае присутствия цистеина, появляется тотчас же красное пятно (чувствительность до 0,0006 мг цистеина).
Для выявления цистеина, после пропитки бумаги в растворе нитропруссиата, ее следует ввести в раствор цианистого натрия 40% в метаноле, разрывающий группу – S – S – цистина. По истечении 10 минут появляется желтая окраска, переходящая через несколько часов в зеленый цвет.
Для исследования присутствия сероводородных группировок Мартинсон применяет метод Мирского с цианистым железом, вызывающий окисление этих групп, с появлением специфического цвета, который можно фотоколориметрировать.
Определение цистеина можно производить колориметриметчески с помощью ферицианида, восстанавливаемого группами – SH в прусский синий. Определение можно производить непосредственно на белках без предварительного гидролиза. Количество а (в мл) определяемого раствора (0,1–0,2 мг цистеина) разбавляют водой до 2,25 мл. Добавляют: 0, 05 мл буферного фосфата м/1 с pH 6,7; 0,05 мл раствора фериацианида калия 0,1 м. (свежеприготовленного) и 0,5 мл раствора додецилсульфата натрия 10%. Оставляют на 10 минут при 37°С, затем добавляют 0,4 мл H2S04H. Объем дополняется до 20 (предпочтительно оперировать в мерной колбе).
Конечный раствор фотоколориметрируют с использованием желтого фильтра (7000–7500 А). Отсчитанное значение превращают в мг цистеина путем экстраполирования на калибровочной кривой, предварительно построенной с помощью одинаково приготовленных контрольных образцов, для чего используются количества цистеина от 0,1 до 0,4 мг.
Определение цистина можно производить также колориметрически, определяя яркость синего цвета, получаемого с помощью реактива Фолен-Марензи, в присутствии сульфита натрия.
Реактив Фолен - Марензи приготовляется следующим образом: 100 г вольфрамата натрия растворяют в 200 мл воды и, охлаждая колбу, добавляют 20 мл фосфорной кислоты 85%. Затем, в течение 20 минут через раствор пропускают струю сероводорода и одновременно добавляют еще 10 мл фосфорной кислоты 85%. Кислотность проверяют с помощью Конго красного и, в случае необходимости, фосфорную кислоту добавляют до изменения окраски индикатора. Фильтруют и затем фильтрат переводят в разделительную воронку на 1 литр, где взбалтывают с 30 мл спирта. После разделения обоих слоев отбирают нижний слой и фильтруют в мерную колбу, добавляя воду до тех пор пока вес жидкости не достигнет 300 г. Кипятят несколько минут – операция обеспечивающая удаление сероводорода. Добавляют 20 мл фосфорной кислоты 85% и нагревают с орошением при 100°С в течение одного часа. Фильтруют, к фильтрату добавляют несколько капель брома и кипятят до полного обесцвечивания раствора. После охлаждения медленно добавляют горячий раствор 25 г карбоната лития, растворенного в 50 мл фосфорной кислоты 85% и 250 мл воды. Конечный объем реактива (фосфорно-18-вольфрамовая кислота) доводят до одного литра.
Для определения в мерной колбе на 10 мл количество анализируемого раствора разбавляют до 1 мл серной кислотой 0,1 н. и затем добавляют: 2 мл ацетата натрия 4 м. и 0,3 мл уксусной кислоты 4 м. (значение pH раствора должно быть = 5). Затем добавляют 0,6 мл сульфита натрия 10% (pH 5) и 0,8 мл реактива Фолен-Марензи. Оставляют 15 минут в покое, объем жидкости доводят до метки и тотчас же после этого отсчитывают фотоколориметрически интенсивность окраски (желтый фильтр на 7200А).
Одновременно приготовляют новый образец одинаковым образом, лишь с тем отличием, что до реактива Фолен-Марензи добавляют 0,3 мл хлорной ртути ;0,1 м. (2,75 г HgCl2 в 100 мл дистиллированной воды). Появляющаяся в этом образце окраска соответствует остальным восстановительным веществам – за исключением цистина – присутствующим в образце. Следовательно, фотоколориметрическое значение этого определения необходимо вычесть из первого.
Калибровочную кривую строят используя количество цистина от 0,015 до 0,150 мг.
Определение метионина. Метионин в нейтральной среде, обработанный избытком йода, фиксирует йод. Добавление гипосульфита к подкисленному раствору, разлагает образовавшееся соединение и допускает фильтрование освобожденного йода.
Для определения к 5 мл анализируемого раствора добавляют 5 мл буферного фосфатного раствора м/1 (рн7), 5 мл йодистого калия, 7 мл воды и йодного раствора 0,1 н. в достаточном количестве для получения коричневой окраски. По истечении 20 минут избыток йода нейтрализуют добавлением тиосульфата натрия 0,025 н. (до исчезновения коричневой окраски). Затем добавляют 5 мл НС1 2 н., после чего освобожденный йод определяют с помощью тиусульфата 0,01 н. Примем «а» – число мл тиосульфата, израсходованного для определения.
Имея в виду, что в препарате могут присутствовать также и другие вещества, дающие аналогичную реакцию, параллельно приготовляют второй образец, в котором метионин предварительно превращают в сульфокислоту, которая уже не фиксирует йод. Для этой цели 5 мл анализируемого препарата (предварительно нейтрализованного) берут в колбу на 50 мл, добавляют 1 мл НС1 6 н. и достаточное количество йодного раствора 0,1 н для получения бледно-желтой окраски. По истечении 10–20 минут добавляют 1 мл раствора йодистого калия 5 мл и смесь состоящую из 2 мл NaOH 3 м., 4 мл йодистого калия 5 м., 5 мл фосфатного буферного раствора м/1 с pH 7 и 5 мл воды. Оставляют в покое в течение 10–20 минут, затем избыток йода нейтрализуют тиосульфатом 0,025 н., подкисляя 5 мл НС1 2 н., после чего освобожденный йод определяют с помощью тиосульфата 0,01 н. Примем «б» – количество израсходованных мл тиосульфата.
Количество метионина в мг, присутствующего в анализируемом препарате получается с помощью следующей формулы:
(а – б) X0,7448 = мг метионина.
Идентификация пролинаигидроксипролина можно производить с помощью изатина (0,1 г изатина в 50 мл н-бутанола с 5% ледяной уксусной кислотой). Фильтровальную бумагу, на которую навели одну каплю определяемого раствора, пропитывают реактивом и оставляют высохнуть в автоклаве при 100°С. Пролин появляется в виде яркого синего пятна; гидроксипролин – как бледное синее пятно. Другие аминокислоты дают с изатином розовую или фиолетовую окраску. Чувствительность реакции: 0,0002 мг пролина и 0,0008 мг гидроксипролина.
Для приготовления раствора гипохлорита, в 76 мл холодной воды (0°С) растворяют 8 г NaOH. Сосуд с раствором взвешивают, затем барбо- тируют хлор до увеличения веса на 7,1 г. Объем дополняют до 100 мл водой, а затем раствор сохраняют в холодильнике (-f-4°C) в хорошо закупоренной бутылке из цветного стекла.
Определение: в колбу на 50 мл, приспособленную к холодильнику, вводят анализируемый препарат (который должен содержать 0,002–0,006 мг гидроксипролина) и дополняют объем до 4,5 мл водой. Содержание колбы охлаждают погружая ее в ледяную баню. Добавляют 0,5 мл раствора карбоната натрия 10% и 0,5 мл гипохлорита. Смешивают. Спустя 3 минуты добавляют 1,5 мл раствора глютамата 10% и щепотку пемзы. Балон вынимают со льда и присоединяют к холодильнику. Перегонку производят в сухом, состоянии, причем дистиллят собирают в градуированную пробирку емкостью в 15 мл. Содержание пробирки доводят водой до 7 мл и затем добавляют 1 мл 2,5% спиртового раствора п-диметиламинобензальдегида и 1 мл НС1 6 н. Точно через 2 минуты производят фотоколориметрический отсчет (5300А) яркости появившейся окраски, с использованием кювет в 3 см.
Калибровочную кривую строят с помощью разбавлений гидроксипролина от 0,001 до 0,008 мг.
Идентификацию аргинина производят с помощью реактива Сакагуки, состоящего из двух растворов. 1-й раствор: а-нафтола 0,01% в спирте 95%, содержащем 5% мочевины. 2-й раствор: растворяют 2 г брома в 100 мл NaOH 5%. Оба раствора сохраняют на холоде (+4°) в цветных бутылках.
Для идентификации в 10 мл первого раствора (сс-нафтол) растворяют 5 таблеток NaOH и затем этим раствором пропитывают фильтровальную бумагу, содержащую 1 каплю определяемого препарата. Высушивают в струе горячего воздуха. Мелко размельчают с гипобромитом натрия (2-й раствор). Почти немедленно аргинин дает устойчивое красное пятно. Другие гуанидиновые однозамещенные производные дают в этих условиях пятна розово-фиолетового цвета. Другие аминокислоты дают отрицательную реакцию. Чувствительность реакции: 0,0001 мг свободного аргинина или в виде полипептида.
Определение аргинина основано на колориметрической реакции, тождественной с вышеприведенной.
Анализируемый раствор (разбавленный до 5 мл) охлаждают на льду и затем добавляют: 1 мл спиртного раствора оксина 0,02% (0,2% раствор о-оксихинолина в спирте 96% разбавляют 1:10 водой непосредственно перед употреблением) 1 мл NaOH 10% и две капли гипобромитного раствора (см. выше реакция идентификации). После краткого встряхивания добавляют 1 мл раствора мочевины 40%.
Встряхивают и затем тотчас же производят отсчет на фотометре (5000 А). Калибровочную кривую строят с помощью стандартных растворов аргинина содержащих 0,01–0,05 мг аргинина.
Определение орнитина. В сильно кислой среде нингидрин дает с орнитином специфическую окраску, которую можно фотоколориметрировать Присутствие значительных количеств пролина и гексоновых оснований препятствует специфичности этих реакций.
Нингидриновый раствор приготовляют растворяя 0,625 г нингидрина в 10 мл фосфорной кислоты 6 м; объем дополняют до 25 мл ледяной уксусной кислотой.
Из анализируемого (нейтрализованного) раствора берут 1 мл в пробирку, добавляют 3 мл уксусной кислоты и 1 мл раствора нингидрина и помещают на 1 час при 100°С в водяную баню. После охлаждения добавляют 5 мл ледяной уксусной кислоты и фотоколориметрируют (5000 А) яркость появившейся окраски. Калибровочную кривую строят с помощью орнитина в количестве 0,01-0,04 мг.
Идентификацию гистидинаитирозина можно производить с помощью реактива Паули: 10 мл сульфаниловой кислоты 0,5% в НС1 н/1, смешивают с 5 мл раствора нитрата натрия 5%; затем добавляют 10 мл водного раствора карбоната натрия 10%.
Этим реактивом опрыскивают фильтровальную бумагу, на которую наведена 1 капля исследуемого образца.
В случае присутствия тирозина появляется красное пятно. Гистидин дает краснофиолетовое пятно. Остальные аминокислоты реакции не дают. Чувствительность реакции: 0,0002 мг гистидина и 0,0005 мг тирозина.
Колориметрическое определение гистидина может быть также проведено с помощью реактива Паули. В мерную колбу в 25 мл вводят 5 мл анализируемого препарата (содержащего 0,02–0,1 мг гистидина). Добавляют 1 мл сульфаниловой кислоты 1 % в НС1 н/1 и 1 мл нитрита натрия 5%. Встряхивают в течение 5 минут и затем добавляют 3 мл раствора карбоната натрия 10%. Быстро встряхивают, охлаждают водой и затем добавляют 10 мл этилового спирта 20%. Охлаждают под краном и фотоколориметрируют (5000 А). Калибровочную кривую строят применяя количество гистидина от 0,02 до 0,1 мг.
Более значительные количества тирозина, гистамина и аммиака (причем последний можно удалить нагревая анализируемый препарат) препятствуют специфичности метода.
Определение тирозина. Измененный микрометод Томаса дает возможность определить количество в 0,005 мг тирозина, с использованием фотоколориметрического определения (5000 А) красного цвета получаемого при обработке тирозина а-нитрозо-(3-нафтолом в присутствии азотной кислоты.
В мерную колбу на 5 мл вводят: 0,5 мл анализируемого продукта, 0,25 мл Н8Р04 (уд. вес = 1,71), 0,5 мл НС1 (уд. вес = 1,19), 0,1 мл HN03 м/1 и 0,5 мл раствора а-нитрозо-3-нафтола 0,1 %^в NaOH 0,2 н. Смесь выдерживают точно 4 минуты в кипящей водяной бане. Охлаждают. Объем дополняют до метки НС1 6 н. Встряхивают и фотоколориметрируют. Для построения калибровочной кривой используют тирозин.
Определение гликокола можно производить колориметра, чески, определяя в присутствии хромотропной кислоты формальдегид, получаемый в результате воздействия нингидрина на гликокол.
Хромотропная кислота – это 1,8-дигидроксинафтален-3,6-дисульфоно- вая кислота. В качестве реактива используется 5% раствор этой кислоты.
В колбу на 50 мл, приспособленную к холодильнику, последовательно вводят 2 мл фосфатного буферного раствора с pH 5,5 (3,5 г калиевого фосфата на 100 мл раствора однокалиевого фосфата 20%), 1 мл раствора нингидрина 1% и 5 мл анализируемого препарата/содержащего 0,05–0,02 мг гликокола. Колбу приспосабливают к холодильнику и быстро перегоняют в мерную колбу на 20 мл. Затем колбу для перегонки погружают в воду со льдом, добавляют еще 2 мл дистиллированной воды и продолжают перегонку до получения сухого остатка. В мерной колбе объем дистиллятов дополняют до метки (20 мл). Затем, в случае необходимости фильтруют и к 5 мл фильтрата медленно добавляют 4 мл концентрированной серной кислоты, а после охлаждения 0,1 мл раствора хромотропной кислоты. Смешивают и выдерживают в течение получаса в бане с кипящей водой. Охлаждают и затем фотоколориметрируют (5000 А). Для построения калибровочной кривой применяют гликокол в количестве от 0,05 до 0,2 мг.
Этот метод дает возможность определять только свободный гликокол. Если биологический препарат содержит белковые вещества, то следует предпочесть предварительное осаждение (вольфрамат натрия 10% в кислой среде).
Определение фенилаланина. В присутствии сульфоазотной смеси эту аминокислоту нитрируют, а в результате обработки цинковым порошком в кислой среде получают соответствующий амин, который в результате сочетания с а-нафтиламином дает азокраситель, который можно фотоколориметрировать. Следовательно, реакция происходит в 4 этапа.
1. Для нитрирования, препарат (содержащий 0,02–0,05 мг фенилаланина) выпаривают в фарфоровой чашке на водяной бане. Остаток нагревают в течение 20 минут с 2 мл сульфоазотной смеси (нитрат калия 10% в концентрированной серной кислоте).
2. Восстановление производят путем количественного перевода нитрированного препарата в мерную колбу на 20 мл. После дополнения объема водой, содержимое мерной колбы переводят в колбу Эрленмейера на 150 мл вместе с 1 г цинкового порошка. После 1-часового контакта (и встряхивания) фильтруют.
3. Диазотирование производят в мерной колбе на 10 мл, в которую вводят: 2 мл фильтрата, 2 мл NaOH 2н. и после появления осадка, 1 мл НС1 н/1, растворяющий осадок; охлаждают. Добавляют 0,4 мл раствора нитрита натрия 0,1% и по истечении 1–2 минут 1 мл сульфоната аммония 5%. Встряхивают в течение 10 минут.