Методы, основанные на специфическом связывании веществ лигандами (лигандные технологиии)
Основные положения и принципы методов
Основой данной группы методов исследования служит свойство специфического связывания исследуемого вещества лигандами — природными или синтетическими соединениями, имеющими к этому веществу (аналиту) высокое сродство. В подавляющем большинстве случаев речь идет об иммунохимической реакции связывания исследуемого белка (аналита), который согласно иммунохимической терминологии является антигеном со специфическим белком антителом.
Иммунохимические методы – совокупность методов определения химического строения и свойств антигенов и антител, а также химических закономерностей их взаимодействия. Принципы иммунохимических методов основаны на специфичности иммунологической реакции и белковой природе антител.
Однако в иммунохимической реакции антигеном может быть и низкомолекулярное вещество, в этом случае оно называется гаптеном. В настоящее время в лабораторной аналитике чаще всего в качестве лигандов используют антитела, значительно реже другие белки, например транспортные или клеточные белки – мишени гормонов. В последнее время появились сообщения о разработке нового класса лигандов – аптамеров (от лат. apt us – соответствовать, точно подходить). Это – семейство синтетических одноцепочечных олигонуклеотидов РНК и ДНК, среди которых, как выяснилось, можно найти представителя, обладающего очень высоким сродством почти к любому соединению.
Антитела – белки, содержащие углеводную часть, образуются и секретируются плазматическими клетками. Они принадлежат к белкам плазмы и называются иммуноглобулинами, или гамма-глобулинами.
В качестве антител в лабораторной диагностике используют белки класса IgG. Их молекулы состоят из тяжелых и легких цепей, сложенных таким образом, что молекула имеет форму латинской буквы «У», на обеих ножках находятся одинаковые гипервариабельные участки (т.е. такие участки, аминокислотный состав которых у разных антител очень различен), это – связывающие рецепторы (рис. 4.1). Тем самым каждая молекула антитела может соединяться с двумя молекулами антигена.
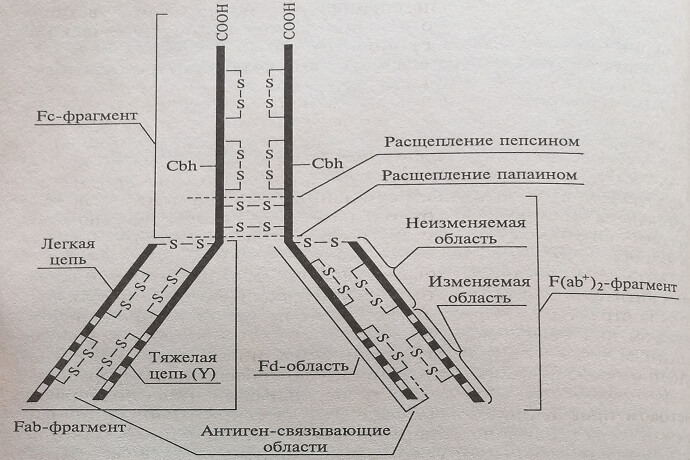
Рис. 4.1. Схема молекулы антитела IgG: Cbh — углеводы; —S—S— — дисульфидные мостики; F(ab+)2, Fc, Fab, Fd- основные фрагменты, образующиеся при протеолитической ферментативной обработке
На поверхности антигена в свою очередь находится много различных детерминант, или эпитопов, участков, с которыми может специфически связываться рецептор антитела. Поэтому против молекул антигена одного сорта может быть выработано много различных антител, но каждое антитело содержит два одинаковых рецептора и может связываться только с одним определенным участком (детерминантой) антигена. Если молекула IgG встречает две молекулы белка, содержащие детерминанты, которыми она может связаться, образуется мостик, соединяющий молекулы антигена. За счет подобных мостиков могут образовываться и более крупные конгломераты.
Различают моноклональные и поликлональные антитела. В первом случае речь идет об антителах, все молекулы которых одинаковы, их рецепторы имеют сродство (направлены) против одних и тех же детерминант (участков поверхности) антигена, а поликлональные антитела представляют собой смесь антител против разных участков поверхности одного и того же антигена. Поэтому моноклональные антитела очень специфичны, но не очень чувствительны в том смысле, что для проведения иммунохимической реакции нужна их высокая концентрация.
Поликлональные антитела могут в буквальном смысле слова облепить молекулу антигена, поэтому реакция — более выраженная, но менее специфичная. Поликлональные антитела получают традиционным способом – путем иммунизации животного, а моноклональные – размножением в тканевой культуре потомков одной и той же клетки – клеточного клона, все клетки которого вырабатывают одинаковые молекулы антител против одной и той же детерминанты антигена. Если данный набор антител — поликлональных или реже моноклональных – реагирует не только со «своим» антигеном, но и с другими, то говорят о перекрестных реакциях.
Аптамеры оказались серьезными конкурентами моноклональных антител, потому что это – синтетические соединения, химическая структура которых известна, их всегда можно получить в нужном количестве и необходимого качества. Моноклональные антитела – это природные соединения, никто не знает, какая именно последовательность аминокислот обеспечивает формирование нужного рецептора.
Моноклональные антитела подбирают методом проб и ошибок, выделяя тот клеточный клон, который вырабатывает наиболее специфические белки, однако никогда нельзя гарантировать, что это самые специфичные. Может быть, самого специфичного клона в данной популяции и нет. Если линия клеток-производителей погибла, восстановить производство точно таких же антител уже невозможно. Аптамеры лишены этих недостатков, поэтому среди них удается найти вещества, обладающие на порядок большим сродством к аналиту. Недостаток аптамеров – их чувствительность к действию содержащихся в биологическом материале ферментов нуклеаз, способных быстро разрушить любую цепочку ДНК или РНК.
Для того чтобы преодолеть это отрицательное свойство, используют олигонуклеотиды, в которых некоторые гидроксильные группы рибозы или дезоксирибозы заменены на метальную или аминогруппу, или на фтор.
Методами избирательного связывания определяют много разнообразных веществ, хотя в большинстве своем это – белки, а также полипептиды, гормоны небелковой природы и лекарственные препараты. В любом случае задача заключается в том, чтобы сделать видимым образовавшийся комплекс, который отличается от исходных аналита и лиганда в первую очередь большим размером. Все иммунохимические методы, как и другие методы, основанные на связывании лигандами, в той или иной форме используют это обстоятельство.
Закономерности образования крупных комплексов «антиген антитело» несколько отличаются от других вариантов связывания с лигандами тем, что антитела имеют по две связывающие ножки; на антигене много детерминант. Если антител мало (меньше чем молекул антигена), то самые большие комплексы могут состоять только из двух молекул аналита, соединенных мостиком из антитела. При увеличении количества антител могут образовываться и более крупные комплексы, в которых несколько молекул антигена соединены аналогичным способом. Такие крупные комплексы плохо растворимы и выпадают в осадок (преципитат) что лежит в основе реакции преципитации. Если наблюдается избыток молекул антител (их больше, чем детерминант, с которыми они связываются), комплекс растворяется, потому что антитела только одной ножкой присоединяются к антигенам, для второй нет свободной детерминанты. Реакция «антиген-антитело» проявляется в растворе в виде образования агрегатов. Если при определении антигена ввести в тест-систему постоянное количество антител, то при невысокой концентрации белка-антигена все антигены связаны с антителами. Если образующиеся иммунные комплексы осадить центрифугированием, то в надосадочной жидкости можно определить несвязанные антитела. Такое явление называют избытком антител (зона А, рис. 4.2).
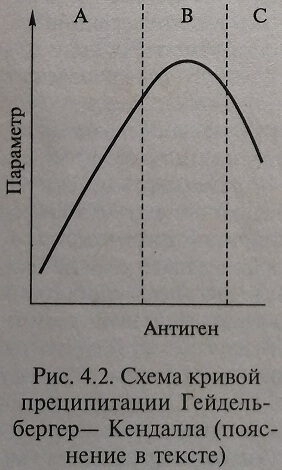
В том случае, если концентрация антигенов и антител пропорциональна, происходит связывание всех антигенов и антител, такой комплекс выпадает в осадок в виде Преципитата, и в над-осадке не определяются ни антитела, ни антигены. Это состояние называют эквивалентным (зона В, пик кривой, см. рис. 4.2). Подбирая соответствующие условия, область эквивалентности можно расширить, но устранить этот эффект нельзя.
При дальнейшем увеличении концентрации антигена количество антител бывает недостаточным для полного связывания белка. Частицы иммунных комплексов становятся мелкими, преципитат не образуется. В надосадочной жидкости определяются свободные антигены. Данное состояние называется избытком антигена (зона С, см. рис. 4.2).
В 1929 г. М. Гейдельбергер и Ф. Кендалл описали эти взаимоотношения между концентрацией антигена и антител в растворе в виде графика – классической преципитационной кривои Гейдельбергера-Кенделла (см. рис. 4.2). Во всех методах иммунопреципитации – преципитации Гейдель-радиальной иммунодиффузии, иммуно-бергер – Кендалла (пояс электрофореза ) антитело доведены таким образом, что реакция протекает в зоне эквивалентности. В случае избытка антигена образуются растворимые иммунные комплексы малого размера, снижается измерительный сигнал. Для получения сигнала, пропорционального количеству антигена, биожидкость разводят таким образом, чтобы концентрация антигена пришлась на пределы восходящей части кривой Гейдельбергера- Кендалла.
В классическом варианте на выполнение реакции «антиген-антитело» уходили часы или даже сутки, однако оказалось, что это время можно значительно сократить, проводя реакцию в растворе, содержащем 30-50 г/л полиэтиленгликоля-6 ООО (ПЭГ). Это высокомолекулярное соединение, связывающее значительный объем воды, снижает растворимость белка, ускоряет процессы в оставшемся свободном пространстве, приводит к повышению преципитации иммунного комплекса и расширяет зону эквивалентности. Присутствие в реакционной смеси ПЭГ создает определенную вязкость раствора, молекулы ПЭГ заполняют часть объема реакционной смеси. Относительная концентрация белка в таком растворе становится выше и реакция взаимодействия белка (антигена) и антител в таком растворе проходит значительно быстрее. Результаты исследования в таких методах можно получить уже спустя несколько минут.
Определение антигена или антитела возможно только тогда, когда реакция «антиген-антитело» может быть визуализирована или измерена. Выбор метода определения зависит от характеристик антигена (размеры, количество, структуры антигенных детерминант) и характеристик соответствующих антител (авидность, специфичность). Антигены и антитела могут быть измерены методами прямой и непрямой детекции, детекции на основе меченого антигена или антитела.
Признаком того, что наступило специфическое связывание, является образование комплекса аналита и лиганда, который отличается прежде всего более крупными размерами молекулы. В некоторых случаях эти комплексы настолько велики, что выпадают в осадок – образуется видимый на глаз преципитат. Иногда, чтобы определить количество комплекса, его отделяют от непрореагировавшего продукта – гетерогенный анализ, если об образовании комплекса судят по появлению каких-либо новых свойств молекул – это гомогенный анализ.
Прямые методы детекции антигена или антитела включают технику агглютинации корпускулярных антигенов, опосредованную антителами, и исследования, в которых наблюдается реакция преципитации. К таким методам относятся: прямая агглютинация, например тест прямой гемагглютинации для определи ния группы крови; агглютинация бактерий (определение антител реакция Видаля); реакции классификации и типирования бактерий (определение антигена – реакция Грубера); преципитиновые реакции – реакции с образованием преципитата. Многие из этих реакций проводят в полутвердой матрице (агароза, агар) радиальная иммунодиффузия, иммуноэлектрофорез, электрофорез с иммунофиксацией, электроиммунодиффузия, двунаправленный иммуноэлектрофорез. Анализ антигенов или антител как растворимых иммунных комплексов (иммунонефелометрия и иммунотурбидиметрия) также относится к группе методов прямой детекции.
Непрямые методы детекции антигена или антитела применяют в тех случаях, когда иммунопреципитат имеет очень низкий предел детекции, прямая визуализация преципитиновой реакции невозможна. Но если лиганд связан с твердой фазой, такой, как частицы латекса, то реакция «антиген-антитело» становится видимой, например, в форме агглютината. К этой группе относятся методы латексной агглютинации, непрямой (пассивной) гемагглютинации, тесты ингибирования гемагглютинации, тесты фиксации комплемента.
Иммуноанализ с использованием антигенов или антител, меченных различными способами, применяют для обнаружения и определения антител (или антигенов) в низких концентрациях. Методические принципы включают конкурентное и неконкурентное связывание. Далее приведена краткая характеристика наиболее распространенных методов, основанных на специфическом связывании аналита.
Иммунодиффузия
Это – один из методов иммунологического анализа антигенов и антител, основанный на реакции преципитации в геле. В результате реакции между антигенами и антителами, поступающими в гель путем диффузии, в зоне оптимального их соотношения образуются полосы преципитации, легко выявляемые визуально или окрашиванием на белки.
Особенность метода заключается в том, что каждая пара «антиген-антитело» формирует свою полоску, и реакция не зависит от наличия в системе других антигенов и антител. Местоположение полос преципитации определяется скоростью диффузии антигенов и антител и их концентрацией в исходных растворах.
Пассивная диффузия в геле может быть одиночной, когда устанавливается градиент концентрации для одного реактанта (например, антигена), а среда импрегнирована антителом. Вариантом этого метода является радиальная иммунодиффузия (РИД).
РИД служит методом количественного определения белков. Исследование выполняют на специальных пластинках, на поверхности которых закреплен слой геля, содержащий моноспецифицные. Подобные пластинки выпускают отечественные предприятия.
В геле есть лунки для внесения 5 мкл исследуемой пробы, обычно, без предварительного разведения и обработки трех различных калибраторов, в качестве которых могут быть использованы только специальные, приготовленные в промышленных условиях и откалиброванные по калибраторам более высокого уровня, растворы исследуемого белка.
Исследуемое вещество (аналит) и антитело (реактив) диффундируют в геле навстречу друг другу. В результате создаются противоположные по направлению градиенты концентраций реактива и аналита. Растворимая часть иммунных комплексов сначала образуется около места нанесения пробы. С увеличением радиуса диффузии концентрация нанесенного антигена будет уменьшаться с образованием нерастворимых комплексов. В определенном месте соотношение антигена и антитела таково (эквивалентная зона кривой Гейдельбергера-Кенделла), что выпадает осадок (преципитат) и образуется четкая линия преципитации в виде круга, обычно видимая на глаз, но иногда возникает необходимость в специальном красителе, который делает зону преципитации более отчетливой.
Пластины инкубируются при комнатной температуре в течение 12-24 ч, продолжительность зависит от определяемого антигена и оговаривается инструкцией к набору, например для определения IgG достаточно 12 ч. За это время вокруг лунки формируется зона преципитации, диаметр которой измеряют с помощью специальной линейки с точностью до 0,1 мм.
Расчет выполняют по калибровочному графику, при построении которого исходят из того факта, что концентрация исследуемого белка (антигена) пропорциональна квадрату диаметра преципитата или площади поверхности, очерченной окружностью линии преципитации.
Известны возможности объективизировать определения, выполняемые методом РИД, с помощью компьютеризированного считывателя (ридера). Пластины после проведенной диффузии помещают на площадку ридера над источником света и оценивают по двум изображениям треугольных светодиодов, расположенных на противоположных сторонах кольца преципитации. Результаты опытных и контрольных проб рассчитываются автоматически в соответствии с выбранной программой калибровочной кривой (по диаметру или по площади колец преципитации) и выводятся на экран прибора в величинах диаметров колец преципитации, их площади и концентрации исследуемых белков.
Преимущество этого метода состоит в его простоте, он не нуждается в сложной аппаратуре, поэтому подходит для небольших лабораторий, где исследуют малые серии. В то же время, метод продолжителен, трудоемок, не может быть автоматизирован, имеет достаточно низкую чувствительность, оценка результатов в значительной мере субьективна. В целом метод достаточно надежен, однако присутствие в одной из проб необычных белков (например, моноклональной природы), которые быстро диффундируют и попадают в места расположения других преципитатов, может повлиять на результаты в соседних лунках.
Чрезвычайно большая концентрация исследуемого белка может привести к образованию зоны преципитации, в которой нарушены обычные соотношения между радиусом и количеством антигена. Надо иметь в виду также, что маленькие молекулы антигена диффундируют быстрее больших, поэтому при том же количестве белка радиус зоны преципитации больше.
Двумерная иммунодиффузия, или метод двойной диффузии Оухтерлони характеризуется установлением градиента концентраций и для антигена, и для антитела. Этот метод позволяет сравнивать два исследуемых материала и устанавливать идентичность или неидентичность антигенов в них. Наиболее простой вариант этого метода проводят в чашках Петри, наполненных агаром. В одну из лунок наносят антитело, в две других – антигены: известный и неизвестный. При их идентичности образуется одна сплошная дугообразная полоска преципитации, в противном случае — две пересекающиеся полоски. При близости, но не идентичности антигенов образуется одна сплошная полоска преципитации и другая, не пересекающая ее (частичная идентичность). Четвертый вариант позволяет в третью лунку поместить два антитела.
Иммуноэлектрофорез
Метод представляет собой комбинацию двух методов – иммунодиффузии и электрофореза. Первоначально выполняют процедуру электрофореза белков в геле агара или агарозы, помещенном на тонкую стеклянную или пластмассовую пластинку (на рис. 4.3 – это лунки х, у, z для внесения сыворотки). После ее завершения в узкий желобок полосы, сформированной вблизи его края (параллельно направлению движения разделяемых белков), вносят антисыворотку к определенному виду белка, каждую в отдельную бороздку (на рис. 4.3, а – антисыворотка, содержащая антитела к пяти белкам; на рис. 4.3, б – к двум белкам; на рис. 4.3, в – к одному белку) и дают ей возможность диффундировать в геле агара. Гель инкубируют во влажной камере при температуре 4 °С в течение 24-72 ч. В месте контакта антисыворотки с электрофоретически разделенными белками образуются преципитационные дуги вследствие образования комплексов «антиген-антитело», характерные для отдельных белков. При сравнении с известной контрольной сывороткой белки могут быть идентифицированы.
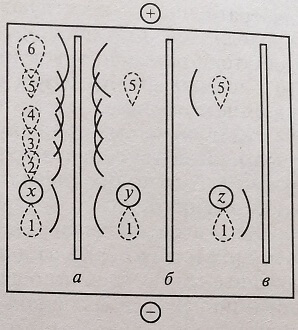
Рис. 4.3. Схема проведения иммуноэлектрофореза на геле агара/агарозы
При необходимости положение специфических полосок может быть зафиксировано зафиксировано с помощью их окрашивания и фотографирования.
Метод позволяет разделить более 25 белков сыворотки. Для детального анализа состава белков с более высоким разрешением можно проводить поперечный иммуноэлектрофорез с разделением компонентов в двух направлениях.
Иммуноэлектрофорез противоточный (встречный)
Это – метод электрофореза, в котором антитела под действием эндоосмоса перемещаются в геле в направлении к катоду, противоположном направлению перемещения в электрическом поле антигенов, обладающих электрофоретической подвижностью. Имея более низкую изоэлектрическую точку, антигены при электрофорезе перемещаются к аноду быстрее, чем антитела к катоду. В области реакции антигенов с соответствующими антителами образуются полосы преципитации (их расположение перпендикулярно направлению электрического тока), по которым выявляют исследуемые вещества.
Иммуноэлектрофорез прерывистый встречный
Метод представляет собой разновидность иммуноэлектрофореза, характеризующуюся уменьшением ионной силы в геле по сравнению с таковой буфера, заполняющего электродные камеры, а также сокращением (прерыванием) времени электрофореза до 1,0-1,5 ч.
Электроиммунодиффузия, иммуноэлектрофорез «ракетный» (метод Лаурелла)
Это иммунохимический метод, при котором также сочетаются иммунодиффузия и электрофорез. Он позволяет различить вещества по электрической подвижности с помощью специфической преципитации между антигеном, нанесенным на пластинку с гелем (агар, агароза) или на ацетат целлюлозы, и соответствующими антителами, содержащимися в геле. Метод получил такое название за форму, которую приобретают преципитаты в результате реакции «антиген-антитело», проходящей в геле.
Вдоль кромки геля делают ряд лунок, в которые помещают исследуемый материал, например диск из фильтровальной бумаги размером 4 мм, обильно пропитанный кровью, после чего проводят электрофорез. При этом в слое геля создается электрическое поле, благодаря которому антиген входит в гель. Поскольку антигены обычно движутся быстрее, чем антитела, но в одном направлении, реактанты продвигаются в геле вместе. Это позволяет пренебречь различиями в относительной молекулярной массе веществ и конфигурации неправильной формы. Высота «ракеты», образующейся в ходе такой реакции, прямо пропорциональна концентрации антигена, ее измеряют от верхней границы лунки до высоты пика.
«Ракетный» иммуноэлектрофорез – вариант метода, при котором градиент концентрации устанавливается лишь для одного антигена, как и при радиальной иммунодифузии, однако приложение напряжения побуждает нанесенный в лунки антиген двигаться в сторону гомогенной суспензии антител в геле. При их контакте и образуются заостренные «ракетообразные» линии преципитации. Сравнение со стандартом, нанесенным на ту же пластинку, позволяет проводить количественную оценку исследуемого белка.
Поскольку калибровочная кривая для этого метода линейна лишь в узком диапазоне концентраций, исследуемую пробу приходится соответственно разводить или концентрировать. Недостатки метода заключаются в большой продолжительности процедуры (2-18 ч) и малой производительности.
Метод иммунофиксации
В методе иммунофиксации после проведения однонаправленного иммуноэлектрофореза на различные зоны геля наносят специфичные антисыворотки. Иммунопреципитаты связывают с гелем, а остальные непреципитировавшие белки удаляют промыванием геля. Окрашивание геля позволяет наблюдать и идентифицировать исследуемые белки.
Комбинация электрофореза с иммунофиксацией и субтращией (иммунофиксация с вычитанием)
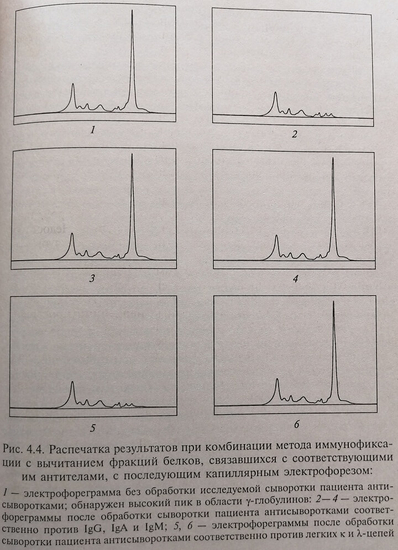
Метод позволяет точно определять специфичность белкового расстройства. Иммунофиксация состоит в связывании фракций белков сыворотки со специфическими антителами, закрепленными в лунках сефарозы. Связавшаяся с антителом фракция белка не выявляется при последующем капиллярном электрофорезе сыворотки. В приведенном на рис. 4.4 примере проба разведенной сыворотки наносится на пять различных подложек, каждая из которых содержит специфическое антитело – три из них специфичны для тяжелых цепей иммуноглобулинов (IgG, IgA, IgM), а два (по одной) для легких цепей. После контакта с твердой подложкой проба подвергается электрофорезу параллельно с необработанной пробой сыворотки.
Специфический иммуноглобулин идентифицируется отсутствием соответствующего пика при сравнении с электрофореграммой белков необработанной антителами сыворотки данного пациента: на рис. 4.4 на электрофореграмме 2, полученной после обработки исследуемой сыворотки антисывороткой против IgG, высокий пик в области у-глобулинов, отмечаемый на электрофореграмме 1 отсутствует; на электрофореграмме 5, полученной после обработки сыворотки пациента антисывороткой против легких к-цепей, также отсутствует высокий пик, наблюдаемый на электрофореграмме 1. В данном случае речь идет о у-глобулинопатии по типу IgG и легких к-цепей.
Методы определения антигенов или антител как растворимых иммунных комплексов
Принцип этих методов заключается в том, что растворимые комплексы «антиген-антитело» способны поглощать или рассеивать падающий на них свет. Светопоглощение может быть измерено фотометрически, светорассеяние – нефелометрически (иммунофелометрические методы).
Эти микрометоды нашли применение для определения широкого спектра индивидуальных белков в биологических жидкостях в клинико-диагностических лабораториях. Включение в состав реактивов ПЭГ или других полимеров позволяет выполнять реакцию в течение нескольких минут.
Распространению методов способствовало появление готовых наборов реактивов, анализаторов (фотометрических анализаторов турбидиметров и нефелометров), а также достижения в стандартизации этих методов: разработка вторичных калибровочных растворов для наборов реактивов на основе референтного материала CRM 470. Как правило, калибровочные графики в этих методах носят нелинейный характер.
Пределы измерения концентрации белков регламентируются изготовителями наборов реактивов. При этом следует учесть, что, исходя из кривой Гейдельбергера–Кендалла, одинаковые результаты могут быть получены, когда измерение проводят в избытке антител (на восходящей части кривой, до зоны эквивалентности), и в избытке антигена (нисходящая часть кривой после зоны эквивалентности). Существует ряд приемов (с разведением проб или с добавлением белка), которые позволяют преодолеть этот эффект и правильно определить концентрацию антигена в пробе.
Наиболее точные результаты получают при применении этой группы методов на автоматических анализаторах, адаптированных для исследования Индивидуальных белков, в том числе и с использованием многоточечных, кинетических измерений.
Методы этой группы применяют не только для определения концентрации индивидуальных белков, содержащихся в больших количествах в биожидкостях, но и для тех антигенов, концентрация которых невелика. В этих случаях (например, при определении ревматоидного фактора) антитела иммобилизуются на синтетических полимерных (чаще из полистирола) латексных частицах. Они и входят в состав реактивов. При этом молекулы антигена образуют мостики между частицами латекса, потому что на поверхности каждой такой частицы много детерминант. Повышается чувствительность метода, избыток антигена не мешает реакции. Этот принцип, используемый для количественного определения в растворах индивидуальных белков, которые содержатся в биожидкостях в количествах (10-8 моль/л) с помощью нефелометрии или турбидиметрии, получил название латексной, или усиленной частицами, турбидиметрии. В литературе обозначается английской аббревиатурой PETIA (Particle Enhanced Turbidimetric Immunoassay/ или LPIA (Latex Particle Enhanced Immunoassay).
Латексные тесты
Методы основаны на использовании латексных частиц размерами 80-1000 нм, на которых адсорбированы чаше всего антитела к искомому антигену, для проведения реакции «антиген-антитело».
Поскольку на антигене много детерминант, к ним подсоединяются адсорбированные на латексе антитела. Добавление достаточного количества антигена приводит к склеиванию (агглютинации) латексных частиц, чему избыток антигена не мешает. Растворения комплекса «антиген-антитело» в избытке антигена не происходит, а образовавшийся агглютинат становится видимым. Реакция существенно усиливается, когда участвующие в ней «партнеры» образуют крупные частицы.
Как правило, латексные тесты выпускают в виде наборов реактивов, к которым приложены контрольные сыворотки, дающие положительную и отрицательную реакцию. Иногда взвеси латексных частиц в буферном растворе подкрашивают красителями разных цветов.
Постановка реакции латексагглютинации очень проста. На стеклянную или пластмассовую пластинку или пленку на темном фоне наносят сыворотку и реактив и перемешивают. Спустя 2-3 мин считывают результат, покачивая пластину, регистрируя агглютинацию частиц (качественный метод). Метод не калибруется. Для количественной оценки результатов ставят серию разведений исследуемой сыворотки физиологическим раствором и учитывают то максимальное разведение, при котором еще наблюдается агглютинация. Реакция может быть выполнена и в пробирках.
Иммуноанализ с использованием меченых антигенов или антител (immunoassay)
Иммуноанализ включает большую группу методов, имеющую разнообразные варианты. Основная суть методов заключается в том, что образовавшиеся в ходе иммунохимической реакции или изолированные комплексы «антиген-антитело» соединяются с другими партнерами по реакции, которые называются «маркерами», или «метками», способствующими обнаружению или количественному определению исследуемого вещества. Метка может быть соединена с антителом или антигеном. Этот комплекс называется конъюгатом.
Таким образом, в этих видах исследований аналит (антиген или антитело) оказываются связанными с мечеными антителом или антигеном, в результате образуется сигнал, который может быть обнаружен или измерен.
Маркеры в иммуноанализе указывают на присутствие лиганда и дифференцируются на связанные и несвязанные. Избыток несвязанной метки называется свободной фракцией. В качестве метки могут быть использованы различные вещества: радиоактивные изотопы – такие методы называются радиоиммунными (РИА или ИРМА); ферментиммуноферментные методы (ИФА); (хеми)люминесцентные-иммунолюминесцентные методы; флюоресцирующие вещества-иммунофлюоресцентные методы.
Как уже указывалось, методы иммуноанализа можно подразделить на две категории: гомогенный и гетерогенный иммуноанализ. В гомогенном иммуноанализе метка, присутствующая в несвязанном, свободном, состоянии дает сигнал, отличающийся от сигнала связанного, меченого комплекса «антиген-антитело» Поэтому нет необходимости в этапе их физического разделения в гетерогенном иммуноанализе одна из фракций (обычно связанный комплекс) прикрепляется к твердой фазе, покрытой антигеном или антителом, поэтому другие фракции должны быть удалены (отмыты, отцентрифугированы).
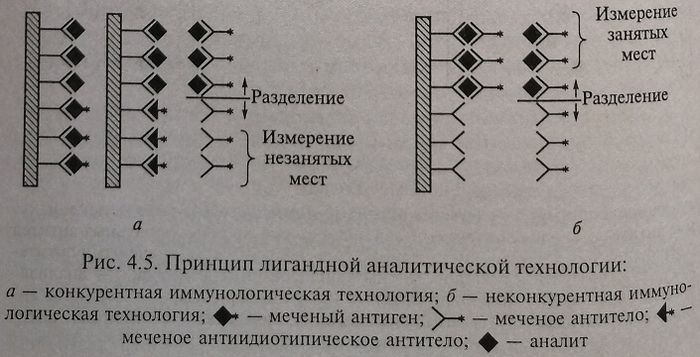
Конкурентный иммуноанализ (конкурентное связывание, сатурационный анализ)
Все реактивы согласно данному методу смешивают одновременно или последовательно. В первом случае в реакционную систему добавляют пробу, содержащую исследуемый аналит, и известное количество аналогичного аналита, меченного каким-либо образом (например, радиоактивным изотопом йода). В результате происходит конкуренция меченого и немеченого антигенов за связывание с ограниченным количеством антител, входящих в состав реакционной смеси: чем больше в пробе аналита, тем меньше меченого аналога свяжется с антителами; чем ниже концентрация аналита, тем больше меченого аналога свяжется с антителами. После завершения реакции в зависимости от технологии связанную фракцию можно отделить центрифугированием или отмыванием и определить количество метки (рис. 4.5).
При последовательной постановке реакции анализируемый антиген в пробе помещают в реакционной смеси сначала в условия, при которых он приходит в равновесие с избытком антител, а затем добавляют меченый антиген. После отделения несвязанного с меткой комплекса от связанной метки измеренный сигнал используют для расчета концентрации анализируемого антигена в 1 пробе.
Неконкурентный иммуноанализ
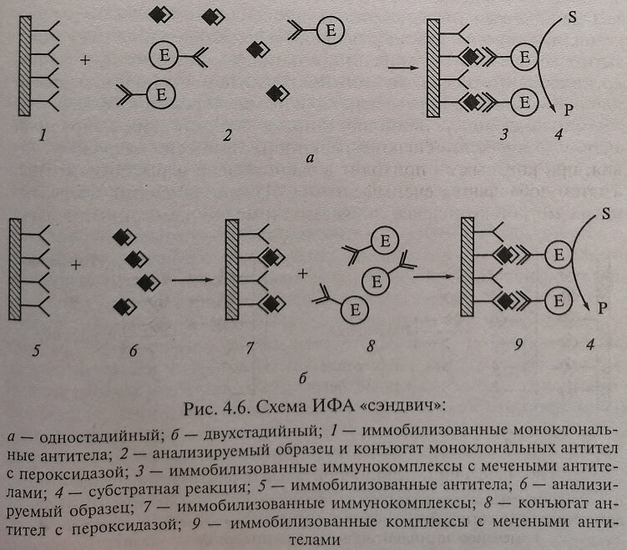
Классическим примером неконкурентного иммуноанализа является метод «сэндвича». Он основан на том, что каждый белок имеет много детерминант-участков, к которым могут подсоединяться антитела, причем антитела также являются белками, которые могут связываться с соответствующими антителами. В этом случае на какой-либо твердой фазе (подложке, например, полистирольной ячейке, пробирке, бусинах, шариках и т. д.) адсорбированы специфичные антитела против исследуемого белка-антигена, способные связать все его количество, имеющееся в пробе.
При одностадийном «сэндвиче» одновременно пипетируют исследуемый образец и меченые антитела (рис. 4.6, а), при двухстадийном – после связывания исследуемого аналита адсорбированными на твердой фазе антителами, другие белки отмывают и удаляют. На второй стадии в систему добавляют меченые антитела (конъюгат), которые связываются с уже связанным с антителами на твердой фазе исследуемым антигеном, но на месте другого эпитопа (рис. 4.6, б), образуя «сэндвич». Избыток меченых антител отмывают и определяют количество связавшейся метки, которое прямо пропорционально содержанию исследуемого белка пробе. Метод является типичным примером гетерогенного иммуноанализа. Один из наиболее часто используемых вариантов – это когда в качестве метки антитела используют фермент (enzyme linked immunosorbent assay – ELISA).
В неконкурентных методах исследования антител натвердофазной поверхности иммобилизуется специфический к искомому антителу антиген. Анализируемое антитело, реагируя с этим антигеном, образует комплекс «антиген-антитело». Остальные белки удаляют методом промывки, далее добавляют меченые антитела к другому эпитопу исследуемого антитела, уже связавшегося с антигеном на твердой фазе. Избыток конъюгата удаляют промыванием.
Разделение всех методов иммуноанализа на две группы – конкурентных и неконкурентных («сэндвича»), в которых непосредственно определяют либо количество связанного аналита, либо количество незанятых им мест связывания, условное, поскольку можно определять сразу оба параметра, нужно только метить их разными метками. Это усложняет и изготовление набора реактивов, и непосредственно аналитическую процедуру, однако позволяет увеличить точность исследования. По этому направлению ведут разработку иммуноанализа с повышенной точностью.
Радиоиммунологический анализ (РИА)
Это – метод исследования взаимодействия антитела с антигеном, при котором в один из компонентов вводят радиоактивную метку. Он требует наличия специфических антител в качестве связывающего агента. Метод основан на законе действия масс, в соответствии с которым определяемое вещество конкурирует со своим аналогом (антигеном), меченным радиоактивным изотопом, за ограниченное число мест связывания антитела до достижения химического равновесия компонентов реакционной смеси.
Разновидность РИА – метод двойной системы антител, в котором комплекс «антиген-антитело» обрабатывают антиглобулиновой преципитирующей сывороткой (вторые антитела) с последующим отделением преципитата центрифугированием.
Иммунорадиометрический метод (ИРМА)
Определение антигена с помощью меченых антител получило название иммунорадиометрического метода. Биожидкость смешивают с избытком меченых антител к исследуемому веществу и после инкубации удаляют непрореагировавшие антитела путем фиксации на твердофазном сорбенте. Количество меченых антител в надосадочной жидкости прямо пропорционально содержанию исследуемого вещества.
Вариантом метода ИРМА является метод двойного связывания, в котором определяемый антиген образует комплекс с антителами, иммобилизованными на твердофазном сорбенте; после удаления свободного антигена добавляют меченые антитела, выявляющие комплекс. Радиоактивность вновь образующегося комплекса «антитела-антиген-меченое антитело» служит мерой концентрации вещества.
Методы РИА обладают очень высокой чувствительностью, позволяют определять очень малые количества веществ, радиоизотопы обладают высокой «специфической» активностью. Однако они характеризуются и недостатками. Для их выполнения необходимо применение радиоактивных веществ, их производство, хранение, уничтожение и т.д. Кроме того, как правило, наборы реактивов для РИА имеют короткий срок хранения (несколько месяцев), что создает трудности для обеспечения бесперебойной работы этими методами. Обычно используют изотопы возбуждающие у-радиацию, имеющие период полужизни 60 дней.
Радиоаллергосорбентный метод
Этот метод является вариантом метода РИА, его используют для определения в крови человека антител к разным видам аллергенов, например IgE или компонентов классического пути активации комплемента. Аллерген иммобилизуют на твердой основе – диске из фильтровальной или хроматографической бумаги (отсюда другое название теста — бумажный радиоиммуносорбентный тест – БРИСТ), на которую наносят исследуемую биожидкость. В присутствии соответствующих антител образуется прочно связанный с диском комплекс «антиген-антитело». После удаления несвязавшихся антител к этому комплексу добавляют антитела сыворотки животных, например кроликов, меченные изотопом 1251 против определяемых антител. После удаления несвязавшихся меченых антител подсчитывают радиоактивность дисков с фиксированным на них комплексом «аллерген-антитело-антиген-антитело 1251».
Основные группы методов разделения свободных и связанных с антителами антигенов – это адсорбция свободных меченых антигенов на декстране, ионообменных смолах, Сефадексе; преципитация ПЭГ, этанолом, сульфатом аммония комплекса лиганда с антителом; иммунопреципитация комплекса «антиген-антитело» с помощью вторых антител, использование твердой фазы (стенки пробирки, в которой проводят реакцию, сферические поверхности, фильтры из нитроцеллюлозы, ячейки микротитровальных планшетов).
Один из современных методов — стрептавидинбиотиновый.
Стрептавидин – это тетрамерный белок с молекулярной массой 60 кДа, способный захватывать и связывать четыре биотинилированных антигена или антитела (рис. 4.7).
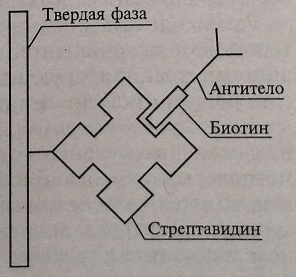
Рис. 4.7. Схема связывания биотинилированного антитела со стрептавидином на твердой фазе
Стрептавидинбиотиновый метод представляет собой систему для фиксирования антигенов или антител на твердой фазе. Такой твердой фазой могут служить покрытые стрептавидином пробирки и др.
Иммуноферментный анализ (ИФА)
Это вид иммуноанализа в котором для выявления комплекса «антиген-антитело» в качестве метки антигена, антитела или обоих компонентов этой реакции используют их конъюгаты с ферментами. Наиболее часто используемые ферменты – щелочная фосфатаза, пероксидаза из конского хрена, глюкозо-6-фосфатдегидрогеназа, (3-галактозидаза. После добавления специфического субстрата фермент превращает его в продукт, образование которого может быть измерено кинетически или методом конечной точки.
Различают гомогенный ИФА (EIA), в котором активность метки измеряют без разделения фракций реакционной смеси. Используемые метки включают ферменты, субстраты или ингибиторы, которые связываются с антигеном, либо антиген, связанный с ферментом и соответствующим антителом, связывается со вторым ферментом. Этот метод позволяет определять гаптены, имеющие малую молекулярную массу, выше 10 9 моль/л.
Вариант гомогенного ИФА (EMIT) – технология, при которой антитела к антигену ингибируют активность фермента в конъюгате. Добавление антигена с пробой биожидкости исследуемого аналита-антигена нейтрализует антитело и реактивирует фермент. Активность фермента прямо пропорциональна концентрации анализируемого антигена в биожидкости.
Существуют различные варианты гетерогенного ИФА, классическими примерами которого являются методы ELISA. Они в свою очередь основаны на конкурентном и неконкурентном связывании. В первом случае специфические антитела к исследуемому антигену иммобилизуются на твердой фазе (например, стенках пробирки). Анализируемый антиген и антиген, меченный ферментом, конкурируют за ограниченное число мест связывания на антителах, иммобилизованных на твердой фазе: чем выше концентрация исследуемого антигена, тем меньшее количество меченого антигена связано с антителами на твердой фазе. После связывания антигена с иммобилизованными антителами на твердой фазе другие белки отмывают и выбрасывают. Далее добавляют субстрат для измерения активности фермента, которая обратно пропорциональна концентрации аналита в биожидкости.
Примером неконкурентного ИФА – ELISA — служит уже описанный метод «сэндвича». Реакцию проводят в два этапа.
На первом этапе практически весь анализируемый антиген связывается со специфическими антителами против него, иммобилизованными на твердой фазе. После первой инкубации выполняет промывку буфером и удаление других белков. На втором этапе добавляют другие антитела к иному эпитопу анализируемого антигена, меченные ферментом (конъюгат).
В результате меченые антитела присоединяются к уже образовавшемуся на первом этапе комплексу «антиген-антитело». Таким образом, антиген окружен антителами с обеих сторон, а фермент, будучи неактивным в конъюгате с антителами, становится активным. Далее добавляют субстрат, специфичный в отношении данного фермента. Связанная ферментативная активность пропорциональна концентрации антигена в пробе. Известны методы ELISA, которые могут быть выполнены в один этап.
В иммуноэнзимометрическом анализе (IEMA) используют меченные ферментом антитела и связанный с твердой фазой антиген. На первом этапе реакции весь исследуемый антиген связывается меченными ферментом антителами. Реакция развивается в растворе. На втором этапе реакции избыток меченных ферментом антител связывается с антигеном, иммобилизованным на твердой фазе. Измеряют ферментативную активность растворимой фракции комплекса «антиген-антитело», которая пропорциональна концентрации исследуемого в биожидкости антигена.
Иммунофлюоресцентный метод (immunofluorescence test, IFT)
Это иммунохимический метод, основанный на использовании явления люминесценции (флюоресценции) для исследования реакции «антиген-антитело», происходящей на поверхности клеток микроорганизмов иди антител в сыворотке против таких клеток, в срезах тканей.
Локализацию изучаемых антигенов (антитела) обнаруживают в результате образования ими иммунных комплексов со специфическими антителами (антигенами), меченными флюоресцирующими красителями – флюорохромами (например, флюоресцеин, родамин). Таким образом, иммунофлюоресцентный тест представляет собой комбинацию гистологической и иммунологической технологий.
Различают прямые иммунофлюоресцентные тесты, в которых антигены, связанные с клетками, выявляют с помощью специфических к исследуемому антигену антител, конъюгированных с флюорофором. В непрямых иммунофлюоресцентных методах определяемый антиген тканевых клеток или микроорганизмов обрабатывают немеченой специфической антисывороткой против этого антигена. Несвязавшиеся белки отмывают, а связавшиеся с клетками антитела выявляют путем обработки препарата меченной флюорофором поливалентной антисывороткой против этих антител (глобулина немеченой антисыворотки).Флюоресцентную микроскопию проводят, используя различные источники света и наборы светофильтров. Наличие флюоресценции и ее интенсивность являются критериями присутствия исследуемого компонента и его концентрации.
Флюоресцентный иммуноанализ (FIA)
Метод объединяет варианты иммуноанализа, в которых в качестве маркера используют флюорохром. Как и в случае ИФА, известны методы гомогенного и гетерогенного FIA. Известно несколько вариантов методов гомогенного FIA.
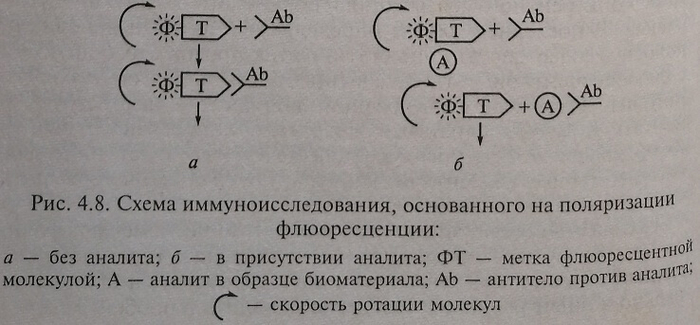
Иммуноанализ с измерением поляризации флюоресценции
Наиболее часто используемая метка — флюоресцеин. Меченое соединение очень мало и вращается быстро (низкая поляризация). После его связывания с большой молекулой антитела к аналиту в его отсутствие вращение значительно замедляется (поляризация изменяется от низкой к высокой). В присутствии аналита он связывается с антителом, меченое соединение вращается быстро (низкая поляризация) (рисунок 4.8).
Иммуноанализ с усилением флюоресценции
В том случае, если меченный флюорохромом антиген связывается с антителом, флюоресценция реакционной смеси усиливается. При добавлении исследуемого антигена происходит его связывание с антителами. Таким образом ингибируется усиление флюоресценции.
Иммуноанализ с гашением флюоресценции
Флюоресценция меченного флюорохромом антигена снижается, если он связывается с антителом. Добавление исследуемого антигена ведет к связыванию антител и увеличению флюоресценции.
Известны варианты методов гетерогенного FIA. Как и в гетерогенном ИФА, свободный меченный флюорохромом антиген отделяется от связанного с антителом антигена перед измерением флюоресценции.
Флюоресцентный иммуноферментный анализ на микрошариках
На микрошариках иммобилизуются антитела к исследуемому антигену. На первом этапе анализируемый антиген инкубируется с микрошариками. Затем добавляют вторичные антитела к этому антигену, меченные щелочной фосфатазой. Это ведет к образованию «сэндвича» на микрошариках. На этапе разделения реакционную смесь пипетируют на матрицу из стекловолокна, на которой удерживаются микрошарики. На последнем этапе матрицу промывают буфером, содержащим субстрат метилумбеллиферилфосфат. На этом этапе удаляют несвязанные, меченные щелочной фосфатазой антитела, а связанная в «сэндвиче» на микрошариках щелочная фосфатаза становится активной в отношении субстрата и гидролизует его в месте присоединения фосфатной группы. Образуется метилумбеллиферон, флюоресценцию которого измеряют.
Многослойный флюоресцентный иммуноанализ («сухая» иммунохимия на полосках и слайдах)
Нанесенная на аналитический элемент (например, многослойную пленку) Исследуемая проба, проникает в специальный слой. Определяемый антиген диффундирует в более глубокий слой, содержащий буфер и детергенты. Под слоем, содержащим буфер, находится слой пленки с молекулами окислов железа. Антиген первоначально мигрирует через этот слой. Он достигает расположенного под ним сигнального слоя, который содержит иммунные комплексы, состоящие из аналога исследуемого меченного флюорофором антигена и гомологичного антитела. Антиген пробы вытесняет меченный флюорофором антиген из этого иммунного комплекса. Меченый антиген мигрирует в слой, содержащий окислы железа, и не флюоресцирует при воздействии света, возбуждающего флюоресценцию. Чем выше концентрация определяемого антигена, тем меньше флюоресценция. Эта технология предназначена для измерения очень малых молекул, например тиреоидных гормонов. Полоски, предназначенные для гетерогенной «сухой иммунохимии» или многослойные пленки могут быть основаны на технологии «сэндвич», конкурентного связывания и обратимого образования комплекса. В последнем случае определяемый антиген наносят на полоску, содержащую конъюгат антител против этого антигена с флюоресцентной меткой, соединенной с аналогом исследуемого вещества. Если в ходе реакции конъюгат подвергается ферментативному гидролизу, его флюоресценцию можно измерить. Когда комплекс антигена и конъюгата диссоциирует, определяемое вещество и его конъюгат конкурируют за ограниченное число мест связывания на антителах.
Количество замещенного конъюгата антигена измеряют флюорометрически после ферментативного гидролиза (конъюгат, связанный с антителом, невосприимчив к гидролизу) и пропорционально концентрации определяемого аналита в пробе.
Люминесцентный иммуноанализ
В зависимости от конкретн исследования носителем люминесцентной метки также могут быть
антигены или антитела. В иммуноанализе используют хемилюминесценцию. Окисление изолюминола перекисью рода вызывает образование аминофталатов и люминесценцию света при 425 нм. Реакцию катализирует пероксидаза хрена.
В случае биолюминесценции образованию света в люминесцентной системе предшествует ферментативная реакция:
- реакция хемилюминесценции;
- реакция биолюминесценции.
В системе «люциферин-люцифераза» фермент катализирует окисление люциферина в «возбужденный» продукт, который разрушается, когда люминесцирует. Предшествующие образованию энергии реакции могут включать, например, АТФ-пируваткиназную реакцию, в случае использования системы «люциферин- люцифераза», полученной из светлячков, или окислительные реакции, если используется НАДФ – независимая система «люциферин-люцифераза», полученная из грибов, морских водорослей или бактерий.
В люминесцентном иммуноанализе малых молекул (тироксин, дигоксин и т.п.) используют технологию конкурентного связывания, когда эндогенный антиген-аналит конкурирует с антигеном, меченным люминолом или эфиром акридина, за ограниченное число мест связывания моноклональными моноспецифическими антителами. Измеряемый сигнал люминесценции обратно пропорционален концентрации определяемого антигена. Принцип этого анализа сходен с принципом конкурентного РИА. «Сэндвич»-технологию используют для иммуноанализа молекул больших размеров, таких, как тиротропин (ТТГ), паратиреоидный гормон, ферритин, хорионический гонадотропин человека, про- лактин, изофермент креатинкиназы MB.
Иммунолюминометрический анализ (ILMA)
В варианте метода, который носит название «иммунолюминометрический анализ», захватывающие антиген антитела в избытке закреплены на твердой фазе и на первом этапе инкубации связывают определяемый антиген. После отмывки всех остальных белков, во время второй инкубации комплексы «антиген-антитело», закрепленные на твердой фазе, взаимодействуют со вторыми антителами, меченными люминесцентной меткой. Измеряемый люминесцентный сигнал пропорционален концентрации анализируемого антигена в биожидкости.
Иммунолюминометрический метод с мечеными вторыми антителами
Технология метода аналогична иммунолюминометрическому анализу (ILMA). Суть заключается в том, что после образования иммунного комплекса исследуемого антигена с иммобилизованными на твердой фазе специфическими антителами добавляют вторые специфические антитела к исследуемому антигену. В результате образуется «сэндвич». Затем этот «сэндвич» метят специфичными, меченными люминесцентной меткой, антителами и измеряют люминесценцию.
Иммуноанализ с использованием электрохемилюминесценции
Технология метода аналогична описанной ранее. Это «закрытая» технология, на основе которой работают различные варианты автоанализаторов «Elecsys» для хемилюминесцентного иммуноанализа.
С появлением люминесцентного иммуноанализа стало возможным определение веществ, имеющих различную молекулярную массу, с аналитической чувствительностью, сравнимой с чувствительностью радиоиммунологического анализа.
Вследствие высокой специфической активности флюоресцентные и люминесцентные метки позволяют определять вещества с более высокой чувствительностью, т. е. имеют болбе низкий предел определения или обнаружения (до 10~20 моль), чем это позволяет, например, радиоактивная метка 1 - 10-18 моль.
Иммуноблоттинг
Данный вид анализа включает методы, основанные на образовании окрашенного пятна в том месте, где произошло связывание аналита. В сущности, блоттинг - это перенос электрофоретически разделенных белков на иммобилизованные матрицы. Основные преимущества этих технологий заключаются в следующем: возможность получить на матрице идеальную копию электрофоретического разделения образцов белков, присутствующих в геле; после переноса образца на матрицу существует возможность проведения с ним большого количества аналитических процедур, которые впоследствии могут быть приложены к иммобилизованным белкам, в то время как в гелях после электрофореза проводить такие реакции невозможно; через технологию блоттинга можно комбинировать различные типы высокоразрешающего электрофореза в геле, включая изоэлектрическое фокусирование и двунаправленный электрофорез с разнообразны-ми исследованиями связывания белков в матрице; для идентификации белков могут быть использованы антитела; лиганды могут быть элюированы с иммобилизованного антигена, различные лиганды могут быть использованы для связывания на одном и том же блоте (пятне). Существуют различные методы блоттинга.
Саутерн блоттинг
Это – технология, в которой разделенные электрофоретически фракции ДНК переносятся с агарозы на нитроцеллюлозу под действием капиллярных сил. Фрагменты ДНК на нитроцеллюлозных фильтрах далее гибридизируются с радиоактивной РНК для проверки комплементарных последовательностей.
Нортерн блоттинг
Метод представляет собой модификацию при которой РНК и малые фрагменты ДНК, которые недостаточно прочно связаны с нитроцеллюлозой, могут быть ковалентно связаны с диазобензилоксиметиловой бумагой. Метод используют для идентификации РНК.
Вестерн блоттинг
Этот метод представляет собой процедуру электрофоретического переноса белков с додецилсульфатполиакриламидных гелей на полосу чистой немодифицированной нитроцеллюлозы. Данный метод лежит в основе иммуноблоттинга (им- муноблот), использующего иммунохимическую реакцию для идентификации белков.
Иммуноблот — очень чувствительный метод визуализации специфических белков. В целом эта реакция может быть разделена на фазы (рис. 4.9). Первоначально проводят разделение белков методами высокоразрешающего электрофореза в геле (двунаправленный электрофорез или изоэлектрическое фокусирование). В качестве гелей чаще всего используют полиакриламидный гель или агарозу. Буферные растворы, как правило, содержат додецилсульфат натрия или мочевину. Далее белок переносят из среды, в которой проводили электрофоретическое разделение, на твердую фазу. В качестве твердой фазы используют полоски (стрипы) нитроцеллюлозы или мембраны на нейлоновой основе. Твердая фаза должна иммобилизовать белки так, чтобы не наблюдалось их диффузии. Для этого применяют ковалентное связывание с нитобензилоксиметил- или цианогенбромйдактивированной бумагой. Перенос белков с электрофоретической среды на твердую фазу выполняют либо методом простой диффузии (под вакуумом, повышенным давлением) при капиллярном давлении, либо электрофоретически (электроблоттинг).
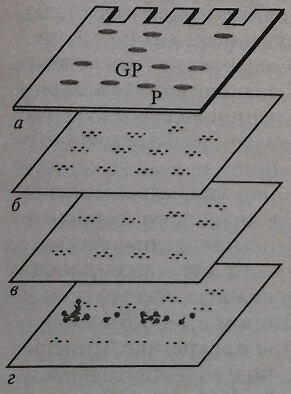
Рис. 4.9. Принцип иммуноблота: а – гель с разделенными белками (Р) или гликопротеинами (GP); б – твердая фаза с перенесенным белком; в – инкубация с антителами, образование иммунных комплексов; г – инкубация с антителами, меченными ферментом (конъюгат)
Наиболее эффективен и чаще всего применяется метод электроблоттинга. После переноса белков на твердую фазу неспецифические места связывания на ней блокируются. Белки (в виде полос) определяют путем использования антител, меченных ферментами или радиоактивными изотопами. После добавления субстрата связанный конъюгат выявляется в виде окрашенной полосы.
Микроточечный анализ. Биочипы
Суть микроточечного анализа заключается в том, что на твердой подложке в точке диаметром приблизительно 10-50 мкм иммобилизованы антитела, специфичные для определенного аналита. После экспозиции исследуемой биожидкости с этими антителами (их называют «сенсорными», т.е, антителами, распознающими антиген), образования комплекса «антиген-антитело», удаления остатка исследуемой пробы добавляют так называемые «развивающие, или выявляющие», антитела, специфичные к другому эпитопу определяемого антигена (в случае, если иссдедуют аналиты с большой молекулярной массой) или «выявляющие» антитела к незанятым местам связывания антигена на «сенсорных» антителах (в случае определения аналитов с малой молекулярной массой).
Можно использовать технологию неконкурентного и конкурентного связывания. Оценку фракционной занятости «сенсорных» антител можно провести по измерению отношения между «сенсорными» (а-фотоны, образующиеся под действием возбуждающего луча лазера в случае использования флюоресцентных меток) и «выявляющими» (р-фотоны) антителами, образующими димеры двойных антител. Измеряют это отношение путем использования различных меток для данных антител, например пары радиоактивных меток, ферментов, хемилюминесцентных маркеров либо меток другого происхождения. Большое значение имеет использование флюоресцентных меток. Соотношение а- и (3-фотонов является мерой для расчета концентрации аналита. Каждая микроточка, как указано ранее, предназначена для отдельного аналита.
Если поместить на твердую подложку мономолекулярный слой антител в микроточках ко многим аналитам, то в случае применения флюоресцентных меток и оптического сканирования оказывается возможным в одной пробе провести анализ многих компонентов, т. е. выполнить многопараметровый анализ десятков, сотен и даже тысяч различных веществ в пробе объемом 0,1-1,0 мл.
Многопараметровые чипы имеют до 100 дискретных (отдельных) мест для разных аналитов на одном чипе. Чувствительность этих методов намного выше, чем обычного иммуноанализа. Известные технологии иммуноанализа на биочипах применяют в автоанализаторе «EVIDENCE». Онипредназначены для исследования многих аналитов (гормонов, аполипопротеинов, онкомаркеров, маркеров повреждения сердечной мышцы, бесплодия, анемий), для определения лекарств, средств, вызывающих токсикомании, и т.д.
Количество дискретных мест на биочипе будет зависеть от избранной панели аналитов для исследования. Каждую из технологий иммуноанализа применяют на любом биочипе, представляющем собой квадрат из плотного материала площадью 9 мм2.
Добавление проб пациентов в точки для каждого аналита (теста) и реактивов, инкубация, калибровки и другие операции данный анализатор выполняет автоматически. Биочип (каждую точку для аналитов на нем формируют в заводских условиях) содержит различные антитела и другие компоненты в зависимости от каждого вида исследований. Метод конкурентного связывания используют для определения аналитов с низкой молекулярной массой, метод «сэндвич» – для анализа веществ с большой молекулярной массой, технологии с захватом антител – для выявления аллергенов в пробе пациента.
По завершении анализа биочип сбрасывается в емкость, находящуюся в автоанализаторе. Количественное определение и качественное обнаружение аналитов основано на принципе измерения хемилюминесценции высокочувствительного субстрата для пероксидазы.