Окислительные энзиматические системы содержащие в своей структуре железо
Цитохромы, пероксидаза и каталаза являются наиболее известными окислительными энзимами, содержащими железо. В настоящем разделе будут описаны методы определения этих энзимов. Кроме них, в настоящее время известны также и другие железосодержащие окислительные энзимы: миелопероксидаза, лактопероксидаза, цитохромпероксидаза и др.
Цитохромы

Цитохромы, описанные Кейлином, на основании исходных указаний Мак Мунна обеспечивают переокисление восстановленных флавинэнзимов в результате акцептирования электрона из водорода удаляемого из субстрата (рис. 60). Вначале Кейлин доказал присутствие в тканях 3 цитохромов, различающихся между собой длиной волны абсорбционных спектроскопических полос:
цитрохром а : б 040 А; цитрохром b : 5 560 А; цитрохром с : 5 500 А.
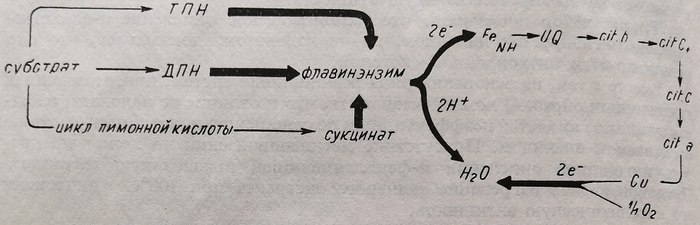
В настоящее время известно гораздо более значительное количество цитрохромов (а, ах, а2> а8, b, bх, b2, с). Цитрохром b известен также под названием «фактора Слатера», а цитрохром а8 идентичен с «цитохромоксидазой» окисляющей конечное звено цитохромной системы и катализирующей активность кислорода для фиксации расщепленного водорода Новейшие данные (Грин, 1961) показали, что в цитохромной систем располагается ряд других металлических энзимов, включающих некоторые белки с негемическим железом (рис. 64).
Рис. 64. Схема последовательности в цитохромной системе. 1 - ТПН; 2 – субстрат; 3 – ДПН; 4 – флавинэнзим; 5 – цикл лимонной кислоты; 6 – сукциват
Цитохром с. Он является компонентом наиболее подробно изученной цитрохромной системы. Устойчивое вещество, состоящее из белка и гематина, причем этот последний содержит также цистеиновые остатки. Содержание железа в цитохроме с колеблется в зависимости от вида организма, из которого он происходит, в пределах от 0,421 до 0,456%. Его молекулярный вес был оценен в пределах 12–13000, вследствие чего, наряду с термоустойчивостью цитрохрома с, некоторые авторы не склонны считать это вещество энзимом в обычно применяемом смысле этого термина. Оппенгеймер применяет для цитохромов название «мезокатализаторов».
Растворы цитохрома с имеют желтый цвет, который изменяется, превращаясь в красный при восстановлении цитохрома за счет контакта с дитионитом натрия, лейкофлавином, цистеином, аскорбиновой кислотой, гидрохиноном и др. Энзиматически цитохром восстанавливается цитохромоксидазой (цитохром а3).
Приготовление цитохрома с можно произвести исходя от сердечной мышцы (быка, свиньи и др.) а, очищенной от жира и соединительной ткани, мелко нарубленной, из которой кровь удалена посредством выжимания. К примерно 1 кг таким образом приготовленной мышцы добавляют 1 л трихлоруксусной кислоты 2,5% и как можно чаще встряхивают в течение 2 часов. Экстракционная жидкость (pH которой составляет приблизительно 4), получается в результате выжимания всего материала в куске марли.
Жидкость доводят до значения pH 7, с помощью NaOH н/1 и центрифугируют в течение 10 минут; надосадочную жидкость сливают и затем к ней добавляют на каждые 100 мл объема по 50 г сульфата аммония. Оставляют на ночь в холодильнике, а на следующий день фильтруют, затем к фильтрату, опять на холоде, добавляют трихлоруксусную кислоту 20% в количестве, соответствующем 1/5 объема. Эта операция вызывает осаждение цитохрома и одновременно его восстановление. Осадок собирают посредством центрифугирования, промывают насыщенным раствором сульфата аммония и снова центрифугируют. Конечный осадок растворяют примерно в 20 мл дистиллированной воды, переводят в целлофановый мешок и диализируют в течение 2 дней при наличии раствора NaCl 1 %.
Концентрацию восстановленного цитрохрома с определяют спектрофотометрически, применяя длину волны 5 500 А.
Цитохром-с-оксидаза. Это вещество было описано впервые под названием «индофенолоксидазы», на основании того факта, что инокуляция животному а-нафтола и диметил-п-фенилендиамина («на-ди») вызывает появление индофенола синего в тканях животного.
Впоследствии было установлено, что реактив «на-ди» окисляется цитрохромом с, в свою очередь энзиматически окисляемым «цитохромоксидазой».
За исключением анаэробных микроорганизмов, присутствие цитохромоксидазы было обнаружено во всех формах жизни. Она активна лишь по отношению к цитохрому с, характеризуясь таким образом весьма высокой специфичностью.
Цитохромоксидаза ингибируется в присутствии цианового иона, сероводорода, азида натрия, а также при нагревании до 56°С.
Приготовление цитохромоксидазы можно произвести используя сердечную мышцу свиньи, быка и др., очищенную от жира и соединительной ткани, мелко нарубленной и обильно промытой водопроводной водой. Этот материал можно подвергнуть механическому растиранию (Varing blendor или PowerMaster) или растиранию в ступке (к 200 г материала добавляют 250 мл фосфатного буферного раствора 0,04 м. с pH 7,0 и 100 г кварцевого песка) После растирания, добавляют еще 350 мл фосфатного буферного раствора и центрифугируют 1 минуту при 1500 об/мин. Надосадочную жидкость смешивают со 100 мл ацетатного буферного раствора 0,2 м. с pH 4,5. Образовавшийся осадок собирают центрифугированием и снова взвешивают в приблизительно 35 мл фосфатного буферного раствора 0,1 м. с pH 7,3.
Таким образом полученная взвесь содержит цитохромоксидазу, цитохромы а и с, фумаразу и ряд дегидрогеназ. Коэнзимы 1 и II (ДПН и ТПН) отсутствуют или присутствуют лишь в весьма незначительных количествах.
Определение активности цитохромоксидазы возможно с помощью аппарата Варбурга по методу Штоца. В реакционный сосуд вводят следующие реактивы:
- 1 мл фосфатного буферного раствора 0,1 м с pH 7,2 1 мл раствора цитохрома с (с 107 молей на мл);
- 1 мл энзиматического препарата;
- 0,3 мл раствора гидрохинона 2,5% (вводят в боковое разветвление реакционного сосуда);
- 0,25 мл раствора КОН 10% вводят в нижнюю чашу реакционного сосуда.
В случае применения препарата состоящего из неочищенной цитохромоксидазы (содержащего также цитохромную систему) можно отказаться от добавления цитохромного раствора в реакционную систему.
Одновременно приготовляют второй реакционный сосуд с одинаковым содержанием, лишь с той разницей, что цитохромоксидазовый препарат предварительно нагревают до 56°С.
Затем реакционные сосуды устанавливают на соответствующих манометрах аппарата Варбурга и определяется расход молекулярного кислорода. Для реакции применяют температуру 37°С, причем гидрохинон из бокового разветвления добавляют в реакционную систему только после предварительного нагревания в момент начала определения.
Для подсчета цитохромоксидазной активности используемого препарата, из собственно образца вычитают значение расхода кислорода по второму контрольному манометру (где автоокислительный процесс происходит независимо от действия цитохромоксидазы). Расчет производят на 1 мл энзиматического препарата.
Цитохромоксидазной единицей считается количество энзима, вызывающее в описанных экспериментальных условиях – расход в 10 мм3 в час.
Кроме того, цитохром-с-оксидазу можно определять также, измеряя скорость изменения абсорбционного спектра восстановленного цитохрома с, в случае если он окисляется в присутствии энзиматического препарата.
Каталазы
Эти энзимы обладают белковой структурой и содержат в качестве простетической группы железо в виде геминового производного. За исключением нескольких микроорганизмов (семейство Lactobacteriaceae, род Clostridium и др.) присутствуют при всех формах жизни. Они специфически катализируют распад перекиси водорода и его производных (этилводородперекись), выделяя молекулярный кислород. Активной группой с каталитической точки зрения является железо, в гидратированной форме. Каталитическая реакция протекает с образованием каталазовой перекиси, реагирующей со второй молекулой перекиси водорода:
Fe – ОН + НаОа = Fe – ООН + НаО Fe - ООН + НаОа = Fe – ОН + НаО + Оа
Благодаря тому, что активная группа содержит железо, каталаза инактивируется синильной кислотой, азидом натрия, гидроксиламином и п-гидроксиламидобензолсульфонамидом. Эффект последних двух веществ угнетается присутствием сыворотки, сывороточного белка или гемина.
Определение активности каталазы. Метод Ойлера- Жезефсона пользуется для определения каталазовой активности дозировкой перекиси водорода, не расщепленной энзиматическим препаратом по истечении определеного промежутка времени контакта.
В качестве субстрата применяют перекись водорода 0,01 н. с фосфатным буферным раствором 0,0067 м. с pH 6,8. Раствор сохраняют при 0°С в сосуде со льдом. В одинаковых условиях (0°) производят все определения, во избежание внезапного разложения перекиси водорода.
Реакционная система следующая:
- 50 мл раствора перекиси водорода;
- 1 мл энзиматического препарата (разбавленного подходящим образом).
Одновременно приготовляют контрольную реакционную систему с одинаковым содержанием лишь с тем различием, что энзим был предварительно подвергнут инактивированию (при нагревании до температуры выше 70°С). С помощью этого контрольного образца можно установить внезапное разложение перекиси.
Тотчас же после того, как были приготовлены обе смеси, из каждой из них берут образец по 5 мл, который с помощью пипетки переводят в колбу Эрленмейера с 5 мл H2S04 2 н. Считается, что этот образец соответствует «нулевому времени».
Другие образцы по 5 мл берут по истечении 3, 6, 9,12, 30 и 60 минут, вливая каждый из них в колбы Эрленмейера с серной кислотой, причем эта последняя обеспечивает прекращение энзиматической реакции.
К концу во все колбы Эрленмейера с образцами добавляют по 2 мл йодистого калия 10% и 2 капли раствора молибдата аммония 1%, выделяющего количество йода, соответствующее энзиматически недиссоциированной перекиси. Свободный йод титруют затем раствором тиосульфата натрия 0,02 н.
Для подсчета результатов, принимая во внимание, что реакция энзиматической диссоциации перекиси водорода соответствует мономолекулярному типу, применяют известную формулу.
Таким образом установленное значение К для 1 мл энзиматического препарата дает возможность, подсчитать каталазную активность препарата. Эта активность выражается в «каталазной способности».
Для определения каталазовой активности могут быть использованы и другие способы:
- Определение количества молекулярного кислорода, выделяемого энзиматическим препаратом, в течение известного промежутка времени его контакта с субстратом (перекись водорода 0,01 н. в фосфатном буферном растворе 0,0067 н. с pH 6,8). Количество выделенного молекулярного кислорода определяется посредством манометрического метода Варбурга.
- Спектрофотометрическое определение интенсивности абсорбционного спектра Соре (специфичного для каталазы) использованием спектрофотометра Бекмана.
- Определение количества перекиси водорода, неразложившегося при действии каталазы, используя манганиметрическое титрование (раствор КМп04 0,1 н) , в присутствии серной кислоты (с конечной концентрацией 6–7%).
Пероксидаза
В присутствии перекиси водорода пероксидаза катализует окисление значительного числа метаболитов, обладающих феноловой или ароматической аминовой структурой. Так, пероксидаза превращает бензидин в п-хинондиимид, билирубин в биливердин, катехол в о-хинон, гидрохинон в хингидрон, о- и п-фенилендиамин в феназин, пирогалол в пурпурогаллин и т. д. Реакции окисления, катализируемые пероксидазой, весьма часто сопровождаются образованием красящих веществ: окисление адреналина ведет к появлению красного цвета, о-крезола – зеленого, м-крезола – красноватого, тритпофана и гваякола – краснобурых цветов и т. д. На этом свойстве основан наиболее широко применяемый метод определения перо- ксидазовой активности.
С этой целью приготовляют раствор пирогалола, 0,25%, к которому добавляют 0,5% перекиси водорода. К 10 мл этого раствора добавляют 1 мл энзиматического препарата. Смешивают и оставляют на 5 минут при 20°С. Затем энзиматическую реакцию останавливают добавлением 50 мл H2S04 5%. Образующийся пурпурогаллин извлекают из образца повторным встряхиванием с эфиром в разделительной воронке.
Эфирные экстракты соединяют вместе, доводят до известного объема и сопоставляют колориметрически со стандартным раствором пурпурогаллина в эфире.
Для определения пероксидазовой активности этим методом необходимо, чтобы используемый энзиматический препарат выделил в описанных условиях не менее 15–20 мг пурпурогаллина.
Активность энзима выражают в мг образовавшегося пурпурогаллина. Пероксидазовой единицей считают количество энзима производящее в вышеприведенных условиях 1 г пурпурогаллина. Чистоту пероксидазового препарата обычно выражают в «PZ» (Purpurogallin Zahl), представляющее число мг пурпурогаллина, образовавшихся в течение 5 минут при 20° эквивалентом 1 мг энзиматического сухого экстракта.
Дифференцирование пероксидазовой активности различных клеток или энзиматических препаратов можно произвести на основе различного поведения этих энзимов по отношению к:
- различным субстратам (так, например установлено, что в то время как полифенолы окисляются большинством клеточных пероксид аз, монофенолы, ароматические амины и мочевая кислота подвергаются окислению только в присутствии определенных пероксидаз);
- различным значениям pH (существуют пероксидазовые препараты, воздействующие либо в нейтральной зоне, либо в кислой среде);
- различным температурам (большинство пероксидаз отличаются оптимальным эффектом при температуре 37°С; другие весьма активны при более высоких температурах, около 70°С).
Для идентификации этих различий можно применять:
- в качестве субстратов: водные растворы пирогалола 2% (полифенол: 1,2,3-триоксибензол) и бензидина (ароматический диамин: 4,4- диамино-дифенил);
- реакцию можно проводить как при нейтральном значение pH (фосфатный буферный раствор 0,2 н. с pH 7,0–7,2), так и при кислом pH (ацетатный буферный раствор 0,2 м. с pH 4,0–4,5);
- ингибицию реакционных систем можно проводить как при 37°С, так и при 68°С в водяной бане.
Для практической работы реакционные системы приготовляют в центрифужных пробирках (емкостью 15–25 мл), причем берут вместе: 1 мл энзиматического препарата (для контрольного образца энзиматический препарат предварительно инактивируют нагреванием при 100°С в течение 20 минут), 4 мл буферного раствора, 0,5 мл раствора субстрата и 0,5 мл раствора перекиси водорода 1% (30% концентрации).
Пробирки инкубируют (одну серию при 37°С, а другую – при 68°С) и по истечении инкубационного периода быстро охлаждают (в воде со льдом) и центрифугируют 20 минут при 3 000 об/мин. К концу яркость окраски надосадочной жидкости определяют фотометрически (4 900 А), сравнивая с контрольным образцом.
Метод Мошковского для выявления пероксидазы на лейкоцитарных мазках (по Соболеву).
1 каплю свеже собранной крови наводят на стеклянную пластинку. Мазок фиксируют в течение 3 минут в формалине 4%, затем окрашивают.
Для окрашивания приготовляют раствор Романовского-Гимзы следующим образом: к 10 мл воды добавляют несколько кристаллов бензидина; энергично встряхивают до растворения; фильтруют; к фильтрату добавляют 5 капель раствора перекиси водорода 5 %. Затем добавляют 15 капель основного раствора Романовского-Гимза, а мазок окрашивают в течение 25 минут. После промывания и сушки исследуют под микроскопом (иммерсия).
Азурофильные и нейтрофильные грануляции полиморфонуклеаров, а также ядра миэлобастов и моноцитов окрашиваются в желто-золотистобурый цвет. Лимфоциты, лимфобласты и базофильные гранулоциты не реагируют.
Пероксидаза ингибupуется в присутствии синильной кислоты, сероводорода, азида натрия, окиси азота, гидроксиламина, дитионита натрия и тиомочевины. Аналогичный эффект дает избыток перекиси водорода.
Энзим может характеризоваться окислительной активностью не только в присутствии перекиси водорода, но и других перекисей, как например: перекиси этилводорода, перекиси эфира, перекиси скипидара, перекисленного диацетона и др.