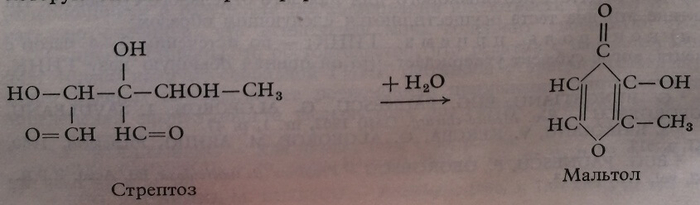Определение химиотерапевтических средств и антибиотиков
Биохимические методы определения антибиотиков и синтетических химиотерапевтических препаратов касаются, в первую очередь, туберкулостатических средств, так как в этих случаях результаты бактериологических методов получаются по истечении слишком продолжительного промежутка времени (8–21 день) вследствие медленного развития туберкулезной палочки. По этой причине в нижеследующем описаны методы определения химиотерапевтических препаратов, специфичных для туберкулезной палочки (гидразид изоникотиновой кислоты, п-аминосалициловая кислота, сульфоны, стрептомицин и др.).
Сульфаниламиды
Метод с реактивом Эрлиха
Реактивы.
- п-толуолсульфоновая кислота.
- Буферный раствор цитрата натрия: растворяют 39,40 г уксусной кислоты в 188 мл едкого натра 2 н, затем дополняют объем до 250 мл дистиллированной водой.
- Реактив Эрлиха: бесцветный п-диметиламинобензалдегид 2% в спирте 95°.
- Стандартный раствор сульфаминиламида. Приготовляют серию стандартных растворов султфаминиламида от 2,5 мг%, до 20% мг% обрабатываемых так же как и анализируемый образец, и затем используют для построения калибровочной кривой на фотометре Пульфриха с синим фильтром на 470 мл и кюветой на 10 мм.
Техника.
а) Свободный сульфаниламид. К 1 мл общей крови, сыворотки или спинно-мозговой жидкости добавляют 13 мл дистиллированной воды. Хорошо встряхивают и, если речь идет об общей крови, оставляют в покое на 3 минуты для завершения гемолиза, затем по каплям добавляют б мл п-толуолсульфоновой кислоты 20 % (1), непрерывно перемешивая, оставляют в покое на 5 минут и фильтруют. К 5 мл фильтрата добавляют 1 мл буферного раствора (2) и 2 мл реактива Эрлиха (3), после чего цвет сопоставляют с окраской стандартного раствора сульфонамида, наиболее сходной концентрации или отсчитывают затухание на фотометре Пульфриха.
б) Общий сульфаниламид (свободный и сопряженный) определяется тем же методом после того, как гидролизировался фильтрат, полученный после очищения кипячением до постоянного объема в течение одного часа на водяной бане.
Примечания. С терапевтической точки зрения интерес представляет только свободный сульфонамид, так как именно он является активным.
Для определения в моче пользуются тем же методом, однако учитывая, что в моче концентрация сульфонамида в 10–20 раз больше, чем в крови, причем мочу разбавляют в соответствующем соотношении.
Если стандартная кривая построена при помощи сульфаниламидных стандартных растворов и небходимо выразить результаты в сульфатиазоле, сульфапиридине и сульфадиазине, полученные значения умножают на 1,5.
Метод диазотирования
Определение в моче.
Реактивы:
- Трихлоруксусная кислота 50%.
- Нитрит натрия 0,1%. Раствор должен быть свежим.
- Раствор диметил-ос-нафтиламина: растворяют 2 мл перегнанного диметил-а-нафтиламина в смеси из 250 мл спирта 90° и 250 мл ацетона.
- Стандартный раствор сульфаниламида.
- Соляная кислота 10%.
- Едкий натр н.
- Сапонин 0,5%.
Техника.
1. Свободный сульфаниламид. К 1 мл мочи разбавленной 1/20 или даже 1/50 добавляют 9 мл дистиллированной воды, 1 мл трихлоруксусной кислоты 50% (1), 1 мл нитрата натрия 0,10% (2). Слегка встряхивают, затем добавляют 5 мл раствора диметил-а-нафтиламина (3), снова встряхивают и затем через пять минут цвет сопоставляют с окраской стандартного раствора ближайшей концентрации или отсчитывают затухание на фотометре Пульфриха.
2. Общий сульфаниламид (свободный и сопряженный). К 1 мл разбавленной также как и выше мочи, добавляют 2 мл соляной кислоты 10% (5), и затем ставят на 1 час в водяную баню для кипячения. После охлаждения нейтрализуют едким натром н (индикатор лакмус) (6), после чего определение продолжают по описанному способу.
Определение в крови. К 2 мл общей крови, взятой на оксалате калия добавляют 10 мл раствора сапонина 0,5 °/00 (7), встряхивают и оставляют в покое на 5 минут для завершения гемолиза крови. Эритроциты удерживают значительное количество сульфонамида. Затем добавляют по каплям 2 мл трихлоруксусной кислоты 50%, непрерывно перемешивая и по истечении 5 минут фильтруют. Из прозрачного фильтрата берут 10 мл к которым добавляют 1 мл дистиллированной воды и 1 мл нитрата натрия 0,10%, затем встряхивают и спустя 5 минут добавляют 5 мл раствора диметил-а-нафтиламина. Отсчет на колориметре или фотометре производят спустя 10 минут.
Примечание. Определение в спинно-мозговой жидкости производят тем же способом на 10 мл разбавленного продукта. Иногда, после добавления трихлоруксусной кислоты появляется слабая флокуляция, устраняемая фильтрованием.
Сульфоны
Определение производят по способам, описанным для сульфонамидов, пользуясь материнским сульфоном (диаминодифенилсульфон), для приготовления стандартного раствора. Поскольку концентрация сульфонов в моче ниже концентрации сульфонамидов, мочу разбавляют только 1/4, причем учитывается также собственная окраска мочи.
Примечание. Результаты, полученные с помощью этих методов определения сульфонамидов и сульфонов, хотя и не отличаются высокой точностью, все же являются достаточными для клинических нужд.
За сутки до определения больной не должен принимать п-аминосалициловой кислоты (ПАСК), гидразида изоникотиновой кислоты или других медикаментов, содержащих в молекуле группу амино, так как они реагируют таким же образом, как и сульфонамиды и сульфоны.
Парааминосалициловая кислота (ПАСК)
Метод диазотирования
Принцип. Для диазотирования сульфаниловой кислоты в водном растворе и в присутствии крепкой минеральной кислоты, с помощью азотистой кислоты, получают диазо-реактив (диазониевая соль).
Это диазопроизводное конденсируется в щелочной среде с фенолом или его производными (ПАСК и др.) образуя окрашенные в красный цвет производные азобензола.
Реактивы.
- Трихлоруксусная кислота 10%.
- Едкий натр 30%.
- Диазореактив: к раствору сульфаниловой кислоты 1% в соляной кислоте 10%, сохраняемому на льду, добавляют раствор нитрита натрия 10% до тех пор, пока реакция йодид-крахмал не станет весьма слабо положительной, после чего добавляют раствор сульфаниловой кислоты 1%, до отрицательности реакции. Реактив приготовляют непосредственно перед употреблением и сохраняют на льду.
- Стандартные растворы ПАСК. Приготовляют серию стандартных растворов от 1 мг% до 50 мг% ПАСК, которые обрабатывают в тех же условиях, как и анализируемый образец и используют для построения калибровочной кривой на фотометре Пульфриха с зеленым фильтром 350 мл и кюветой на 10 мм.
Техника. К 1 мл сыворотки добавляют 2 мл трихлоруксусной кислоты 10% (1), встряхивают, оставляют в покое 5 минут, затем фильтруют.
Из прозрачного фильтрата берут 2 мл (1 мл сыворотки), добавляют 0,25 мл едкого натра 30% (2) и 0,25 мл диазо-реактива (3), затем красный цвет сравнивают с цветом стандартного раствора ближайшей концентрации или отсчитывают затухание на фотометре Пульфриха.
Примечания. Сульфонамиды и п-аминобензойная кислота не дают окраски, а кровь в норме дает лишь незначительную окраску. Салициловая кислота дает окраску, яркость которой равна лишь 5% окраски вызываемой ПАСК.
Метод с хлорным железом.
Принцип. Как и любое феноловое производное, ПАСК дает с хлорным железом фиолетовую окраску, которую можно колориметрировать.
Реактивы.
- Хлористый кальций 10%.
- Аммиак 3 м.
- Соляная кислота 10%.
- Хлорное железо 10%.
Техника. К 10 мл мочи добавляют 5–10 капель раствора хлористого кальция 10% (1), доводят до рН=8-9 аммиаком 3 м и затем фильтруют, споласкивая фильтр несколькими миллилитрами дистиллированной воды. Фильтрат и промывочные воды доводят до рН=2 раствора соляной кислоты 10% (3), затем добавляют 2 капли хлорного железа и краснофиолетовый цвет сравнивают с цветом стандартного раствора ПАСК, обработанного таким же образом.
Примечание. Если моча содержит слишком большое количество ПАСК, ее разбаяляют дистиллированной водой.
Погрешность метода ± 5%.
В течение последних суток больной не должен принимать салициловой кислоты, салицилатов, аспирина и др., так как все эти препараты, одинаково реагируя с хлорным железом, искажают результаты определения
Метод можно применить также при определении ПАСК в крови.
К 10 мл крови, собранной на смеси оксалатов, добавляют 10 мл трихлоруксусной кислоты 10%, энергично встряхивают в течение 5 минут, затем фильтруют. К 5 мл прозрачного фильтрата добавляют 0,5 мл хлорного железа 10%, затем красно-фиолетовый цвет сравнивают с цветом стандартного раствора ПАСК, обрабатываемого одинаковым образом или отсчитывают затухание на фотометре Пульфриха на 530 м(л и кюветой на 10 мл.
Примечание. Как метод диазотирования, так и метод с хлорным железом дают возможность определять общую ПАСК.
Метод Мейер-Лауенера
ПАСК находится в крови в виде свободной ПАСК, ацетилированной ПАСК И глицин-ПАСК, а моча наряду с этими метаболитами содержит также ПАСК, связанную с глюкуроновой кислотой.
А. Определение свободной ПАСК
Принцип. Путем обработки буферным раствором цитрата pH 3, свободная ПАСК декарбрксилируется в н-аминофенол, который в кислой среде образует окрашенный продукт с п-нитроанилином, который фотометрируют.
Реактивы.
- Буферный раствор цитрата pH 3: к 596 мл соляной кислоты н. добавляют 81 мл едкого натра н. и 8,4872 г лимонной кислоты. Растворяют и дополняют дистиллированной водой до 1000 мл.
- п-толуолсульфоновая кислота 20%.
- Диазотированный п-нитроанилин: растворяется 90 мг п-нитроанилина в 100 мл соляной кислоты н, и 400 мл метилового спирта. К 100 мл этого раствора перед употреблением добавляют 10 мл нитрита натрия 1 % и спустя 10 минут приливают 10 мл сульфата аммония 10%.
- Стандартные растворы от 1 мг% до 50 мг% ПАСК для построения калибровочной кривой.
Техника. К 0,4 плазмы или мочи (разбавленной 1/50) добавляют 7,6 мл цитратного буферного раствора pH 3 (1). Погружают в течение 20 минут в кипящую водяную баню, охлаждают в воде со льдом, добавляют
2 мл п-толуолсульфоновой кислоты 20% (2), встряхивают и фильтруют.
К 5 мл прозрачного фильтрата добавляют 5 мл диазотированного п-нитроанилина, оставляют 45 минут при комнатной температуре, после чего отсчитывают затухание на фотометре с фильтром на 470 мл и кюветой на 10 мм, пользуясь контрольным образцом, заменяющим сыворотку или мочу с дистиллированной водой.
Затухание относят к калибровочной кривой, отмечая результат через А.
Б. Определение общей ПАСК
Принцип основывается на цветной реакции хлорного железа со всеми тремя феноловыми производными: ПАСК свободная, ацетил-ПАСК и глицин-ПАСК.
Реактивы.
- Эфир без перекисей.
- Соляная кислота н.
- Ацетон чистый.
- Хлорное железо, раствор 0,45% в буферном растворе соляной кислоты-гликокола pH 2,4.
- Хлороформ.
Техника. Берут 2 мл плазмы или негемолизированной сыворотки в пробирку с притертой пробкой. Добавляют 10 мл эфира (1) и 1,2 мл соляной кислоты н (2) и встряхивают 2 минуты. После отделения отсасывают пипеткой 7 мл эфирного экстракта и выпаривают досуха. Осадок растворяют в 0,5 мл ацетона (3) и 5,5 мл дистиллированной воды, затем добавляют 1 мл хлорного железа 0,45% (4) и слегка встряхивают. Если раствор мутный, добавляют 1 мл хлороформа,- встряхивают и центрифугируют.
Фотометрический отсчет производят по истечении 5 минут с зеленым фильтром на 530 м|х и кюветой на 10 мм используя контрольный образец, заменяющий сыворотку с дистиллированной водой. Затухание относят к калибровочной кривой и затем результат отмечают через В.
Примечание. Для определения мочи необходим предварительный гидролиз продукта сопряжения ПАСК с глюкуроновой кислотой. Для этого берут 5 мл мочи, разбавленной 1/50 или 1/100, добавляют 5 мл серной кислоты 20% и выдерживают в течение 5 часов на кипящей водяной бане, благодаря чему все метаболиты ПАСК переходят в м-аминофенол. Дополняют до исходного объема, берут 0,5 мл гидролизата, добавляют 4,5 мл дистиллированной воды и 5 мл диазотированного п-нитроанилина. Оставляют на 45 минут до появления окраски и отсчитывают затухание, используя фильтр на 470 м(х и кювету на 10 мм с помощью контрольного образца, в котором мочу заменяют дистиллированной водой. Затухание относят к калибровочной кривой, учитывая также степень разбавления.
В. Определение суммы Ацетил-ПАСК + свободная ПАСК
Принцип. Посредством кипячения с п-толуолсульфоновой кислотой 20 % происходит гидролиз ацетил-ПАСК и декарбоксилирование свободной ПАСК в м-аминофенол, присоединяющийся к диазотированному п-нитроанилину.
Реактивы:
- п-толуолсульфоновая кислота 20%.
- Диазотированный п-нитроанилин.
Техника. К 0,4 мл плазмы, сыворотки или мочи (разбавленной 1/50) добавляют 7,6 мл дистиллированной воды и 2 мл п-толуолсульфоновой кислоты 20% (1), затем погружают на 45 минут в кипящую водяную баню. После охлаждения фильтруют, берут 5 мл прозрачного фильтрата и обрабатывают 5 мл диазотированного п-нитроанилина (2). Оставляют на 45 минут для появления окраски, затем отсчитывают затухание с помощью фильтра на 470 мл с кюветой на 10 мм. Результат относят к калибровочной кривой, полученной с помощью стандартных растворов ПАСК и отмечают результат через С.
Расчет:
А – ПАСК свободная в мг%.
В – ПАСК общая в мг%.
С – ПАСК свободная + ацетил – ПАСК в мг%.
Принимая во внимание также соответствующий удельный вес, можно подсчитать:
D – ацетил – ПАСК – (С–А) X 1,27 в мг%.
Е – глицин – ПАСК = (В–С) X 1,37 мг%.
Примечание. Метод дает возможность определять все метаболиты ПАСК и вместе с тем он является весьма чувствительным. По этим причинам он превосходит все выше описанные методы.
Гидразид изоникотиновой кислоты (ГИНК)
Метод Шорта
Принцип. Свободная ГИНК дает с 1,2-нафтохинон-4-сульфоновой кислотой желтую окраску, которую можно колориметрировать.
Реактивы.
- Трихлоруксусная кислота 10%.
- 1,2-нафтохинон-4-сульфоновая кислота 0,1%.
- Двухнатриевый фосфат 0,5 н.
Техника. К 10 мл крови, взятой на оксалате натрия добавляют 10 мл трихлоруксусной кислоты 10% (1), хорошо встряхивают и фильтруют. Из прозрачного фильтрата берут 10 мл (5 мл крови), к которым добавляют 4 мл дистиллированной воды, 2 мл 1,2-нафтохинон-4-сульфоновой кислоты 0,1% (2) и 4 мл двухнатриевого фосфата 0,5 н (3). Оставляют на 30 минут в темноте для появления окраски, затем полученный желтый цвет сопоставляют с цветом стандартного раствора 2–3 г/мл ГИНК или отсчитывают затухание на фотометре Пульфриха с синим фильтром на 470 мл и кюветой на 10 мм.
Метод с реактивом Эрлиха
Принцип. Свободная ГИНК дает с реактивом Эрлиха желтый азометин, окраска которого пропорциональна концентрации химио-терапевтического препарата.
Реактивы.
- Сульфат аммония.
- Едкий натр 0,5 н.
- Смесь эфира с амиловым спиртом: смешивают 4 объема эфира с одним объемом амилового спирта.
- Соляная кислота 0,1 н.
- Соляная кислота 6 н.
- Реактив Эрлиха: растворяют 1,2 г п-диметиламино-бензальдегида в 20 мл абсолютного спирта, затем добавляют 2 мл соляной кислоты 12 н. Используют свежеприготовленный реактив.
Техника. К 5 мл плазмы, мочи (в случае необходимости разбавляют дистиллированной водой) или к спинномозговой жидкости добавляют 3,2 г сульфата аммония (1), 1 мл едкого натра 0,5 н (2) и 40 мл смеси эфира с амиловым спиртом (3). Подвергают механическому перемешиванию в течение 30 минут в случае плазмы или 10 минут в случае мочи и спинномозговой жидкости.
20 мл органического экстракта переводят в разделительную воронку, добавляют 4 мл соляной кислоты 0,1 н (4), встряхивают в течение 5 минут и сливают кислый экстракт. К 3 мл кислого экстракта добавляют 0,5 мл соляной кислоты 6 н (5) и 1 мл реактива Эрлиха (6), затем погружают на 45 минут в кипящую водяную баню, охлаждают, объем дополняют до 4 мл соляной кислоты 0,1 н и отсчитывают затухание на фотометре Пульфриха с синим фильтром на 470 мх и кюветой на 5 мм, используя в качестве компенсирующей жидкости НС1 0,1 н.
Недавно Гребеник, применяя дифференциальное фотометрирование (селективные фильтры) реактивной системы, получил повышение селективности метода определения свободной ГИНК и ее метаболитов.
Метод Рубина
Принцип. Метод основан на реакции Кенига: гидразид фиксирует цианистый бром и дает продукт желтого цвета, яркость которого пропорциональна концентрации химиотерапевтического препарата в анализируемом образце.
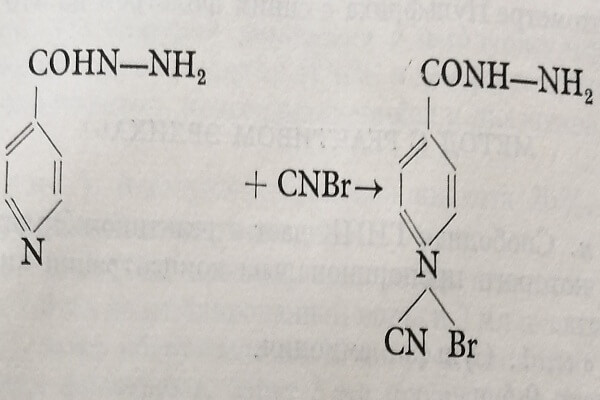
Реактивы.
- Вольфрамат натрия 10%.
- Серная кислота 2/3 н.
- Перманганат калия 4%.
- Аскорбиновая кислота 1%.
- Двухкалиевый фосфат 0,2%.
- Буферный раствор: растворяют 87 г двухкалиевого фосфата и 107 г хлористого аммония в 500 мл дистиллированной воды, затем добавляют 6,7 мл аммиака и объем дополняют до 1 000 мл дистиллированной водой.
- 10% цианистого брома цианогена.
- Стандартный раствор ГИНК. Приготовляют серию стандартных растворов ГИНК, начиная с 1 (лг /мл до 20 (хг/мл, которые обрабатывают в тех же условиях, как и анализируемый образец и используют для построения калибровочной кривой на фотометре Пульфриха с синим фильтром на 470 мл и кюветой на 10 мм.
Техника. К 2 мг плазмы добавляют 16 мл дистиллированной воды, 1 мл 10% вольфрамата натрия (1) и 1 мл серной кислоты 2/3 н (2). Погружают на 20 минут в кипящую водяную баню, часто взбалтывая, главным образом в течение первых 5 минут. Быстро охлаждают, центрифугируют 5 минут при 2 000 об/мин. Берут 15 мл надосадочной жидкости, к которой добавляют по каплям раствор перманганата калия 4% (3) до получения устойчивой розовой окраски. Объем выпаривают до 5 мл на водяной бане, поддерживая розовую окраску посредством постепенного добавления перманганата. И наконец, розовый цвет удаляют добавлением необходимого объема аскорбиновой кислоты 1% (4) и выпаривают досуха. Осадок берут с 4 мл двухкалиевого фосфата 0,2% (5) и энергично встряхивают в течение нескольких минут, затем центрифугируют. Из прозрачной жидкости берут 3 мл и добавляют 2 мл буферного раствора (6) и 5 мл цианистого брома.
Окраску сравнивают с цветом стандартного раствора ГИНК, обработанного таким же образом и затем отсчитывают затухание на фотометре Пульфриха.
Примечания. Рекомендуется приготовить также слепой образец из 2 мл дистиллированной воды, 2 мл буферного раствора и 2 мл цианистого брома 10%. Методы определения ГИНК в гуморальных жидкостях основываются либо на восстановительных свойствах гидразиновой цепи (Шорт, Гребеник, Келли и Поэт), либо на цветной реакции изоникотинового ядра (Рубин и сотрудники). Несмотря на то, что методы первой категории менее сложны и связаны с меньшей затратой времени, они менее специфичны, вследствие чего интерпретация результатов затруднена. Действительно, реакция Эрлиха устанавливает также присутствие других веществ, находящихся в нормальных условиях в гуморальных жидкостях организма, (например, уробилин, уробилиноген и др.), или в гуморальных жидкостях организма, леченного ПАСК, сульфонами и другими препаратами.
Метод Рубина, в основе которого лежит присутствие изоникотинового ядра, является специфическим и дает более точные результаты. Однако, с помощью этого метода можно определить только общую ГИНК (свободная ГИНК + метаболиты).
Метод с ванилином, после предварительной экстракции
Для повышения чувствительности и специфичности метода определения свободной ГИНК (активной в отношении туберкулеза), предложена предварительная экстракция ГИНК из сыворотки, спинномозговой жидкости или мочи, с последующим проведением цветной реакции на экстрагирующей жидкости. Для экстракции используют либо смесь хлороформа с бензойной кислотой, либо смесь изоамилового спирта и дихлорэтана.
На основе этих соображений можно применить упрощенный способ, использующий – после предварительной экстракции изоамиловым спиртом и дихлоретаном – цветную реакцию, которую 4-окси-З-метокси- бензадьдегид (ванилин) дает со свободной ГИНК.
Реактив приготовляют, растворяя 4-окси-З-метокси-бензаль- дегида в 25 мл абсолютного этилового спирта.
Экстракцию производят, используя в качестве растворителя смесь, состоящую из трех объемов изоамилового спирта и 7 объемов дихлорэтана. До смешивания эти растворители следует подвергнуть очистке. Для этого 2 части изоамилового спирта последовательно встряхивают (в разделительной воронке) с одной частью НС1 2 н, одной частью NaOH 2 н и два раза двумя частями бидистиллированной воды; в последующем, для обезвоживания обрабатывают 50 г/литр безводного сульфата натрия (или аммония) и 2 г/литр активированного животного угля. Перед употреблением фильтруют. Дихлорэтан обрабатывают только безводным сульфатом и животным углем (в одинаковых соотношениях).
Для экстракции в флакон с притертой пробкой на 50 мл берут 3 мл анализируемого продукта (плазмы, сыворотки, спинномозговой жидкости, разбавленной мочи) и 3,2 г безводного сульфата аммония, затем встряхивают и добавляют 40 мл растворяющей смеси, после чего встряхивают горизонтально (предпочтительно механически) в течение 30 минут.
Параллельно, таким же образом, приготовляют стандартный контрольный образец, используя вместо биологического продукта равное количеству (3 мл) свежеприготовленного водного раствора, содержащего 5 г ГИНК/мл.
После встряхивания обе смеси, обработанные растворителем центра, фугируют в течение 15 минут при 2000 об/мин. И наконец, из кислых слоев экстракта берут количества по 3 мл, используемые для определения свободной ГИНК (активной в отношении туберкулеза).
Определение: к каждым 3 мл кислого экстракта добавляют во 0,2 мл реактива с ванилином и фотометрируют (максимальная абсорбция при 365 мл) при сопоставлении с контрольным образцом с 3 мл дистиллированной воды и 0,2 мл реактива с ванилином.
Для получения результатов в случае если а – затухание образца и б–затухание стандартного контрольного образца, то X 5 – концентрация в (хг активной ГИНК на мл анализируемого продукта.
Тест Мочи с ванадатом
В 1052 г. Волленберг показал, что в кислой среде в присутствии ванадата аммония, ГИНК дает при нагревании цветную коричнево-красную реакцию. В 1960 г. Пэунеску и Бузеску изменили состав реактива с ванадатом и описали способ, допускающий идентификацию свободной ГИНК (активной в отношении туберкулеза) в моче, без нагревания реактивной смеси и разбавления продукта. Окраску, появляющуюся при добавлении реактива в мочу, содержащую свободную ГИНК, дает клещевидный комплекс, образующийся в кислой среде, между ионом ванадия и ГИНК. Если кислотность среды нейтрализуется, комплекс ванадия расщепляется и окраска исчезает. Аналогичный процесс происходит в случае применения видоизмененного Пэунеску реактива для определения ГИНК в моче. Реактив обладает пониженной кислотностью (уксусная кислота), легко образующей буфер с мочевыми солями, благодаря чему, по истечении продолжительного отрезка времени с момента образования комплекса, реактив разлагается и окраска исчезает. На этом процессе основана особая специфичность теста, предложенного Пэунеску и Бузеску 3 так как, если в течение последующих 10–15 минут яркость коричнево-красноватой окраски (появившейся в моче после добавления реакива с ванадатом) видимо сокращается, то можно быть уверенным в том, что образовался комплекс ванадия и ГИНК, (отделившийся в результате тампонирования кислотности среды) и следовательно очевидно, что испытуемая моча содержит свободную ГИНК.
С другой стороны, то обстоятельство, что реактив с ванадатом выявляет только наличие свободной ГИНК (активной с туберкулостатической точки зрения) обусловливает возможность применения этого теста для определения эффективности назначаемых доз ГИНК. Для этой цели, для испытания пользуются мочой отфильтрованной в течение точно определенного периода, так как между концентрацией ГИНК в крови и его количеством, отфильтрованным почками, существует прямо пропорциональное соотношению. Кроме того, для оценки эффективной дозы ГИНК исследуемый субъект должен быть подвергнут определенным ограничениям в отношении объема выпиваемых жидкостей, так как большое количество жидкости увеличивает почечное выведение ГИНК и искажает получаемые результаты.
Приготовление реактива с ванадатом (формула Пэунеску). В мерную колбу на 1 литр берут 500 мл дистиллированной воды и 20 г сульфата аммония; взбалтывают до растворения, затем добавляют 1 г метаванадата натрия (NaVOg) и взбалтывают до растворения; после этого добавляют 40 мл ледяной уксусной кислоты и 10 мл концентрированной серной кислоты (уд. вес = 1,84), доводя до 1 литра дистиллированной водой.
Реактив сохраняют в коричневой бутылке с притертой пробкой, при комнатной температуре.
Проведение реакции. В 2 пробирки одинакового диаметра берут по 2 мл мочи. В одну из пробирок тотчас же добавляют 2 мл реактива с ванадатом; во вторую пробирку также берут 2 мл реактива, но лишь по истечении 10 минут с момента проведения первой реакции.
Если свободная ГИНК присутствует в моче в достаточной концентрации (10–20 мг/мл мочи), то непосредственно после добавления реактива появляется коричнево-красноватая окраска, видимая невооруженным глазом, яркость которой тем больше, чем значительней концентрация химиотерапевтического препарата.
Со временем яркость слабеет; таким образом, по истечении 10 минут с момента проведения первой реакции, при осуществлении реакции во второй пробирке и немедленном сравнении получаемогоцвета с цветом первого образца, можно заметить, что второй образец характеризуется более яркой окраской.
В этом случае, результат теста является определенно положительным, так как в этих условиях специфичность реакции не вызывает никаких сомнений.
Тест мочи с ванадатом можно применять как для контроля приема ГИНК (имеющего значение при химиопрофилактических работах и химиотерапии туберкулеза на дому), так и для установления эффективной индивидуальной дозы ГИНК (в зависимости от метаболического типа «инактиватора» для ГИНК, неодинакового для каждого отдельного субъекта). На практике эти два теста осуществляются следующим образом:
а) контроль приема ГИНК; – по истечении 2–4 часов с момента, когда субъект утверждает, что он принял обычную дозу ГИНК, его заставляют мочиться и на этой моче производят тест с ванадатом (результат должен быть положительным).
Если результат отрицательный, то это значит, что пациент не принимал ГИНК (вопреки его утверждению), либо он является « быстрым инактиватором» (назначенная доза ГИНК не является эффективной). В этом последнем случае, в присутствии врача ему дают прописанную дозу ГИНК и затем, согласно ниже описанному способу производят испытание эффективности этой дозы.
Определение эффективной индивидуальной дозы ГИНК: больному утром дают 1/3 суточной дозы ГИНК с чаем или с молоком; затем в последующие 5–6 часов ему не дают пить более 100–200 мл жидкости.
По истечение 4 часов с момента приема ГИНК больной мочится и мочу выбрасывают. В течение промежутка времени между 4 и 5 1/2 часами, он не должен больше мочиться. По истечении 5 1/2 часов мочу собирают. Эта моча представляет собой образец I. Затем собирают мочу между 5 1/2 и 7 часами, причем эта последняя является образцом II.
На этих двух образцах мочи производится тест с ванадатом. Если оба образца дают положительный результат, то это означает, что в крови больного достигается эффективная антибациллярная доза ГИНК (следовательно назначенное количество ГИНК достаточно).
Если последний или оба образца оказываются отрицательными, то это свидетельствует о том, что приписанная доза недостаточна (больной является «быстрым инактиватором»). В этом случае на следующий день тест с ванадатом повторяется в одинаковых условиях, причем больному прописывается большее количество ГИНК, допускающее положительность обоих образцов.
В случае когда ГИНК дают в два приема в сутки, образец мочи следует брать между 7–9 и 9–11 часами, с момента приема туберкулостатического препарата.
Стрептомицин
Определение в крови
Принцип. Мальтол, получаемый при гидролизе стрептомицина в щелочной среде, дает с реактивом Фолен-Чокылтеу синюю окраску, которую можно колориметрировать.
Реактивы:
- Вольфрамат натрия 10%.
- Едкий натр 4%.
- Реактив Фолен-Чиокылтэу. Реактив должен иметь не зеленоватый, а желтый оттенок. Сохраняется в сухом и темном месте.
- Стандартные растворы дигидрострептомицина. Приготовляют серию стандартных растворов, начиная с 1 мг/мл до 50 мг/мл дигидрострептомицина, обрабатываемых в тех же условиях как и анализируемый образец и затем используют для построения калибровочной кривой на фотометре Пульфриха, с желтым фильтром на 756 мл и кюветой на 10 мм.
Техника. К 1 мл сыворотки или спинномозговой жидкости добавляют 9 мл вольфрамата натрия 10% (1), слегка встряхивают, оставляют в покое на 5 минут, затем фильтруют или центрифугируют. Из прозрачного фильтрата берут 1 мл (0,1 мл исходного продукта) и разбавляют 4 мл или 9 мл дистиллированной воды, в зависимости от концентрации стрептомицина, затем добавляют 0,2 мл едкого натра 4% (2) и 1 каплю реактива Фолен-Чиокылтэу. По истечении 5 минут цвет образца сравнивают с цветом стандартного раствора ближайшей концентрации, или отсчитывают затухание на фотометре Пульфриха.
Примечание. Окраска остается желтой или зеленоватожелтой в отсутствии стрептомицина или при концентрации менее 1 мг/мл.
Реактив Фолен-Чиокылтэу дает синюю окраску (в щелочной среде) со всеми органическими веществами, содержащими феноловое ядро. Большинство этих веществ можно удалить предварительным осаждением вольфраматом. Однако, чтобы удалить все побочные компоненты, рекомендуется экстрагирование стрептомицина хлороформом.
Вместе с тем, рекомендуется приготовить параллельный слепой образец.
Определение в моче
Принцип. В результате обработки ацетил-ацетоном метилглукозамин переходит из молекулы стрептомицина в пироловые производные, дающие с реактивом Эрлиха красный цвет.
Реактивы.
- Ацетилацетон 2%.
- Едкий натр 10%.
- Этиловый спирт 95°.
- Раствор п-диметиламинобензальдегида. Растворяют 0,8 г вещества в 30 мл спирта 95° и 30 мл концентрированной соляной кислоты.
- Стандартные растворы дигидрострептомицина. Приготовляют серию стандартных растворов, начиная с 30 fir/мл до 500 fxr/мл дигидрострептомицина, которые обрабатывают в одинаковых условиях, как и анализируемый образец и используют для построения калибровочной кривой на фотометре Пульфриха с зеленым фильтром на 530 мл с кюветой на 10 мм.
Техника. К1 мл мочи добавляют 1 мл ацетилацетона 2% и 2 капли едкого натра 10% (2), затем нагревают в течение 10 минут в кипящей водяной бане. При охлаждении добавляют 2 мл спирта 95° (3), затем красный цвет сопоставляют с цветом стандартного раствора ближайшей концентрации или отсчитывают затухание на фотометре Пульфриха.
Примечание. Во избежание погрешностей вследствие присутствия производных индола в моче, производные дающие ту же окраску с реактивом Эрлиха, параллельно проводят другое определение мочи, обработанной одинаковым образом, минус ацетилацетон.
Для получения более четкой окраски рекомендуется предварительно осадить мочу реактивом Куртона, удаляя избыток свинца сульфатом натрия. Этот метод не является достаточно чувствительным, в связи с чем, для определения малых концентраций, рекомендуется применение бактериологического метода.