Определение липидных веществ
В широком смысле этого слова липиды считаются веществами, содержащими в своей молекуле одну или несколько жирных кислот. Основной характеристикой этих веществ является их различная растворимость в определенных органических растворителях, – свойство, лежащее в основе их разделения и очистки. В биологических препаратах однако существуют и другие вещества, которые, не являясь липидами, отличаются общей с этими последними растворимостью. Так, например, углеводороды с большим молекулярным весом (например, каротеноидные карбиды), спирты стеролы и др. увлекаются органическими растворителями вместе с липидами. Подобные смеси, получаемые при эстрагировании органическими растворителями называются липоидными веществами – термин, не соответствующий какому-либо химическому определению, а указывающий лишь на наличие ряда общих физико-химических свойств.
Вместе с тем, этот термин подчеркивает то, что с помощью обычно применяемых методов, основанных на растворимости соединений, из биологических продуктов невозможно получить совершенно очищенные липидные вещества.
Анализ липидных веществ, присутствующих в том или ином биологическом препарате, состоит из трех операций: а) экстрагирование липидов; б) фракционирование и в) химический анализ фракционированных липидов.
Экстрагирование липидов
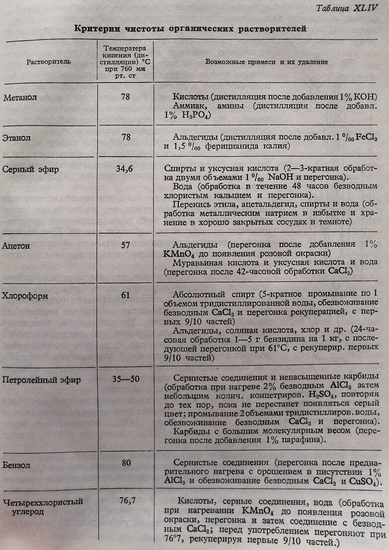
Экстрагирование липидов, присутствующих в каком-либо биологическом препарате, производят с помощью хорошо очищенных органических растворителей (эфиров, спиртов, бензола, хлороформа и др.) (таблица XLIV). Если подвергаемый экстракции препарат не жидкий, необходимо предварительно его тщательно растереть в порошок, чтобы таким образом обеспечить быстрое растворение липидов. Для измельчения, наряду с простейшим методом растирания в ступке в присутствии кварцевого песка, рекомендуется использование специальных приборов: растирателя Латапи, Уоринг-Блендора, атомизора и др. После растирания рекомендуется обезвоживание препарата, что препятствует растворению липидных элементов. Не следует предпочитать термическое обезвоживание, так как это может привести к разрушению компонентов препарата. Следует отдавать предпочтение замораживанию продуктов с последующей возгонкой льда в вакууме при низких температурах. Если имеются условия, допускающие проведение подобного обезвоживания, препарат может быть обработан в холодном состоянии спиртом и ацетоном; однако необходимо, чтобы использованные для обезвоживания вещества не выбрасывались, а служили бы для рекуперирования небольших количеств растворенных ими липидов.
После растирания и дегидратирования, биологический препарат может быть подвергнут липидной экстракции. Экстракционный агент следует выбирать весьма тщательно, так как он должен удовлетворять двум условиям: быть хорошим растворителем и в то же время способствовать отделениюлипидов из макромолекулярных соединений (глюцидо-протидо-липидных). Форма, в которой большинство липидов находится в биологических продуктах. Неполярные экстракционные агенты (серный эфир, петролейный эфир) являются отличными растворителями, однако они не способствуют отделению липидов из макромолекулярных соединений. Полярные растворители и, главным образом спирты весьма эффективно обеспечивают это отделение, особенно в случае, если эта операция производится при нагревании.
Растворяющие свойства полярных растворителей однако значительно более низкие. На практике рекомендуется работать с несколькими экстракционными агентами (либо одновременно, либо последовательно), таким образом чтобы разрушающее действие на соединения ряда веществ (например, горячий спирт) дополнялось растворяющим действием других агентов (эфир, хлороформ, бензол).
Общие липиды могут быть извлечены из того или иного биологического препарата различными методами, используя для этой цели различные экстракционные агенты в виде разных смесей. При выборе растворителей весьма важно учитывать необходимость полного отделения липидов, присутствующих в изучаемом препарате.
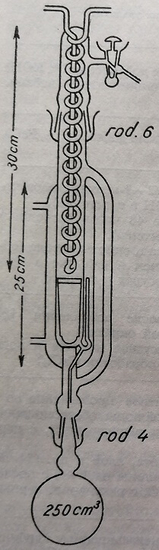
Наиболее действенные методы экстрагирования липидов связаны с применением аппаратов типа Сокслет (Кумагава), обеспечивающих непрерывную экстракцию при нагревании липидных веществ из исследуемого препарата. Во избежание окисления веществ во время экстракции рекомендуется способ экстрагирования в вакууме, для чего используется аппарат Сокслета, измененный для вакуума (рис. 56).
Рис. 56. Аппарат типа Сокслета, измененный для вакуума (постоянный экстрактор для жиров).
При выборе экстракционных агентов следует учитывать как их характеристики, так и свойства растворимости основных липидов.
Наиболее часто применяемыми экстракционными агентами являются: этанол (температура дистилляции 78°С), серный эфир (34°С), петролейный эфир (35– 50°С), ацетон (57°С), хлороформ (61°С), бензол (80°С) и др.
В отношении характеристики растворимости основных липидов, эти последние могут быть разделены на несколько больших групп. Следует, однако, отметить, что в рамках этих групп существуют различные степени растворимости, что связано, в первую очередь, с природой жирных кислот, принимающих участие в составе молекулы. В основном, чем больше молекулярный вес составной жирной кислоты или чем больше количество двойных связей и разветвлений, тем меньше растворимость молекулы в спирте.
Жирные кислоты хорошо растворяются в петролейном эфире, бензоле, хлороформе, серном эфире; они растворимы в ацетоне, мало растворимы в спирте, нерастворимы в воде (щелочные мыла растворимы в воде).
Нейтральные жиры (глицериды и стериды) хорошо растворимы в бензоле, хлороформе, петролейном спирте, растворимы в ацетоне и горячем спирте и весьма мало растворимы в холодном спирте; нерастворимы в воде.
Цериды характеризуются растворимостью, аналогичной растворимости глицеридов и стеридов, но весьма мало растворимы в холодном ацетоне и хорошо растворимы в ацетоне при кипячении.
Фосфатиды (фосфолипиды) в основном нерастворимы в ацетоне и растворимы в эфире, в присутствии небольших количеств воды.
Для приготовления бактериальных фосфатидов (туберкулезная палочка) Такаяши применяет стандартизованный способ. Анализируемый продукт (микробные тела) обезвоживают троекратно холодной обработкой ацетоном в течение трех недель. Ацетон сливают и затем высушивают в вакууме. Получаемый порошок взвешивают, причем на каждый 10 г порошка добавляют по 100 мл ацетона для анализа; смесь выдерживают в течение трех часов при 40–45°С, непрерывно взбалтывая (магнитный смеситель). Ацетон сливают, после чего экстракцию повторяют в аналогичных условиях. После слива второй порции ацетона, высушивают в вакууме и затем порошок берут с метанолом для анализа (по 100 мл метанола на каждые 10 г исходного порошка), после чего приступают к аналогичной экстракции (3 часа при 40–45°С, при непрерывном перемешивании). Метаноловую экстракцию повторяют дважды, затем экстракты соединяют, фильтруют через фильтр Зейца ЕК и концентрируют (в вакууме или в атмосфере азота) до окончательного – в 5 раз меньшего объема. К этому концентрату добавляют 3 объема ацетона, образовавшийся осадок центрифугируют и берут с хлороформом. После повторного центрифугирования растворенное в хлороформе вещество снова осаждают 3 объемами ацетона. Затем осадок снова берут с хлороформом, с последующим повторным центрифугированием и осаждением ацетоном. Получаемый в результате осадок высушивают в вакууме, а получаемый белый (слегка желтоватый) порошок содержит фосфатидную фракцию высокой чистоты (Р=1,8– 2,0%; N=0,05–0,2%).
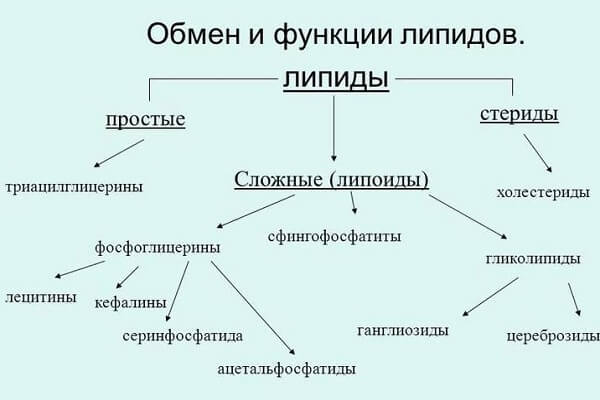
Следует однако отметить, что термин «фосфатиды» включает значительную группу фосфорных липидов: лецитины (фосфатидилхолины), фосфатидные кислоты, цефалины (фосфатидилэтаноламины), фосфатидил- серины, фосфатидиллизины, ацеталфосфатиды, глюцидофосфатиды, сфин-гомиэлины (сфингофосфатиды). Их дифференцирование можно производить по характеристикам растворимости. Так, например:
а) Свободные фосфатидные кислоты растворяются в ацетоне, хлороформе, эфире и спирте; не растворяются в воде. В виде солей натрия и калия они не растворяются в ацетоне, но растворяются в воде, бензоле хлороформе и эфире.
Соли бария и кальция растворяются только в бензоле, хлороформе и эфире.
б) Лецитины хорошо растворяются в бензоле, хлороформе и петролейном эфире. Не растворяются в ацетоне и воде.
в) Цефалины отличаются характеристикой, аналогичной лецитинам, лишь с тем различием, что мало растворимы и в алкоголе.
г) Инозито- и глюцидофосфатиды не растворяются в спирте, эмульгируются в воде и растворяются в петролейном эфире, бензоле и хлороформе.
д) Сфингомиэлины не растворяются в эфире, даже при нагревании; эмульгируются в воде; растворяются в пиридине, уксусной кислоте, хлороформе й мало растворимы в спирте.
е) Цереброзиды растворяются в пиридине, бензоле и уксусной кислоте.
В зависимости от приведенных характеристик растворимости разных липидов, эти вещества можно сгруппировать в три класса:
- Липиды, растворяющиеся в ацетоне: глицериды и стериды (нейтральные жиры), а также цериды, жирные кислоты и липоидные вещества.
- Липиды, нерастворяющиеся в ацетоне и растворяющиеся в эфире: все фосфатиды, за исключением сфинголипидов.
- Липиды, не растворяющиеся в эфире: сфинголипиды (сфингомиэлины и цереброзиды).
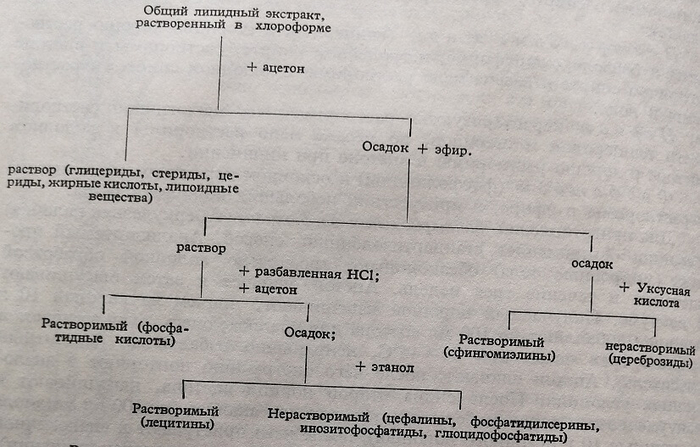
Основываясь на этих общих характеристиках растворимости, Фор предлагает схему фракционирования общего липидного экстракта, приводимую на рис. 57.
Фракционирование липидов
Общий липидный экстракт (рис. 57) растворяют в хлороформе и добавляют 2,5 объемов ацетона, осаждают фосфатиды и цереброзиды. Осадок очищают повторным растворением в хлороформе и осаждением ацетоном, к которому добавляют небольшое количество хлористого магния. Затем из осадка путем экстрагирования теплым ацетоном (30–35°С) отделяют цериды. Остаток осадка обрабатывают несколько раз эфиром, растворяющим фосфатиды, причем в нерастворимой форме остаются только сфинго-липиды: цереброзиды и сфингомиэлины. Эти последние разделяют между собой обработкой осадка ледяной уксусной кислотой, растворяющей сфингомиэлины.
Рис. 57. Схема операций фракционирования общего липидного экстракта
Растворимые в эфире фосфатиды обрабатывают ацетоном, подкисленным НС1 1 %–операция, в результате которой в растворе остаются фосфатидные кислоты. Осадок, обрабатываемый спиртом, приводит лецитины в растворимое состояние. Цефалины, фосфатидилсерины, инозитофосфатиды и глюцидофосфатиды, оставшиеся в конечном осадке, растворяют в хлороформе и отделяют фракционированным осаждением спиртом учитывая что их растворимость в спирте снижается в порядке их перечисления.
Растворимые в ацетоне липиды (1-ая обработка хлороформного раствора) содержат: глицериды (моно-, ди- и триглицериды), стериды, цериды, свободные жирные кислоты и липоидные вещества (карбиды, спирты, кетоны и др.). Фракционирование этих различных классов липидов довольно затруднительно вследствие их весьма сходной растворимости.
Жирные кислоты отделяют растворением липидов в серном эфире и взбалтыванием растворов с разбавленным карбонатом натрия. Таким образом, так как образующиеся щелочные соли жирных кислот являются водорастворимыми, переходя в водную фазу смеси, они могут быть собраны с помощью разделительной воронки. Весьма важно, чтобы раствор карбоната натрия, которым обрабатывают липиды, был как можно более разбавленным, для того, чтобы препятствовать по мере возможности гидролизу других липидов.
Другие вещества (например, холестерол), можно отделить непосредственно из смеси, используя различные вещества, обеспечивающие их эффективное осаждение (дигитонозид).
В настоящее время наиболее точным способом полного фракционирования смеси ацетонорастворимых липидов является хроматографический метод. Благодаря ему можно не только отделить глицериды от стеридов, жирных кислот, стеролов и карбидов, но и фракционировать в рамках одной и той же группы эти соединения.
Химический анализ фракционирования липидов
Как уже было указано выше, физические свойства и, главным образом характеристика растворимости, могут дать ряд весьма ценных указаний относительно природы того или иного липидного вещества. Однако, их более полная характеристика нуждается в уточнении ряда химических данных.
Все липиды содержат длинные цепи углерода, так что попытка охарактеризовать их определением С или Н не является достаточным критерием дифференцирования. Содержание Р, N и S дает более характерные сведения. Кроме того, указания, касающиеся природы жирных кислот, присутствующих в исследуемом продукте, могут также способствовать дифференцированию липидов. По этим причинам, наряду с содержанием Р и К, липидное вещество характеризуют с помощью ряда «коэффициентов» кислотности, омыления, йодного и ацетилового числа.
Определение N в том или ином липидном препарате осуществляют применяя метод микрокьельдаля.
Определение Р можно производить с помощью метода Бриггса.
Определение коэффициента свободной кислотности. Этот коэффициент выражают количеством мг КОН 0,05 н, необходимых для нейтрализации свободной кислотности одного грамма исследуемого липида. Для титрования количество g липида растворяют в 20 мл этанола, причем титруют в присутствие фенолфталеина 1% в качестве индикатора. Одновременно приготовляют контрольный образец (без липида). Если п – число мл гидрата, израсходованных для титрования образца, а п* – число мл гидрата, израсходованных для контрольного образца, то соотношение является коэффициентом свободной кислотности анализируемого липида.
Определение коэффициента омыления. Известное, точно отмеренное количество липида омыляют известным количеством титрованного щелочного раствора (гидролиз с орошением в течение 3–24 часов, при 100°С ). Жирные кислоты липида, отделившиеся в результате этого гидролиза, нейтрализуют часть лцелочи; избыток же титруют разбавленной кислотой. Разница между исходным количеством щелочи и ее титрованным количеством после смешения с препаратом является количеством щелочи, необходимым для омыления соответствующего образца. Эта величина пропорциональна количеству жирных кислот, присутствующему в анализируемом липиде и обратно пропорциональна его молекулярному весу.
Число омыления выражают количеством мг КОН 0,1 н необходимых для насыщения жирных кислот, присутствующих в 1 г анализируемого липида.
Определение йодного числа. Количество йода в г, фиксируемое в 100 ,г анализируемого липида, является его йодным числом.
Таким образом, получают ряд ценных данных относительно ненасыщенных связей, присутствующих в анализируемом веществе.
Точным методом определения йодного числа является микрометод Роземунд-Кунгена, измененный Ясуда. Этот метод применяет в качестве реактива галогенирования дибромпиридин (для приготовления реактива смешивают 4,1 мл пиридина для анализа; 2,7 мл концентрированной H2S04 для анализа; 1,24 мл брома для анализа и ледяную уксусную кислоту для анализа до 1 литра). Определенное количество g определяемого вещества (10–20 мг) растворяют в хлороформе (или уксусной кислоте) и добавляют 10 мл реактива.
Реактивный сосуд герметически закрывают (притертой пробкой) и оставляют на 30 минут в темноте. Добавляют 2 мл раствора йодистого калия 2%. Затем титруют тиосульфатом 0,05 н в присутствии крахмала 1 % до исчезновения синей окраски. Принимаем п – число израсходованных мл тиосульфата. Одновременно приготовляют контрольный образец, содержащий вместо определяемого вещества, равное количество известной ненасыщенной жирной кислоты (олеиновая кислота). Предположим, что п' – число мл тиосульфата, израсходованных в данном случае.
Йодное число подсчитывают по известной формуле.
Определение ацетилового числа. Большинство липидных веществ содержит свободные гидроксильные или аминовые группы, являющиеся следствием присутствия в молекуле глицерола, гидроксилированных жирных кислот, азотных оснований, трехалоза, инозитола, озов и т. д. Эти группы могут связать ацетиловый радикал. Йодное число является именно количеством уксусной кислоты в мг, которая может связать 1 г анализируемого липидного вещества.
Ацетиловое число можно определить дозируя число омыления какого- либо липидного вещества до и после обработки уксусным ангидридом. Для того чтобы не повлиять на кислотность препарата в результате добавления уксусного ангидрида, избыток этого вещества удаляют перегонкой при 175°С в присутствии кислот (как уксусный ангидрид, так и ксилол дистиллируют при 135–138°С).
Если S значение числа омыления до ацетиллирования, a S* значение после обработки уксусным ангидридом, то разница S–S* = а – представляет собой количество КОН, нейтрализующееся уксусной кислотой, фиксируемой 1 г анализируемого вещества. Учитывая, что 56 г КОН нейтрализуют 60 г уксусной кислоты, умножая значение а с оотношением =1,071 получаем значение А, отражающее правильно установленное ацетиловое число: количество уксусной кислоты, фиксируемое 1 г анализируемого липида.