Определение небелковых азотсодержащих веществ крови
Определение остаточного азота видоизмененным методом Аселя
Для определения остаточного азота видоизмененным методом Аселя необходимо следующее оснащение рабочего места:
- Штативы для пробирок и пипеток.
- Центрифужные пробирки.
- Микропипетки.
- Пипетки, градуированные на 1, 2, 5 и 10 мл.
- Мерные колбочки на 50 и 100 мл.
- Воронки.
- Стеклянные палочки.
- Фильтры.
- Колбы Кьельдаля.
- Капельницы.
- Центрифуга.
- Песочная баня.
- Колориметр Дюбоска или фотоэлектроколориметр (ФЭК-М).
- Сернокислый аммоний [(NH4)2S04].
- Двуйодистая ртуть (HgJ2).
- Трихлоруксусная кислота.
- Едкий натр.
- Йодистый калий.
- Концентрированная серная кислота.
- Пергидроль.
- Дистиллированная вода.
Для исследования используется сыворотка или плазма крови.
В основу метода положен следующий принцип: в процессе минерализации фильтрата крови с серной кислотой выделяющийся азот образует сернокислый аммоний, дающий с реактивом Несслера цветную реакцию. Количество образовавшегося сернокислого аммония соответствует содержанию азота в фильтрате крови. В связи с этим содержание остаточного азота в крови определяют по количеству образовавшегося сернокислого аммония колориметрическим способом.
Для этого метода необходимы следующие реактивы:
- Стандартный раствор сернокислого аммония: на аналитических весах в стеклянном бюксе взвешивают 0,4716 г (NH4)2S04 И растворяют его небольшим количеством дистиллированной воды. Растворенный сернокислый аммоний из бюкса количественно переводят в мерную колбу на 100 мл (полученный раствор через воронку сливают в колбу на 100 мл, несколько раз смывают бокс дистиллированной водой из промывалки и выливают в колбу), затем доливают дистиллированой водой до метки. Приготовленный реактив содержит 1 мг азота в 1 мл раствора. В темной посуде он может храниться в течение 4 месяцев.
- Рабочий раствор сернокислого аммония — готовят путем разведения стандартного раствора в 20 раз. Раствор содержит 0,05 мг азота в 1 мл.
- 25% раствор трихлоруксусной кислоты: 25 г трихлоруксусиой кислоты растворяют в колбе, переводят в цилиндр на 100 мл и доводят дистиллированной водой до метки.
- Концентрированная серная кислота.
- Реактив Несслера: в ступку помещают 5 г йодис¬того калия и 5—6 мл воды и растирают до растворения смеси; прибавляют 10 г двуйодистой ртути, растирают до растворения реактива. Получают желтый прозрачный раствор, который переводят (осторожно!) в 100 мл мерную колбу н доливают до половины объема водой.
Отдельно растворяют 20 г NaOH и после остывания раствор выливают в ту же колбу. Доливают до метки водой. В течение нескольких дней осаждается избыток ртутных солей, над осадком остается прозрачная светло-желтая жидкость. Ее осторожно сливают в темную склянку с корковой пробкой. Пробку парафинируют. Реактив хранят в темном месте.
Техника определения
В штатив устанавливают четыре пронумерованные центрифужные пробирки. В две из них (опытные) наливают по 1,4 мл. а в две другие (контрольные) — по 1,6 мл дистиллированной воды.
У больного микропипеткой набирают кровь в количестве 0.2 мл и помещают в первую пробирку. Такое же количество крови помещают во вторую пробирку. Содержимое пробирок смешивают (можно в тех же количествах использовать сыворотку или плазму кропи).
Во все четыре пробирки добавляют по 0.4 мл 25% раствора трихлоруксусной кислоты (для осаждения белков крови), тщательно размешивают содержимое первых двух пробирок стеклянной палочкой и оставляют на 30 минут при комнатной температуре. Затем во все пробирки добавляют по 2 мл воды, перемешивают их содержимое и оставляют еще на 10 минут. По истечении этого времени две сухие пробирки маркируют и в каждую из них фильтруют содержимое первых двух опытных пробирок.
Подготовив четыре колбы Кьельдаля, их нумеруют и в первые две наливают по 2 мл фильтрата из опытных пробирок, а в две другие — по 2 мл жидкости, взятой из центрифужных пробирок, предназначенных для контроля.
Во все четыре колбы Кьельдаля приливают по 0.1 мл концентрированной H2SO4 и ставят их в наклонном положении на песочную баню, находящуюся на нагревательном приборе. Сжигание проводят в вытяжном шкафу до полного обесцвечивания жидкости (если нет вытяжного шкафа, в отверстия колб вставляют неплотные пробки из увлажненной водой ваты с целью улавливания выделяющегося сернистого ангидрида). Для ускорения процесса сжигания в момент обугливания содержимого колбы снимают с песчаной бани, охлаждают, добавляют в них по 1-2 капли пергидроля (являющегося катализатором) и вновь ставят на песок до обесцвечивания проб.
Когда содержимое колб обесцветится, их снимают с бани и в опытные колбы приливают по 7 мл дистиллированной воды и по 3 мл реактива Несслера, а в контрольные — по 1 мл рабочего стандартного раствора (NH4)2S04, по 6 мл дистиллированной воды и по 3 мл реактива Несслера. Содержимое всех колб приобретает желтый цвет и должно быть прозрачным.
Определение остаточного азота в подготовленных таким образом пробах проводят в колориметре Дюбоска.
Пример расчета: N=0.05х10х1000/(15х0.1)=33,6 мг%,
где 0,05 — содержание азота в миллиграммах на 1 мл рабочего стандартного раствора; 10 — толщина слоя жидкости в контрольной пробе; 15 — толщина слоя жидкости в опытной пробе, 0,1 мл — количество крови, взятой в опыт, в миллилитрах; 100 — коэффициент перевода в проценты. При определении остаточного азота на фотоэлектроколориметре во все четыре колбы Кьельдаля (после того как была проведена минерализация) приливают по 7 мл воды и по 3 мл реактива Несслера. Содержимое контрольных и опытных колб колориметрируют против воды в кюветах с расстоянием рабочих граней 20 мм, при нейтральном светофильтре на левом барабане.
Из среднего арифметического экстинкций, полученных при колориметрировании опытных проб, вычитают среднее арифметическое из полученных при колориметрировании экстинкций контроля. Результат определяют по калибровочной кривой.
Определение остаточного азота крови в чашках Конвея
Для определения остаточного азота в чашках Конвея необходимо следующее оснащение рабочего места:
- Штативы для пробирок и пипеток.
- Микропипетки.
- Пипетки, градуированные на 1, 2 и 5 мл.
- Центрифужные пробирки.
- Колбы Кьельдаля.
- Песочная баня.
- Чашки Конвея.
- Микробюретка.
- Едкий натр.
- Концентрированная серная кислота.
- 96° этиловый спирт.
- Метиловый красный.
- Метиленовая синька.
- Пергидроль.
- Вазелин.
Сущность определения остаточного азота этим методом та же, что и при определении видоизмененным методом Аселя.
Для этого метода необходимы следующие реактивы:
- Индикаторная смесь Ташира. Для приготовления этой смеси вначале готовят основной раствор: к 40 мл 0,1% спиртового раствора метилового красного приливают 10 мл 0,1% спиртового раствора метиленовой синьки. Из основного раствора готовят рабочий: к 1 объему основного раствора прибавляют 1 объем спирта и 2 объема воды (смесь Ташира). Индикаторная смесь Ташира в кислой среде дает вишнево-красный цвет, а в щелочной — зеленый.
- 22% раствор трихлоруксусной кислоты: 22 г трихлоруксусной кислоты (CCI3COOH) растворяют водой в мерной колбе на 100 мл и доводят до метки.
- 5 N раствор H2SO4: 33,2 мл концентрированной серной кислоты приливают в воду, налитую в колбу на 250 мл, и доводят дистиллированной водой до метки.
- 0,01 N раствор H2SO4 : 26,63 мл концентрированной серной кислоты приливают в воду, налитую в колбу на 1 л, и доводят дистиллированной водой до метки.
- 40% раствор NaOH: 40 г химически чистого едкого натра растворяют в небольшом объеме дистиллированной воды в толстостенной колбе, переводят по охлаждении в цилиндр емкостью 100 мл и доливают водой до метки. Раствор хранят в толстостенной склянке, парафинированной внутри.
- 0,01 N раствор NaOH — готовят из 0,1 N раствора NaOH путем разведения его в 10 раз.
Техника определения
В штатив устанавливают две центрифужные пробирки и наливают в них по 2,8 мл воды. В каждую пробирку вносят по 0,2 мл крови, взятой микропипеткой, и добавляют по 1 мл 22% раствора трихлоруксусной кислоты для осаждения белков крови.
Пробирки оставляют на 10 минут, после чего центрифугируют в течение 10—15 минут. Берут четыре колбы Кьельдаля и в первую из них наливают 2 мл фильтрата, полученного в результате центрифугирования первой пробирки, во вторую — 2 мл фильтрата из второй пробирки и добавляют в каждую из них по 0,5 мл 5 N раствора H2S04. В третью и четвертую колбы (контрольные) наливают по 1,5 мл воды, по 0,5 мл 22% трихлоруксусной кислоты и 0,5 мл 5N раствора H2S04. Содержимое всех колб подвергают такой же минерализации, как и при методе Аселя.
После сжигания содержимое каждой колбы очень тщательно переносят во внешнюю часть чашки Конвея, а затем каждую колбу ополаскивают 8 раз 0,5 мл дистиллированной воды, каждый раз выливая содержимое ее во внешнюю часть чашки Конвея (рис. 88).
Рис. 88. Чашка Конвея.
Во внутреннюю часть чашек Конвея помещают 0,01 N раствор H2SO4 в количестве 2 мл, а в наружную пх часть быстро наливают по 3 мл 40%. раствора NaOH. Надо, чтобы раствор, перенесенный из колбы Кьельдаля во внешнюю часть Конвея, и 3 мл 40% раствора NaOH не смешивались (их можно соединять осторожным движением после того, как чашка будет закрыта), и немедленно притирают к поверхности чашек крышки, смазанные вазелином.
Получив в результате притирания крышки герметически замкнутое пространство, чашки оставляют на сутки при комнатной температуре. В этих условиях во внешней части чашек при взаимодействии испытуемого раствора и 40% раствора NaOH происходит выделение аммиака. 0,01 N раствор серной кислоты, помещенный заранее в среднюю часть чашек Конвея, поглощает выделяющийся аммиак. Через сутки крышки чашек снимают, к содержимому чашек, находящемуся в них средней части, добавляют 1-2 капли индикатора Ташира и титруют 0,01 N раствором NaOH, титрование заканчивают в момент появления зеленого окрашивания. Затем производят расчет.
Пример расчета.
х = (А — В) X 0,14 X 100,
где А — количество 0,01 N раствора NaOH, пошедшее на титрование контрольной пробы, в миллилитрах; В — количество 0,01 N раствора NaOH, пошедшее на титрование опытной пробы, в миллилитрах; 0,14 — количество азота, эквивалентное 1 мл 0,01 N раствора NaOH; 100 — коэффициент пересчета на 100 мл крови.
Результаты определения оформляют в бланке анализа. Остаточный азот в нормальной крови составляет 20-40 мг%.
Определение мочевины в крови по методу Бородина в модификации Коварского
Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Штативы.
- Градуированные пробирки.
- Градуированные пипетки на 5 и 10 мл.
- Капельницы.
- Аппарат Коварского.
- Сернокислый калий (K2SO4).
- Хлористый натрий.
- Трихлоруксусная кислота.
- Едкий натр.
- Концентрированная соляная кислота.
- Бром.
Для исследования необходима сыворотка крови.
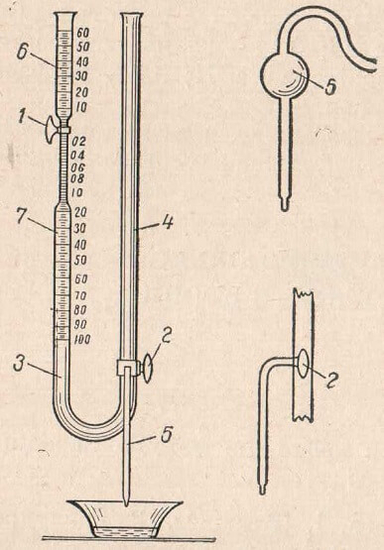
Метод основан на окислении мочевины бромистой щелочыо, в результате чего образуется азот, объем которого измеряют в аппарате Коварского (рис. 89).
Аппарат Коварского представляет собой U-образную стеклянную трубку, оба колена которой снабжены стеклянными кранами. Кран верхней трети левого колена позволяет разобщать верхнюю часть трубки от остальной ее части. Часть над краном градуирована и служит для отмеривания исследуемой жидкости и приливаемых реактивов. Трубка под краном также градуирована и служит для измерения объема газа. Часть ее непосредственно под краном значительно сужена и градуирована на 0,02 мл. Кран в нижней части бюретки трехходовой. При его повороте получаются три установки: 1) правое и левое колена сообщаются, причем жидкость из отводной трубки правого колена не вытекает; 2) колена разобщены, жидкость из правого колена вытекает; 3) колена разобщены, жидкость из правого колена не вытекает. На кране обычно имеется метка, позволяющая контролировать установку.
Рис. 89. Аппарат Коварского. 1 — двухходовой кран верхний левый; 2 — трехходовой кран нижний правый; 3 — левое колено аппарата; 4 — правое колено аппарата; 5 — отводная трубка; в — воронка; 7 — замкнутая градуированная часть пробирки.
Подготовка аппарата Коварского к исследованию
Перед тем как начать исследование, обе части прибора заполняют солевым раствором. С этой целью открывают кран левого колена, а трехходовой кран устанавливают в первом положении. Солевой раствор (состав его указан ниже) наливают в правое колено прибора до тех пор, пока он не появится в верхней части левого колена. В этот момент левый кран закрывают, солевой раствор из трубки над краном отсасывают пипеткой, трубку высушивают фильтровальной бумагой. Трехходовому крану придают второе положение (колена разобщены) и спускают солевой раствор из правого колена больше чем наполовину. Переводят трехходовой кран в первое положение (колена сообщаются). Для определения мочевины необходимы следующие реактивы:
- Солевой раствор: в мерную колбу на 1 л помещают 150 г сернокислого калия (K2SO4), 350 г хлористого натрия (NaCl) и доливают дистиллированную воду до метки. После растворения солей содержимое колбы кипятят несколько минут. Раствор охлаждают и фильтруют.
- 10% раствор трихлоруксусной кислоты: 10 г трихлоруксусной кислоты в 100 мл дистиллированной воды.
- 33% раствор едкого натра: 33 г химически чистого едкого натра растворяют в 60-70 мл дистиллированной воды, охлаждают, переливают в цилиндр на 100 мл и доводят водой до метки.
- Бромистая щелочь: к 10 мл 33% раствора NaOH прибавляют (в вытяжном шкафу) 20 капель чистого брома, затем, не вынимая, пробирки из вытяжного шкафа, смешивают NaOH с бромом, переливая из пробирки в пробирку. Бромистую щелочь готовят перед исследованием.
Техника определения
В градуированную центрифужную пробирку наливают 4 мл оксалатной крови или сыворотки и приливают такое же количество 10% трихлоруксусной кислоты. Содержимое пробирки фильтруют, 2,5 мл фильтрата наливают в левое колено прибора и, придав рукоятке верхнего крана горизонтальное положение, вливают фильтрат в нижнюю часть бюретки, после чего кран вновь закрывают. В верхнюю трубку вливают 0,5 мл дистиллированной воды, которую тоже спускают в бюретку. Закрыв верхний кран, в верхнюю трубку вливают бромистую щелочь и спускают несколько кубических сантиметров в нижнюю часть. Кран тщательно закрывают. Тотчас начинается процесс расщепления мочевины и образуется газообразный азот, который вытесняет часть солевого раствора из левого колена в правое, в результате чего уровень его в правом колене повышается. Важно, чтобы он не превышал возможного уровня жидкости в правом колене; в противном случае надо часть жидкости вновь спустить (второе положение крана).
При добавлении бромистой щелочи образуется газообразный азот, который скапливается в суженном участке нижней части бюретки. Слегка поколачивая пальцем по стенке бюретки, отделяют пузырьки газа, скапливающиеся у стенок прибора. Бромистую щелочь добавляют до тех пор, пока не перестанут образовываться новые пузырьки газа. Выжидают 10 минут, пока прекратится образование пузырьков и газ примет температуру окружающего воздуха. Отметив объем газа в левом колене, измеряют температуру в свободном правом колене и записывают показания барометра.
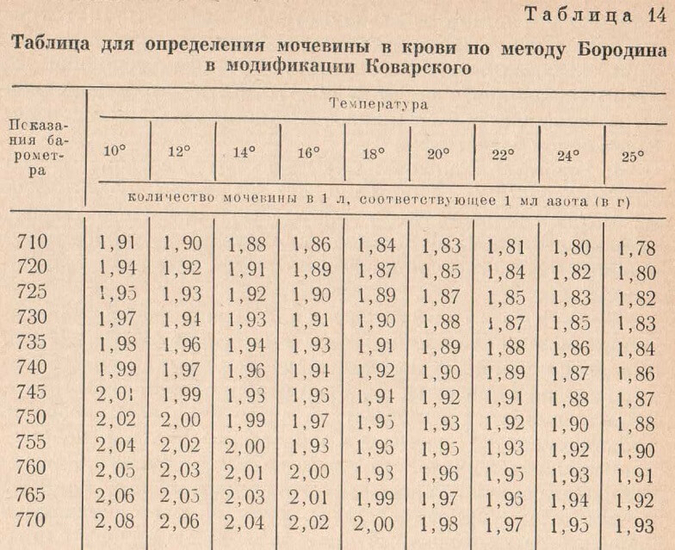
Полученные результаты рассчитывают, пользуясь для этого табл. 14 (таблица перевода объема азота в весовые единицы-граммы — с учетом температуры и барометрического давления).
Нужную цифру находят на пересечении цифр, соответствующих температуре и барометрическому давлению в день опыта.
Найденный объем азота множат на число, установленное по таблице. Произведение указывает количество граммов мочевины в 1 л крови. Ответ выражают в миллиграмм-процентах.
Результаты оформляют в бланке анализа. Мочевина в нормальной крови составляет 20-35 мг%.
Определение индикана в крови по методу Розенберга
Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Штативы.
- Мерные и простые центрифужные пробирки.
- Градуированные пипетки на 2 и 5 мл.
- Капельницы.
- Воронки.
- Фильтровальная бумага.
- Центрифуга.
- Трихлоруксусная кислота.
- Тимол.
- Хлороформ.
- Этиловый спирт 96°.
- Хлорное железо (FeCb).
Для исследования необходима сыворотка крови.
Сущность метода заключается в том, что из индоксила и тимола в присутствии соляной кислоты, содержащей хлорное железо, образуется индиготин, обладающий резко выраженной синей окраской. Интенсивность окраски зависит от содержания индикана.
Для проведения этого метода необходимы следующие реактивы:
- 20% раствор трихлоруксусной кислоты.
- 5% спиртовой раствор тимола: 5 г тимола растворяют этиловым спиртом в эрленмейеровской колбочке, переводят в цилиндр емкостью 100 мл, приливают 96° этилового спирта до метки.
- Раствор Обермейера: 0,5 мл насыщенного раствора хлорного железа приливают к 125 мл концентрированной соляной кислоты, тщательно перемешивают, приливают 0,25 мл хлороформа и взбалтывают.
Реактив следует хранить в посуде, закрытой притертой пробкой, и использовать не раньше чем через 12-24 часа после приготовления.
Техника определения
В штатив устанавливают одну обычную и одну градуированную центрифужные пробирки, нумеруют их и в первую (обычную) центрифужную пробирку наливают 1,5 мл исследуемой сыворотки и 1,5 мл 20% раствора трихлоруксусной кислоты. Смесь оставляют при комнатной температуре на 10-15 минут для полного осаждения белков.
Во вторую (градуированную) центрифужную пробирку вставляют воронку с бумажным фильтром, предварительно промытым горячей дистиллированной водой, и фильтруют через него содержимое первой пробирки.
Отметив полученный объем фильтрата, к нему добавляют 7 капель 5% спиртового раствора тимола и реактив Обермейера в таком же количестве, сколько было фильтрата до добавления к нему тимолового спирта, после чего оставляют пробирку на 20 минут при комнатной температуре.
После отстаивания смеси к ней добавляют 2 мл хлороформа, тщательно смешивают его с содержимым пробирки и оставляют на сутки. Через сутки содержимое пробирки взбалтывают и по интенсивности окраски хлороформа учитывают результат. Если хлороформ имеет едва заметное фиолетовое окрашивание, значит количество индикана в исследуемой пробирке равно 0,022 мг%.
При более интенсивной окраске в пробирку добавляют хлороформ до получения очень слабого фиолетового окрашивания. Количество дополнительно затраченного хлороформа записывают и производят расчет.
Допустим, что было добавлено 10 мл хлороформа. В этом случае прежде всего рассчитывают, во сколько раз был разведен окрашенный хлороформ. Так как сначала в пробирку добавляют 2 мл хлороформа (это величина постоянная), то для определения, во сколько раз он был разведен, нужно 10 разделить на 2: 10/2= 5. Затем
0,022 мг% умножают на разведение. Отсюда количество индикана будет равно: 0,022X5=0,11 мг%.
Индикан в нормальной крови составляет 0,26-0,80 мг%.