Определение сульфгидрильных групп методом амперометрического титрования
Структурными элементами белковых молекул как известно, являются аминокислоты, связанные между собой при помощи пептидных связей. Наличие в белках цистеина обусловливает присутствие в них серы в виде свободных SH и связанных S–S групп. Количество свободных сульфгидрильных групп в молекуле белка является характерным для данного белка. Увеличение их может зависеть от воздействия каких-то денатурирующих агентов.
Каталитические свойства многих ферментов связаны с наличием в их молекуле свободных сульфгидрильных групп. К числу таких ферментов принадлежат: (З-амилаза, карбоксилаза, холинэстераза, сукциндегидраза и др. Сульфгидрильные группы являются активным началом коэнзима А, участвующего во многих процессах межуточного обмена.
Тиоловые ферменты утрачивают каталитическую активность при связывании (блокировании) их сульфгидрильных групп. Блокирование SH-групп наступает при воздействии на тиоловые соединения ионизирующих излучений, солей тяжелых металлов (Pb, Hg, Ag, Cd, Zn и т. д.) и других факторов.
Определение содержания сульфгидрильных групп белков, а также глютатиона и свободного цистеина в сыворотке крови является чувствительным методом при изучении влияния различных вредных факторов как у людей, так и у экспериментальных животных.
Из приведенных ниже методов значительно более точным является амперометрический метод определения сульфгидрильных групп.
Принцип метода
Метод является одним из видов- электрометрического объемного анализа. Для титрования сульфгидрильных групп применяют растворы азотнокислого серебра или хлорной ртути, образующие с ними меркаптосоединения. Конец титрования определяют по возникновению диффузионного тока, свидетельствующего о появлении в растворе свободных ионов Ag или: Hg.
Количество сульфгидрильных групп порядка 0,2 мг в 100 мл может быть определено этим методом с точностью до 1–2%, большие количества (2 мг на 100 мл) – с точностью до 0,3%.
Аппаратура
- Вращающийся платиновый электрод А (индикаторный) (рис. 5). Отрезок платиновой проволоки (В) длиной 6–8 мм и диаметром 0,5 мм впаивают в стеклянную трубку диаметром 6 мм. Трубку заполняют небольшим количеством чистой металлической ртути (/). Стеклянную трубку укрепляют в латунной (#), смонтированной на подшипниках й связанной через передачу -с мотором. Верхний конец стальной проволоки (С), погруженной в ртуть, соединяют с гальванометром. Необходимо применять мотор с постоянным числом оборотов в минуту от 100 до 1000. Для титрования растворов пригоден мотор с числом оборотов в минуту от 100 до 200 (типа патефонного, с редуктором), для титрования гомогенатов необходим мотор с большим числом оборотов в минуту – 500-1000.
- Электрод сравнения В с потенциалом 0,23 V по отношению к каломельному электроду. Готовят следующим образом. В колбу емкостью 100–150 мл, с отводной трубкой (см. схему) впаивают отрезок платиновой проволоки {Ei). В отводную трубку и колбу наливают небольшое количество чистой металлической ртути. В колбу над ртутью наливают раствор электролития. Верхний конец отрезка стальной проволоки, погружённого в ртуть отводной трубки, также соединяют с гальванометром (g).
- Электролитический мостик (D), посредством которого осуществляется электрический контакт между двумя электродами. Мостиком служит стеклянная трубка длиной около 60 см и внутренним диаметром 6 мм, заполненная 3% агаровым гелем на 30% растворе хлористого калия. Трубка имеет два изгиба под прямыми углами. Один конец ее опускают в колбу электрода сравнения, а другой – в сосуд с титруемым раствором (вместе с платиновым электродом). Мостики можно хранить длительное время в сосудах с насыщенным раствором хлористого калия.
- Гальванометр с ценой деления 10–7 – 10~9 А (наиболее подходящими являются гальванометры М-91, М-91 А и М-95 А, выпускаемые Красногвардейским заводом в Ленинграде). Для определения количества SH- групп порядка 30–50 ц. в 100 мл (например, в цельной сыворотке) пригоден портативный гальванометр ГЭП-47.
- Стеклянный гомогенизатор.
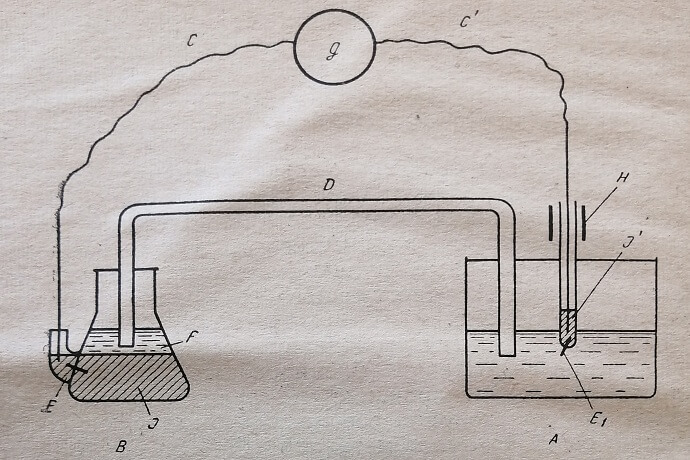
Рис. 5. Схема установки для амперометрического титрования
Посуда
- Микробюретка емкостью 1–2 мл.
- Стакан для реакционной смеси (емкостью 100–250 мл).
- Пипетки на 1 мл с делениями.
- Мерный цилиндр на 25 мл.
- Мерные колбы на 100 мл.
Реактивы
- Металлическая ртуть для заполнения электродов. Предварительно ртуть очищают путем фильтрования через бумажный фильтр. Затем промывают сначала смесью разбавленной азотной кислоты с 5%, раствором Hg2 (N03)2, а затем водой до полного удаления азотной кислоты и тщательно просушивают фильтровальной бумагой. Высушенную ртуть снова фильтруют через бумажные фильтры с многочисленными отверстиями, сделанными обычной иглой.
- Раствор электролита для электрода сравнения. Растворяют 4,2 г йодистого калия и 1,3 г йодистой ртути в 100 мл насыщенного раствора хлористого калия.
- Насыщенный раствор хлористого калия для приготовления раствора электролита для электрода сравнения и хранения электролитических мостиков (при 20° в 100 мл воды растворяют 25,5 г КС1, при 100° – 36 г.).
- 0,001 М раствор азотнокислого серебра. Готовят из основного 0,1 М раствора, для приготовления которого в 1 л воды растворяют 16,98 г азотнокислого серебра Титр 0,1 М раствора AgN03 устанавливают по стандартному 0,1 М раствору хлористого натрия.
- 0,001 М раствор хлорной ртути. Растворяют в 1 л воды 0,2715 г HgCl2.
- Буферные растворы. При титровании раствором азотнокислого серебра наиболее часто применяют аммиачный буфер с рН = 10–11, содержащий 0,25 М раствор аммиака (17 мл аммиака удельного веса 0,9 на 1 л воды) и 0,01 М раствор азотнокислого аммония (0,8 г на 1 л воды). Для титрования белковых SH-групп применяют аммиачный буфер более слабой концентрации с pH = 9,2, который содержит 0,03 М раствор аммиака (2,04 мл на 1 л воды) и 0,03 М раствор азотнокислого аммония (2,4 г на 1 л воды) или трис-буфер: 0,02 М раствор трисгидроксиметиламинометана [NH2C (GH2OH) 3] с pH = 7,4. Для приготовления такого раствора растворяют 2,42 г NH2C(CH20H)3 в 1 л воды.
При титровании раствором хлорной ртути используют 0,9% раствор хлористого натрия с pH = 7,0 или трис-буфер. Помимо указанных, можно применять и другие буферные растворы. - 30% раствор хлористого калия.
- 3% агаровый гель, приготовленный на 30% растворе хлористого калия.
- 5% раствор азотнокислой ртути Hg2(N03).
- Йодистый калий химически чистый в порошке.
- Йодистая ртуть химически чистая в порошке.
- Азотная кислота.
- 0,01% раствор сапонина (для гемолиза).
- 2,5 и 25% растворы сульфосалициловой кислоты (для осаждения белков).
Ход анализа
Подготовка материала
а) Для определения SH-групп низкомолекулярных соединений в крови 1 объем крови смешивают с 8 объемами 0,01% раствора сапонина и быстро осаждают 1 объемом 25% раствора сульфосалициловой кислоты. Полный гемолиз освобождает глютатион из эритроцитов Осадок быстро центрифугируют и фильтруют. Клетки соединений тканей животных ткани, подлежащие исследованию, быстро взвешивают на торзионных весах. Кусочки ткани при 0° гомогенизируют в стеклянном гомогенизаторе с 10 частями 2,5% раствора сульфосалициловой кислоты. Полученные осадки центрифугируют и фильтруют.
в) При определении SH-групп белков (сыворотка, растворимые белки тканей) растворы белка предварительно диализируют против соответствующего буферного раствора при +2–4°. Параллельно проводят определение количества белка или азота посредством методов Лоури или Кьельдаля. Расчет производят на 1 г (1 мг) белка или на 1 г азота.
Титрование
В стакан для титрования пипеткой отмеряют определенный объем испытуемого раствора (0,1–1,0) и доливают соответствующим буферным раствором до 20 мл. В стакан погружают платиновый электрод и один конец солевого мостика. Цепь замыкают погружением другого конца мостика в колбу электрода сравнения. Над стаканом с реакционной смесью устанавливают кран микробюретки. Включают мотор, приводящий в движение платиновый электрод, и отмечают показание гальванометра (отсчет производят от 0 или другого показания гальванометра, принятого за 0). Далее показания гальванометра отмечают по истечении 1 минуты после каждого прибавления к реакционной смеси 0,05 мл 0,001 М раствора азотнокислого серебра или хлорной ртути.
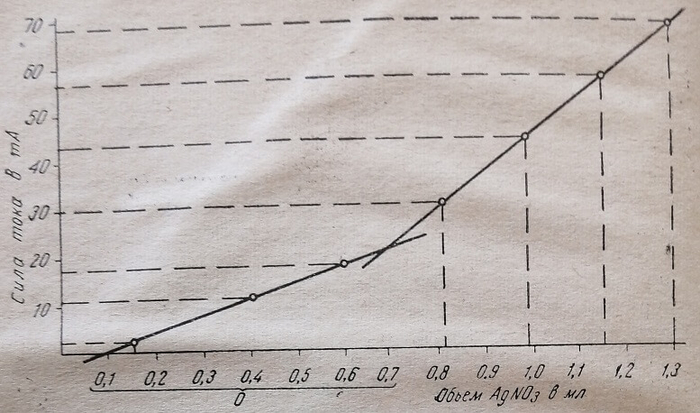
В начале титрования, когда происходит реакция между SH-группами и серебром (или ртутью), наблюдается отсутствие или небольшое изменение силы тока (отсутствие или небольшое отклонение стрелки гальванометра). Когда "все SH-группы полностью прореагируют, изменение силы тока будет зависеть от свободных ионов серебра (или ртути) в растворе. Далее, величина силы тока будет повышаться пропорционально концентрации этих ионов в растворе. Изменение силы тока по отношению к объему прибавляемого раствора азотнокислого серебра или хлорной ртути изображают графически (рис. 6).
На миллиметровой бумаге чертят оси координат. По оси ординат откладывают показания гальванометра (силу тока в миллиамперах), по оси абсцисс – объемы.
Рис. 6. Графическое изображение результатов титрования.
Титрование производят до тех пор, пока ряд последних точек (5–6) будет находиться на одной прямой. Вторую прямую проводят, через ряд начальных точек. Из точки пересечения этих двух прямых опускают перпендикуляр на ось абсцисс. Отрезок по оси абсцисс, заключенный в фигурную скобку, соответствует искомой величине объема азотнокислого серебра (или хлорной ртути), израсходованного на титрование.
Результаты могут быть выражены в процентах SH-групп цистеина или в микромолях SH на 100 мл сыворотки и на 1 г азота. После каждого титрования платиновый электрод, стакан и конец мостика, опускаемого в стакан для титрования, несколько раз тщательно споласкивают дистиллированной водой.
Периодически платиновый электрод промывают горячей азотной кислотой с последующим тщательным промыванием дистиллированной водой. Периодически следует проверять работу прибора, титруя точные растворы цистеина или глютатиона.При расчете в мг цистеина получаем 0,121 мгХ 0,055=0,006655 мг цистеина в 0,1 мл сыворотки. В 100 мл сыворотки содержится 6,65 мг цистеина.