Определение в крови глюкозы и других третичных веществ
Определение глюкозы
В собранной крови глюкоза распределена неравномерно и неодинаково между плазмой и эритроцитами. По этой причине определение гликемии должно проводиться по цельной крови. С наибольшей точностью гликемию можно определить с помощью ферментационного метода, но эта техника отличается высокой точностью и большой трудоемкостью. Среди микрометодов, предложенных для определения гликемии самым чувствительным является метод с антроном. Этот реактив образует с глюкозой специфически окрашенный комплекс. Остальные методы не дают возможности произвести специфическое определение глюкозы, а только отражают ее восстановительную способность. Поэтому необходимо, чтобы остальные восстанавливающие вещества, помимо глюкозы (гликоген в эритроцитах, пировиноградная кислота, сложные гексозофосфорные эфиры, глютатион, аскорбиновая кислота, мочевая кислота, креатин, креатинин и др.) были предварительно удалены дефекацией крови перед определением.
Метод Хагедорн-Йенсен
Принцип. Метод основан на восстановлении при кипячении в щелочной среде феррицианида калия в ферроцианид, который осаждается в виде двойной цинково-калиевой соли согласно уравнению:
K4[Fe(CN)e] + 3ZnS04 = K2Zn3[Fe(CN)e]2 -f 3K2S04.
Феррицианид калия, в избыточном количестве, восстанавливается пропорционально количеству присутствующей в крови глюкозы (и других восстановительных веществ). Избыток феррицианида, затем, количественно восстанавливается йодистоводородной кислотой (практически йодид калия + уксусная кислота) в ферроцианид калия, выделяя известное количество свободного йода соответственно реакции:
2K3Fe(CN)e + 2К ^ 2K4Fe(CN)e +12.
Эта реакция обратима и становится количественной только при ocaждении феррицианида в виде двойной цинково-калиевой соли, как это было показано выше. Таким образом выделяемый йод затем титрует тиосульфатом натрия согласно реакции:
2Na2S203 -f-12 = 2NaI -f- N828403.
Реактивы:
- гидрат натрия 0,1 н.
- 45% кристаллизованный сульфат цинка для анализа (запасный раствор). Хранится в коричневых бутылках. Еженедельно приготовляется рабочий раствор: 0,45% сульфат цинка, разбавляя 1/100 запасный раствор.
- Феррицианид калия 0,005 и. Взвешивают 1,65 г феррицианида калия для анализа и 10,60 г чистого безводного карбоната натрия, который переводят в мерную колбу емкостью в 1000 мл, растворяют и дополняют до метки бидистиллированной водой. Растворы приготовляют за 2–3 дня перед употреблением и сохраняют в коричневой бутылке.
- Сульфат цинка-хлористый натрий. Растворяют 50 г чистого сульфата цинка и 250 г хлористого натрия для анализа и дополняют бидистиллированной водой до 800 мл, фильтруя в случае необходимости.
- 12,50 кристаллический йодид калия. Хранится в коричневой бутылке. При употреблении 4 части раствора (4) смешивают с одной частью раствора (5).
- 3% ледяная уксусная кислота.
- 1% крахмал. Растворяют 1 г растворимого крахмала (amylum solubile), слегка подогревая в нескольких мл воды и дополняют до 100 мл насыщенным раствором хлористого натрия.
- Тиосульфат натрия 0,005 н. Приготовляют в момент употребления, разбавляя 1/20 в мерной колбе на 100 мл раствора тиосульфата натрия 0,1 н. кипяченной бидистиллированной водой для удаления углекислоты. Раствор тиосульфата натрия 0,005 н. сохраняют на льду не более 2–3 дней, так как он быстро меняет свой титр.
- Йодат калия 0,005 н. Взвешивают 0,356 6 г чистого безводного йодата калия, переводят в мерную колбу на 2000 мл и дополняют до метки бидистиллированной водой.
Техника.
а) Дезальбуминирование. Приготовляют и нумерируют ряд пробирок 180/18, одинаковых по числу анализируемыми образцами, причем дополнительно берут еще одну пробирку для слепого контрольного образца, которую титруют так же как и остальные Пробирки для определения восстановительного действия реактивов.
В каждую пробирку наливают: 1 мл едкого натра 0,1 н. (J) и сульфата цинка 0,45% (2). Образуется коллоидный раствор гидрата служащий для дефекации цельной крови.
Взятие цельной крови можно производить предварительно в пробирку на фториде натрия (1 мг на каждый мг крови) посредством внутривенной пункции в локтевую складку или непосредственно с помощью микропипетки на 0,1 мл уколом в мякоть пальца или мочку уха.
После того, как микропипетка точно наполнилась 0,1 мл крови, ее тщательно вытирают кусочком ваты или марли от просочившейся крови, а содержимое выдувают в раствор гидрата цинка, после чего вся кровь со стенок микропипетки хорошо отмывается, всасывая и выдувая смесь 3–4 раза.
Все пробирки ставят на жестяной штатив и на 3 минуты помещают в водяную баню с кипящей водой. Тем временем на штатив ставят такое же количество широких пробирок типа Хагедорна, причем на каждой из них расположена небольшая воронка (диаметром 4–5 см) с фильтровальной бумагой того же диаметра. Фильтры несколько раз хорошо промываются горячей или дистиллированной водой, выбрасывая промывные воды. Для фильтрации, в случае отсутствия фильтровальной бумаги можно пользоваться также гидрофильной ватой. Эту последнюю однако следует дважды прокипятить в дистиллированной воде, меняя воду и выжимая вату для того, чтобы удалить следы восстановительных веществ. После сушки в каждую воронку кладут небольшой кусочек ваты для того, чтобы не затруднять фильтрацию.
По истечении трех минут, пробирки вынимают из водяной ванны, после чего содержание каждой фильтруют в соответствующую пробирку типа Хагедори для того, чтобы удалить белки и наибольшую часть восстановительных веществ. Фильтрат должен быть очень прозрачным. Пробирки для дезальбуминирования и фильтры дважды промываются 3 мл горячей бидистиллированной воды.
б) Восстановление феррицианида. Воронки удаляются, а в каждую пробирку добавляют точно по 2 мл феррицианида калия 0,005 н. (3). Слегка взбалтывают и затем пробирки ставят на 15 минут в водяную баню, которая должна все время кипеть для восстановления феррицианида глюкозой.
По истечении 15 минут пробирки вынимают и охлаждают под струей воды, затем в каждую пробирку наливают по 2 мл смеси реактивов (4) и (5), 2 мл 3% уксусной кислоты (6) и 2–3 капли 1°/0 крахмала (7).
в) Титрование. Все пробирки (включительно контрольную) титруют тиосульфатом натрия 0,005 н. (8) из 2 мл микробюретки (отградуированной 1/100), добавляя реактив по каплям и слегка взбалтывая до исчезновения синей окраски. Исчезновение окраски наблюдают на белом фоне.
Слепой образец должен для титрования израсходовать по меньшей мере 1,80 мл тиосульфата, иначе растворы не годятся или фильтр не был тщательно вымыт.
Расчет. Цифры полученные при титровании корректируют, умножая их на фактор F тиосульфата. В таблице XXVI находят эквивалент в мг глюкозы (100 мл израсходованного тиосульфата как для крови, так и для контрольного образца).
Из результата каждого определения вычитают значение полученное для контрольного образца.
Примечания. В условиях строгой чистоты и свежести реактивов метод Хагедорна дает весьма точный результат.
Рекомендуется, чтобы, как образцы, так и контрольный образец отитровывались повторно.
Колориметрический метод с антроном
Принцип. Глюкоза дает с антроном окрашенный специфический комплекс, затухание которого отсчитывается на фотометре пульфриха.
Реактивы.
1) 10% трихлоруксусная кислота.
2) Реактив антрон-тиомочевина в 66% серной кислоты (в объемах). В подходящую колбу вливают 340 мл дистиллированнои воды, затем внимательно добавляют 660 мл концентрированной кислоты для анализа (уд. вес = 1,84). Предпочтительно приготовить более значительный запас этой смеси. К 1000 мл 66% серной кислоты полученной как указано выше, добавляют 500 мг перекристаллизованного антрона и 10 г чистой тиомочевины и подогревают до 80–90°С, не превышая этой температуры.
От времени до времени взбалтывают до полного растворения, затем оставляют для осаждения и сохраняют в холодильнике в бурой бутылке. Реактив можно использовать только в течение двух недель.
3) Стандартный раствор глюкозы: растворяют 100 мг глюкозы для анализа, высушенной в эксикаторе в 100 мл 0,25% раствора бензойной кислоты (в мерной колбе).
4) Стандартная кривая строится следующим образом; в мерную колбу на 100 мл берут 20 мл стандартного раствора глюкозы и доводят до метки насыщенным раствором бензойной кислоты. 1 мл раствора содержит 0,2 мг глюкозы. Из этого раствора приготовляют ряд разбавлений, соответственно содержащих: 0,05; 0,75; 0,1; 0,125; 0,150; 0,175 и 0,2 мг глюкозы/мл. Берут по 1 мл из каждого разбавления, обрабатывают так же как и анализируемый образец и отсчитывают оптическую плотность на фотометре Пульфриха с кюветой в 1 см и фильтром на 620 MIX.
Техника. На 1 мл крови взятой на фтористом натрии добавляют 9 мл 10% трихлоруксусной кислоты (1), слегка встряхивают и фильтруют. Берут 2 пробирки, причем в первую вливают 1 мл прозрачного фильтрата (0,1 мл крови), а в другую, которая служит слепым образцом, 1 мл дистиллированной воды. В каждую пробирку добавляют по 10 мл реактива антрон (2), покрывают небольшой воронкой типа Хагедорна, затем помещают в баню с кипящей водой на 15 минут. Необходимо пользоваться металлической баней, а во время кипячения пробирки должны быть погружены в вложенную в баню вату, чтобы по мере возможности реакция происходила в темноте. Пробирки вынимают и кладут в сосуд с холодной водой в темноте. После охлаждения внешние стенки пробирок тщательно вытирают марлей, после чего пробирки выдерживают в темноте в течение 20–30 минут, затем отсчитывают затухание на фотометре Пульфриха. Значение затухания относится к стандартной кривой, причем результат получается в мг/100 мл. Стандартная кривая соблюдает закон Ламберт-Беера, т.е. она является линейной только до концентрации 0,2 мг глюкозы/мл.
Для более высоких концентраций (0,3–0,4 мг глюкозы/мл) получаются пониженные результаты с погрешностью в 3–8%. Следовательно, если образец содержит количество глюкозы превышающее 200 мг/100 мл, определение следует повторить, разбавляя фильтрат дистиллированной водой в соотношении 1/1, учитывая при подсчете степень разбавления и умножая полученный результат на 2 пг.
Примечание: Метод простой, чувствительный и быстрый, представляя больше преимуществ, чем метод Хагедорна.
Метод Фолен-Ву
Принцип. При нагревании в щелочной среде, глюкоза восстанавливает тартрат меди в окиси меди (1), которая в свою очередь восстанавливает фосфомолибдотунгстеновую кислоту, давая молибден синий. Поскольку интенсивность окраски пропорциональна количеству находящейся в образца глюкозы, сопоставление производят с окраской которую дает раствор глюкозы известного титра.
Реактивы.
1) Серная кислота 2/3 н.
2) 10% вольфрамат натрия (сохраняется только 2–3 недели).
3) Медь – натриевый реактив Фолен-Ву. Растворяют 40 г безводного карбоната натрия в 400 мл бидистиллированной воды, добавляют 7–5 г винной кислоты небольшими порциями, затем 4,5 г кристаллического сульфата меди, растворенного в 50 мл воды и затем объем дополняют до 1000 мл Раствор сохраняют в бурой бутылке и фильтруют, если со временем на дне образуется осадок.
4) Фосфо-молибдо-тунгстеновый реактив: в колбу Эрленмейера берут : 35 г молибденовой кислоты, 5 г вольфрамата натрия, 200 мл 10% гидрата натрия и 200 мл бидистиллированной воды. Энергично кипятят в течение 1 часа, охлаждают, объем доводят до 350 мл, добавляют 125 мл 85% фосфорной кислоты (полученной из 67 мл кристаллической расплавленной фосфорной кислоты, разбавленных до 125 мл). Дополняют до 500 мл. Раствор не портится.
5) Стандартный раствор глюкозы. Взвешивают 1 г безводной чистой глюкозы, высушенной при 105° и выдержанной в эксикаторе, затем переводят в мерную колбу на 100 мл и дополняют до метки 0,25% раствором бензойной кислоты: 1 мл = 10 мг глюкозы, раствор сохраняется не более 6 месяцев на льду, добавляя несколько капель толуола.
Из этого запасного раствора приготовляют при необходимости рабочий стандартный раствор, разбавляя запасный раствор 1/100. Рабочий стандарт содержит 0,1 мг глюкозы/мл.
Техника.
а) Дезальбуминирование. В пробирку берут 1 мл крови взятой на фториде натрия, 7 мл дистиллированной воды, 1 мл серной кислоты 2/3 н. (1), 1 мл 10% вольфрамата натрия (2) и слегка встряхивают. Спустя 15 минут фильтруют. Фильтрат должен быть прозрачным, а в случае опалесцентности, его помещают на 1 минуту в кипящу10 водяную баню и затем снова фильтруют.
б) Получение окраски. 2 мл фильтрата (0,2 мл крови) наливают в специальную трубку Фолена (рис. 25) (в отсутствие этих трубок можно пользоваться мерными колбами на 25 мл), добавляют 2 мл медь-натриевого раствора Фолен-Ву (3). Трубку Фолена помещвют в горячую водяную баню, спустя 6 минут вынимают и охлаждают под струей воды, затем быстро добавляют 2 мл фосфо-молибдо-тунгстенового реактива (4), растворяющего окись меди (1) и дающего темно-синюю окраску. Разбавляют водой до 25 мл (до имеющейся на трубке Фолена метки), затем хорошо смешивают.
Рис. 25. Трубка Фолена.
Одновременно с этими операциями приготовляют также контрольной образец с 2 мл стандартного рабочего раствора (0,2 мг глюкозы), который обрабатывают также как и анализируемый образец.
в) Отсчет производится на колориметре типа Дюбоска.
Примечания. Метод рекомендуется учитывая его относительно простое выполнение. Между имеющейся в наличии глюкозой и получаемой окраской не существует строгой пропорциональности. В случае гипергликемии, рекомендуется работать с 0,5 мл крови, умножая получаемый результат на 2.
До употребления необходимо проверить, не дает ли смесь из равных частей медь-натриевого раствора и фосфор-молибдо-тунгстенового реактива яркий синий цвет.
Кроме того целесообразно всегда проверять точность нулевой точки колориметра: одинаковый раствор, вводимый в обе кюветы колориметра должен дать одинаковые цифры.
Метод Крецелиус-Зейферта
Принцип метода основан на восстановлении пикриновой кислоты при нагревании в сильно щелочной среде, до краснобурой пикрамовой кислоты.
Реактивы.
1) Насыщенный раствор пикриновой кислоты (1,2%); раствор приготовляют с кипяченной дистиллированной водой, фильтруют после охлаждения и хранят в сосуде темного цвета.
2) 20% едкий натр.
Техника.
а) Дезальбуминирование. При помощи микропипетки, на конце которой надета резиновая трубка, из мякоти пальца отсасывают точно 0,2 мл крови и смешивают в пробирке с 1,8 мл дистиллированной воды.
Стенки микропипетки смываются путем всасывания и выдувания жидкости в пробирку 3–4 раза. Добавляют 1 мл насыщенного раствора пикриновой кислоты (1) и слегка взбалтывают.
Присутствующие в крови белки осаждаются и отделяются фильтрованием.
б) Получение окраски. К 1,5мл фильтрата добавляют 0,15 мл 20% раствора едкого натра. (2). Из этой щелочной жидкости наливают 1,5 мл в пробирку, которую затем кладут в кипящую водяную баню. Ровно через 5 минут пробирку вынимают из бани, быстро охлаждают струей воды, а раствор переводят в сосуд
аппарата Крецелиус-Зейферта (рис. 26) для колориметрирования, которое необходимо произвести в промежуток времени не превышающий 30 минут.

Рис. 26. Аппарат Крецелиус-Зейферта
Шкала прибора расчитана на 0,2 мл крови и при одинаковой окраске дает непосредственно концентрацию глюкозы в мг на 100 мл крови.
Примечания. В случае больших значений (свыше 400 мг/100 определение производят с 0,1 мл крови, которую смешивают с 1,9 дистиллированной воды, а подсчитанный результат умножают на 2.
Рекомендуется произведение слепого образца для того, чтобы проконтролировать чистоту реактивов и вычесть полученное значение из величины образца крови. Для этого в пробирку наливают 2 мл дистиллированной воды, 1 мл насыщенного раствора пикриновой кислоты (1) и 0,3 мл 20°/ раствора едкого натра (2). Затем эту смесь обрабатывают так же как и R случае крови. Результат отсчета не должен превышать значение 30 мг/100 иначе реактивы не годятся.
Метод не является очень точным и имеет только ориентировочное значение. Обычно он дает погрешности, которые могут превысить даже 10–20.
Причины погрешностей:
- Смесь не охлаждается тотчас же после кипячения.
- Пробирки не были чистыми или не были высушены спиртом или эфиром.
- Растворы не были чистыми.
- Смесь не кипятилась точно 5 минут.
- Отсчет произведен при слишком резком, слишком слабом свете или утомленными глазами.
- Кровь содержала ацетон, также восстанавливающий пикриновую кислоту; в этом случае до обработки 20 % раствором едкого натра, фильтрат кипятят на пламени для удаления ацетона. Кипячение производится в градуированной пробирке для того, чтобы точно замерить испарившееся количество смеси и затем дополнить дистиллированной водой.
Патофизиологические изменения. У здорового человека гликемия колеблется от 70 до 120 мг/100 мл, причем этот уровень поддерживается печенью в результате выделения глюкозы гликогенными резервами. Регулировочный механизм гликемии зависит от двух гормональных систем: поджелудочно-дуоденальная система, воздействующая главным образом на выделение инсулина (гипогликемирующий эффект) и мозго-гипофизо-адреналиновая система, выделяющая ряд гормонов отличающихся гипергликемирующим действием. И наконец, регулирование гликемии может осуществляться также нервным путем или с помощью почечного выделения (в случае патологических гликемий).
Если по различным причинам концентрация глюкозы в крови достигает 160–175 мг/100 мл, она превышает порог почечного выделения и начинает удаляться через почки.
Гликемия подвергается физиологическим изменениям в зависимости от питания (чрезмерная нагрузка глюцидами может привести к гипергликемии), а также от ряда внешних факторов: холод, волнения, мышечное усилие и др.
Гипергликемии в первую очередь встречаются при сахарном диабете (140– 300 мг/100 мл, в более легких формах, 300–500 мг /100 мл в тяжелых формах; при диабетической коме гипергликемия может достигнуть 600–800 мг/1 000 мл и даже более 1 200 сг/100 мл), затем при нефрите, некоторых формах гипертензии, вспрыскиваниях адреналина, удушьи, наркозе эфиром и хлороформом и др. Гипогликемии бывают при: желтой атрофии печени, гиперинсулинизме, гипертиреоидизме, истощении и др.
Тест толерантности к глюцидам: вызванная гипергликемия
Принцип. Тест основан на колебаниях гликемии в зависимости от глюцидного питания. Путем введения глюкозы перорально.
Техника. Больной утром натощак берет 1 г глюкозы/1 кг живого веса, растворенной в воде или чае. До дачи глюкозы собирают мочу и отбирают кровь для определения гликемии. Затем после дачи глюкозы – через каждые 30, 60, 90, 120 и 180 минут производится взятие крови. Во время взятия крови больной лежит в постели, не принимая жидкостей или какой-либо пищи.
В собранных таким образом образцах производится определение гликемии.
Обсуждение результатов. Результаты гликемии записывают на двух координатных осях, причем на абсциссе отсчитывают время в минутах, а на ординате – количество глюкозы в мг/100 мл. Соединяя полученные таким образом точки, получают кривую вызванной гипергликемии. Для обсуждения результатов следят за повышением кривой в зависимости от времени, а также за продолжительностью гипергликемии и характеристиками ее снижения.
У здорового человека (рис. 27) отмечается повышение гликемии в течение первых 30 или 60 минут, достигая 150 мг/100 мл, после чего глицемия постепенно снижается, достигая через 90 минут ее исходу значения, а через два часа снижения на 20% ниже нормального уровня. Это – поздняя гипогликемия, появляющаяся повидимому вследствие инсулиновой гиперсекреции, вызываемой исходной гипергликемией.
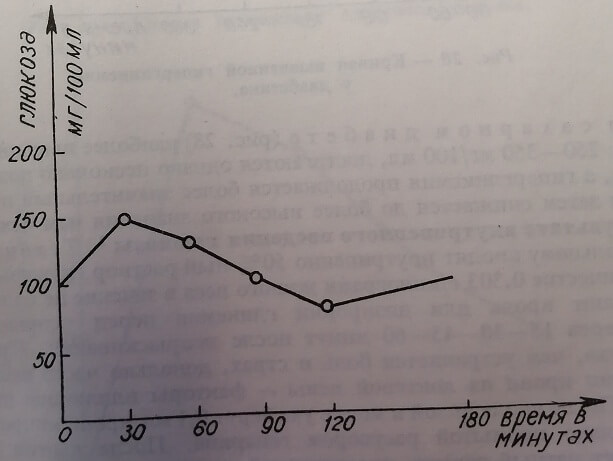
Рис. 27. Кривая вызванной гипергликемии у здорового человека.
При сахарном диабете (рис. 28) наиболее высокие значения гликемии: 250–350 мг/100 мл, достигаются однако несколько позже (спустя 1–2 часа), а гипергликемия продолжается более значительный промежуток времени и затем снижается до более высокого значения чем исходное.

Рис. 28. Кривая вызванной гипергликемии у диабетика.
В результате внутривенного введения глюкозы. Техника. Утром натощак больному вводят внутривенно 50 %-ный раствор глюкозы (стерильной) в количестве 0,303 г/килограмм живого веса в течение не более 2 минут.
Собирают кровь для дозировки гликемии перед вспрыскиванием, также через 15–30–45–60 минут после вспрыскивания. Кровь берут из мочки уха, чем устраняется боль и страх, довольно часто наблюдаемые после взятия крови из локтевой вены – факторы влияющие на уровень гликемии. После укола иглой в мочке уха берут 0,1 мл крови микропипеткой, предварительно промытой раствором гепарина. После взятия крови на ранку кладут ватный тампон, пропитанный гепариновым раствором, благодаря чему впоследствии можно легко производить дальнейшие сборы крови. Затем определение гликемии производится по одному из вышеописанных методов.
Обсуждение результатов. У здорового человека гликемия достигает максимального значения (160 мг/100 мл), спустя 15 минут с момента введения глюкозы, а затем снижается, достигая по истечении 60 минут уровня более низкого по сравнению с исходным (рис. 29).

Рис. 29. Кривая гликемии у здорового человека.
У больного страдающего сахарной болезнью гликемия достигает максимального значения также через 15 минут, причем однако гипергликемия гораздо более значительная (360 мг/100 мл).

Рис. 30. Кривая гликемии у диабетика.
Пировиноградная кислота
Принцип. Пировиноградная кислота дает с салициловым альдегидом в сильно щелочной среде оранжевую окраску, которую можно колориметрировать.
Реактивы.
- Трихлоруксусная кислота 6%. Сохраняется на льду.
- Раствор едкого калия: к 100 г едкого калия добавляются 60 мл воды и осторожно смешивают. Если раствор дает осадок, то для реакции берут прозрачную надосадочную жидкость.
- Салициловый альдегид 2% в этиловом спирте 90°. Раствор устойчив в течение нескольких месяцев.
Техника. а) Дезальбуминирование. В центрифужную пробирку берут 3 мл свежей крови собранной на оксалате, добавляя 3 мл трихлоруксусной кислоты 6% (1), встряхивают и оставляют на 5 минут в покое, затем фильтруют или центрифугируют при высоких оборотах.
Получение окраски. К 1 мл (0,5 мл крови) бесцветного и прозрачного фильтрата добавляют 1 мл раствора едкого калия (2) и 0,5 мл салицилового альдегида (3). Хорошо взбалтывают и выдерживают в течение 10 минут при 37° в водяной бане. Раствор быстро охлаждают и затем делают отсчет оранжевой окраски на колориметре Дюбоска, пользуясь g качестве контрольного образца стандартным раствором пировиноградной кислоты или еще лучше пирувата натрия, содержащим 0,01 мг/мл пировиноградной кислоты. Отсчет можно производить также на фотометре Пульфриха применяя для этой цели синий фильтр на 470 м(х и кювету на 10 мм, строя стандартную кривую с помощью шкалы стандартного раствора пирувата натрия.
Примечание: Стандартный раствор неустойчив, поэтому его приготовляют перед употреблением.
Патофизиологические изменения. В нормальных условиях кровь содержит 0,50 – 1,20 мг пировиноградной кислоты/100 мл.
Количество пировиноградной кислоты увеличивается в крови в случае недостатка карбоксилазы, активная группа которой представлена витамином B1. Это увеличение может быть вызвано отсутствием витамина Вх в пище (эксогенный авитаминоз) или в случае чрезмерного потребления (эндогенный авитаминоз).
Молочная кислота
Колориметрический метод Менделя
Принцип. После дезальбуминирования метафосфорной кислотой глюциды отделяют осаждением сульфатом меди и окисью кальция. Оставшаяся в растворе молочная кислота обрабатывается серной кислотой и. превращается в уксусный альдегид, дающий с вератролом красную окраску, интенсивность которой пропорциональна количеству молочной кислоты присутствующей в анализируемом образце.
Реактивы.
- Метафосфорная кислота 5%. Приготовляется перед употреблением из кристаллической метафосфорной кислоты.
- Кристаллический сульфат меди, раствор 15%.
- Окись кальция, чистая.
- Концентрированная серная кислота, чистая.
- Вератрол, раствор 0,125% в абсолютном спирте.
Техника: а) Дезальбуминирование. К 1 мл плазмы, полученной из венозной крови, взятой на оксалате натрия (больной должен находиться в состоянии полного покоя в течение получаса перед взятием) добавляют 6 мл бидистиллированной воды. Потом капля по капле добавляют 1 мл метафосфорной кислоты 5% (1), слегка взбалтывая. Через несколько минут фильтруют.
в) Превращение молочной кислоты в уксусный альдегид. 0,5 мл надосадочной жикости вливают в чистую сухую пробирку и помещают в воду со льдом, после чего добавляют капля по капле 3 мл серной кислоты (4). Пробирку вынимают и продерживают точно 4 минуты в кипящей водяной бане, после чего снова охлаждают водой со льдом.
г) Колориметрическое определение. Через 2 минуты добавляют 0,1 мл раствора вератрола (5) и слегка взбалтывают. Оставляют на 20 минут до появления красной окраски, сопоставляемой затем в колориметре типа Дюбоска с окраской стандартного раствора лактата лития, высушенного до постоянного веса (1 мл содержит 0,01 мг молочной кислоты), из которого берут 0,5 мл и обрабатывают так же как и анализируемый образец.
Стандартный раствор лактата лития может быть использован также при построении стандартной кривой для фотометра Пульфриха, на котором отсчет проводится с помощью зеленого фильтра 530 мкг и кюветы на 10 мм.
Примечание. Метод менее чувствителен и рекомендуется при наличии значительных количеств молочной кислоты.
Држевская, установив, что осаждение глюцидов не увеличивает чувствительность метода, предлагает исключение этого этапа.
Волюметрический метод
Принцип. Молочная кислота окисляется перманганатом калия в присутствии серной кислоты в уксусный альдегид, углекислоту и воду согласно уравнению:
СН8 • СН (ОН) • СООН + О = СН3 • СНО + СОй + Н20
Уксусный альдегид собирают посредством дистилляции в избытке бисульфита натрия, и определяют количество бисульфита прореагировавшего с уксусным альдегидом.
Реактивы:
- Окись кальция, чистая.
- Сульфат меди, кристаллический, насыщенный раствор.
- Перманганат калия, насыщенный раствор.
- Концентрированная серная кислота, чистая.
- Серная кислота 2%.
- Бисульфит натрия 0,02 н.
- Перманганат калия 0,005 н.
- Йод 0,1 н.
- Крахмал 1%.
- Бикарбонат натрия чистый, раствор насыщенный в холодном состоянии. Приготовляют перед употреблением.
- Йод 0,005 н.
Техника: а) Дезальбуминирование и удаление глюкозы. В центрифужную пробирку на 50 мл берут 3 мл плазмы и 21 мл бидистиллированной воды, затем осторожно добавляют 2,1 г окиси кальция (1) и б мл насыщенного раствора сульфата меди (2). Оставляют в покое на 1 час, от времени до времени встряхивая, затем центрифугируют при большой скорости вращения (3500–4000 об/мин). Надосадочная жидкость должна быть позрачной и не содержать глюкозу (отрицательная проба на а- нафтол или протеины (отрицательная проба на три- хлоруксусную кислоту 10%).
б) Дистилляция уксусного альдегида. Перегоночный аппарат (рис. 31) состоит из стеклянной трубки 30 мм в диаметре и 20 см длины, закупоренной в верхней части резиновой пробкой с двумя отверстиями, через которую пропущены: вытянутая капиллярная трубка для поступления воздуха, трубка воронки для введения раствора перманганата калия, и наконец, стеклянная трубка для вывода паров в холодильник.
Из холодильника продукты конденсации проходят через вытянутую трубку с бисульфитом, а затем через вторую трубку с таким же содержанием. Вторая трубка соединена с водяной грушей или с вакуум- насосом.
До всасывания в аппарат воздух необходимо очистить от восстановительных паров, которые могут находиться в атмосфере лаборатории (главным образом ацетон). Для этого воздух пропускается через насыщенный раствор перманганата калия, к которому добавляют 5% концентрированной серной кислоты (4).
Для перегонки в реакционную трубку вливают 5 мл серной кислоты 2% (5) и 10 мл надосадочной жидкости (1 мл сыворотки). В каждую промывочную трубку вливают по 20 мл бисульфита натрия 0,02 н. (6). Вакуум-насос приводят в действие для обеспечения барботажа воздушной струи, затем постепенно выпускают из воронки в реакционную трубку небольшие количества перманганата калия 0,005 н. (7), регулируемые таким образом чтобы каждое добавление имело место только после полного обесцвечиваний раньше добавленного количества.

Рис. 31. Аппарат для дистилляции молочной кислоты.
Когда обесцвечивание перманганата уже не происходит, это означает, что перегонка закончилась, после чего струю воздуха продолжают барботировать в течение еще 10 минут.
Титрование бисульфита. В колбу Эрленмейера на 200 мл переводят содержание обеих промывочных трубок, споласкивая их с особой тщательностью. Добавляют раствор йода 0,1 н. (8) до синей окраски в присутствии крахмала 1% (9). Для выделения бисульфита соединенного с уксусным альдегидом добавляют 10 мл насыщенного раствора бикарбоната натрия (10) и титруют йодом 0,005 н. (11), добавляемым из микробюретки, до повторного появления синей окраски, устойчивой в течение 5 минут.
Одновременно с этими операциями производят также слепой образец, заменяя титруемый раствор одинаковым объемом дистиллированной воды. Количество йода 0,005 н. использованное для титрования слепого образца вычитается затем из количества израсходованного для анализируемого образца, после чего производится расчет.
Расчет: 1 мл раствора йода 0,005 н. соответствует 0,225 мг молочной кислоты. Предположим, что п – число мл йода 0,005 н. израсходованного при титровании.
Молочная кислота мг/100 мл = 0,225 X n X 100.
Примечание: Метод весьма чувствителен и позволяет определять небольшие количества молочной кислоты (0,2 мг/100 мл).
После каждой перегонки аппарат промывают раствором щавелевой кислоты 5%.
Физиопатологические изменения. В нормальных условиях кровь содержит 8–12 мг молочной кислоты/100 мл. Как известно, молочная кислота контролирует одну из фаз обмена глюкозы. Работы О. Варбурга относительно обмена глюкозы в раковых тканях показали, что в этом случае недостаточность окисления влечет за собой преобладание молочной стадии.
Кроме того определение молочной кислоты представляет интерес также при прослеживании обмена веществ у спортсменов во время тренировок, соревнований и в период отдыха, поскольку известно, что молочная кислота увеличивается после физического усилия в более значительной мере у натренированных лиц (до 30 мг/100 мл), чем у тренированных (15–20 мг/ 100 мл).
Гиперлактацидемия наблюдается также при болезнях сопровождающихся одышкой, воспалении легких, поражениях сердечных клапанов, во время беременности и главным образом при токсикозах.
Этиловый спирт. Микрометод посредством диффузии
Принцип. В присутствии серной кислоты этиловый спирт восстанавливает бихромат натрия пропорционально его концентрации в анализируемом образце. Карбонат натрия кристаллический 20%.
Используют колбу Эрденмойера на 50–100 мл, с пробкой и отделениями (рис. 32). Во внутреннее отделение вводят 1 мл окислительного раствора (1), а во внешнее 1,9 мл карбоната натрия 20% (2) и
0,1 мл крови взятой микропипеткой из мякоти уколотого иглой пальца (палец не вытирают спиртом, а эфиром или же раствором сулемы 2°/00). Микропипетку хорошо смывают, всасывая и выдувая несколько раз жидкость из внешнего отделения. Закупоривают пробкой и оставляют диффундировать в течение 5–24 часов при температуре лаборатории. Содержание внутреннего отделения переводят в градуированную пробирку, хорошо смывая дистиллированной водой и доводя до конечного объема в 10 мл. Отсчитывается затухание образца (Е), а также окислительного раствора (Е0 ) (из которого берут 1 мл и разбавляют также до конечного объема в 10 мл.

Рис. 32. Колба для определения этилового спирта
Расчет: Высчитывают разницу между обоими затуханиями (Ех = Е0– Е), причем значение Ех относят к стандартной кривой, получая результат в мг спирта /100 мл крови.
Стандартная кривая устанавливается в тех же условиях, используя стендартные растворы, приготовленные разбавлением абсолютного спирта.
Обсуждение результата. В нормальных условиях устанавливают 0,5 мг/100 мл – значение представляющее восстановительную способность крови. У человека в состоянии опьянения, непривыкшего к алкоголю, выявляется 120–250 мг/100 мл, в то время как у алкоголиков состояние опьянения характеризуется значениями превышающими 250 мг/100 мл. В исключительных случаях и только при отравлениях (чаще всего с смертельным исходом) можно обнаружить до 700–800 мг/100 мл.





