Полимеразная цепная реакция
Принцип метода
Полимеразная цепная реакция (ПЦР) была разработана сотрудником американской компании «Cetus» К. Мюллисом в 1983 г. Спустя 10 лет за это открытие ему была присуждена Нобелевская премия.
В основе метода ПЦР лежит комплементарное достраивание ДНК-матрицы, осуществляемое in vitro с помощью ферментов, ДНК-полимеразы. Эта реакция носит название репликации. Естественная репликация протекает в несколько стадий – натурация ДНК (расплетение двойной спирали, расход нитей ДНК); 2) образование коротких двунитевых участков («затравок», необходимых для начала синтеза ДНК); 3) синтез новой цепи ДНК (комплементарно, для получения копий коротких участков ДНК, специфичных, например, для конкретных микроорганизмов, т. е. происходит целенаправленный поиск таких специфических участков, что и служит целью генетиской диагностики для выявления возбудителей инфекционных заболеваний).
Открытие термостабильной ДНК-зависимой ДНК-полимеразы (Taq-полимеразы) из термофильных бактерий Thermus aquatic с оптимумом реакции при температуре 70-72 °С позволило сделать процесс репликации ДНК циклическим.
Предпосылками для широкого внедрения метода ПЦР в практику клинико-диагностических лабораторий послужили разработка и промышленный выпуск термостатов с циклической сменой температуры по заданной программе (амплификаторов) и автоматизация этого процесса. При многократном повторении циклов синтеза происходит экспоненциальное (в геометрической прогрессии) увеличение количества копий специфического фрагмента ДНК. Часто искомая ДНК не присутствует в исследуемом материале в достаточном количестве для генетических исследований или определения микроорганизмов. Поэтому для увеличения аналитической чувствительности искомая ДНК должна быть размножена. Полимеразная цепная реакция – наиболее подходящий метод для этих целей.
Таким образом, по своему принципу, ПЦР – метод многократно повторяющихся циклов ферментативного синтеза in vitro специфических нуклеотидных последовательностей ДНК-матрицы, катализируемого ферментом ДНК-зависимой ДНК-полимеразой (амплификация).
Многократно копируемый участок ДНК заведомо выбран исследователем из известной нуклеотидной последовательности определенного фрагмента ДНК-матрицы, который является маркерным, т.е. специфическим, уникальным, например, для данного вида возбудителя. С внедрением этого метода отпала необходимость выделять и очищать ДНК-мишень. Очень небольшой по объему и необработанный материал может быть исследован и подвергнут детекции. Комплементарное достраивание цепи ДНК начинается не в любой точке последовательности ДНК, а только в определенных стартовых блоках — коротких двунитевых участках. В случае присоединения таких блоков к специфическим участкам ДНК можно направить процесс синтеза новой цепи только в этом участке, а не по всей длине цепи ДНК.
Для создания стартовых блоков в заданных участках ДНК используют две олигонуклеотидные «затравки», содержащие 18-35 нуклеотидов, которые комплементарны последовательностям ДНК на правой и левой границах специфического фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК происходит только между ними.
Каждый цикл амплификации при полимеразной цепной реакции протекает в присутствии следующих основных компонентов: ДНК-матрица (ДНК или ее часть, содержащая искомый специфический фрагмент ДНК в образце любого происхождения, в частности в любой биожидкости);
- два синтетических олигонуклеотидных праймера, комплементарные участкам ДНК, находящимся на противоположных нитях на границах определяемого специфического фрагмента и фланкирующим искомую мишенную последовательность ДНК;
- четыре дезоксирибонуклеотида (дНТФ) – смесь дезоксирибо-аденозинтрифосфата, дезоксирибоцитидинтрифосфата, дезоксири- богуанозинтрифосфата, дезоксириботимидинтрифосфата, являющихся материалом для синтеза новых комплементарных цепей ДНК;
- термостабильная ДНК-зависимая ДНК-полимераза, выдерживающая нагревание до 95 °С, катализирующая удлинение цепей праймеров путем последовательного присоединения нуклеотидных оснований из смеси дезоксирибонуклеотидов к растущей цепи синтезируемой ДНК;
- соответствующий солевой буфер, реакционная среда с обязательным присутствием ионов магния, необходимых для поддержания активности ДНК-зависимой ДНК-полимеразы.
Выбор специфического фрагмента и подбор праймеров играют важнейшую роль в специфичности проведения амплификации, что сказывается на качестве проведения анализа.
Конструирование праймеров проводят после определения нуклеотидных последовательностей в исследуемой ДНК. Для подбора оптимальных условий полимеразной цепной реакции с выбранными праймерами используют специальные компьютерные программы. Для анализа сходства испытуемых ДНК с известными нуклеотидными последовательностями используют международные банки данных и компьютерные программы.
Для определения специфических участков генома РНК-содер- жащих вирусов сначала получают ДНК-копию с РНК-матрицы, используя реакцию обратной транскрипции, катализируемую ферментом ревертазой (обратной транскриптазой).
Для получения достаточного количества копий искомого специфического фрагмента амплификация ДНК должна включать несколько (20-40) циклов. Каждый цикл ПЦР состоит из трехэтапов (фаз), протекающих при различных температурных режимах (рис. 5.1). Продолжительность каждого этапа зависит от конкретного определяемого аналита, используемого набора реактивов и типа амплификатора.
1-й этап – денатурация ДНК (расплетение двойной цепи) протекает при температуре 93-95 °С в течение 30-40 с.
2-й этап – присоединение праймеров (отжиг), происходит комплементарно к соответствующим последовательностям на противоположных однонитевых цепях ДНК на границах специфического участка. Для каждой пары праймеров существует своя температура отжига в интервале 50-65 °С. Продолжительность отжига – 20-60 с.
3-й этап – элонгация – комплементарное достраивание цепей ДНК, происходит от 5'-конца к 3'-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей ДНК служат, как указано ранее, ДНТФ. Процесс синтеза происходит при температуре 70-72 °С. Продолжительность этапа – 20-40 с.
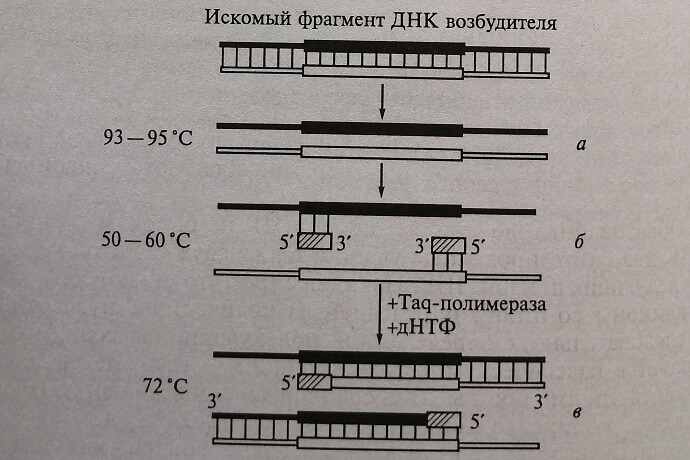
Рис. 5.1. Схема полимеразной цепной реакции. Первый цикл процесса амплификации искомого фрагмента ДНК возбудителя в ПЦР: а – денатурация двунитевой молекулы ДНК; б – присоединение или отжиг стартовых блоков (праймеров); для последующего комплементарного достраивания нитей ДНК; в – комплементарное достраивание нитей ДНК с помошью фермента Taq-полимеразы и дНТФ
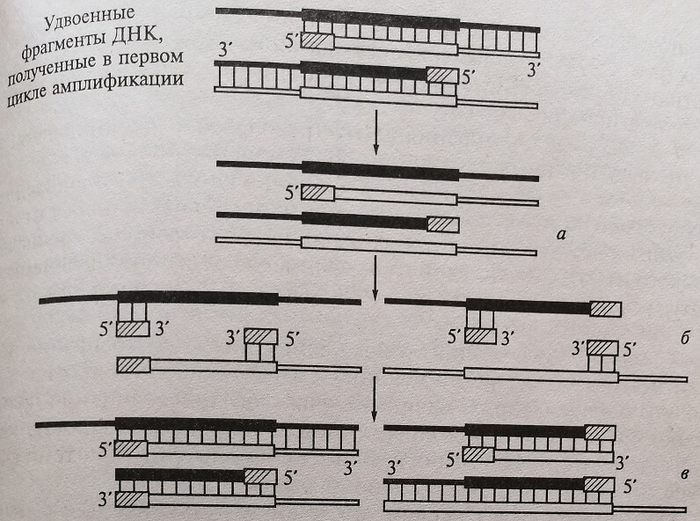
Образовавшиеся в первом цикле амплификации новые цепи ДНК служат матрицами для второго цикла, в котором происходит образование искомого специфического фрагмента «ДНК-ампликона» (рис. 5.2).
Рис. 5.2. Схема полимеразной цепной реакции: а денатурация; б — отжиг праймеров; в — достраивание цепи ДНК
Удвоенные фрагменты ДНК, полученные в первом цикле амплификации, специфически гибридизуются с новыми участками. В результате образуются фрагменты одинаковой длины — ампликоны, концы которых завершаются праймерами. Во время каждого цикла количество вновь синтезированных цепей ДНК удваивается.
Итак, ампликоны, т.е. специфические продукты амплификации, ограниченные двумя праймерами, образуются, начиная со второго цикла.
Образованные во втором цикле ПЦР из одной материнской ДНК два синтезированных участка также служат матрицами для последующих циклов ПЦР. Начиная с третьего цикла, образуются ампликоны со строго определенным количеством нуклеотидов, и, следовательно, с определенной молекулярной массой, что позволяет в классическом методе детекции – гель-электрофорезе выявить эти ампликоны. Так, специфический фрагмент ДНК может быть копирован миллиард раз за короткое время.
Если для выявления нуклеиновой кислоты-мишени методом гибридизации in situ с применением радиоактивного меченого зонда необходимо, чтобы мишень присутствовала в препарате в нескольких тысячах’копий, то при ПЦР интересующая последовательность может быть первоначально представлена лишь одной молекулой. По окончании первого цикла ПЦР из одной молекулы ДНК образуются две новые, идентичные оригинальной. Поскольку праймеры гибридизуются с обеими цепями ДНК, то и нативная последовательность, и синтезируемые ПЦР-продукты могут служить матрицами в последующих циклах репликации. В результате число копий уникальной последовательности увеличивается экспоненциально. Благодаря этому последовательности, присутствующие в изучаемом материале в минимальном количестве (одна или несколько копий) и не поддающиеся обнаружению никакими другими методами, легко выявляются с помощью ПЦР.
Таким образом, ПЦР позволяет найти «иголку в стоге сена» например при исследовании клеток – всего одну аномальную последовательность на 100000 – 1000000 клеток. Экспоненциальное увеличение числа копий молекулы-мишени не только обеспечивает высокую чувствительность, но и облегчает их выявление.
Увеличение числа копий ДНК носит экспоненциальный характер только в первых 20-25 циклах, в дальнейшем в результате истощения дНТФ, снижения активности Taq-ДНК-полимеразы и по другим причинам увеличение количества образующихся копий прекращается.
Итак, схема ПЦР-диагностики выглядит следующим образом:
- взятие биоматериала для исследования;
- пробоподготовка (выделение нуклеиновых кислот);
- постановка и проведение собственно ПЦР;
- детекция ампликонов (электрофорез в геле, планшетная гибридизация);
- интерпретация результатов.
Модификации методов с использованием ПЦР
Полимеразная цепная реакция с использованием обратной транскриптазы. Технология применяется для идентификации РНК вирусов. Простая ПЦР не пригодна для идентификации рибонуклеиновых кислот, так как ДНК-зависимая ДНК-полимераза не способна катализировать синтез ДНК на матрице РНК. Этих целей достигают несколькими приемами:
- применяют дополнительный фермент – РНК-зависимую ДНК-полимеразу – обратную транскриптазу. В результате реакции, катализируемой этим ферментом, образуются однонитевые фрагменты ДНК, Которые в дальнейшем используются в амплификации с помощью Taq-полимеразы;
- применяют ДНК-зависимую ДНК-полимеразу, выделенную из другого термофильного микроба Thermus thermophilus (Tth-полимеразы), с помощью которой в присутствии ионов марганца можно катализировать синтез на РНК однонитевой комплементарной ДНК. При последующем добавлении в среду ионов магния и хелаторов ионов марганца этот же фермент катализирует обычную ДНК-зависимую ДНК-полимеразную реакцию. Таким образом, он может быть одновременно использован и для синтеза комплементарных однонитевых фрагментов ДНК, и для амплификации ДНК.
Мультипраймерная ПЦР
В ходе мультипраймерной ПЦР процесс амплификации нескольких матриц ДНК происходит в одной реакционной среде с несколькими парами праймеров. Это позволяет одновременно провести, например, скрининг по нескольким возбудителям инфекционных болезней, исследовать состояние нескольких аллельных генов у эукариотических организмов, в том числе и у человека.
Гнездовая ПЦР
Это модификация ПЦР, при которой используют две пары праймеров, одна из которых участвует в амплификации внутреннего участка ампликона, полученного после предварительного цикла амплификации с внешней парой праймеров. В ходе этой ПЦР необходимо перенести ампликон на определенном этапе из одной пробирки в другую, что может привести к появлению ложноположительных результатов. Вместе с тем этот вариант ПЦР характеризуется высокой чувствительностью.
ПЦР in situ
Данный метод позволяет специфически амплифицировать и локализовать какую-либо последовательность ДНК внутри клетки. Внутриклеточное обнаружение продуктов ПЦР можно выполнять через непрямую гибридизацию in situ или без этого этапа, с прямой детекцией меченых нуклеотидов. При непрямой ПЦР in situ после проведения амплификации и гибридизации ПЦР-продукт взаимодействует с пробой, меченной флюорохромом. При прямой детекции меченые нуклеотиды (например, дигоксигенин-11-дУТФ, флюоресцеин-дУТФ) включаются непосредственно в состав амплифицируемого продукта.
Метод неоценим в исследовании вирусных инфекций и экспрессии генов в клетке, в оценке эффекта действия новых лекарственных средств на клеточном и молекулярном уровнях.
Количественная ПЦР
При проведении количественной ПЦР частым подходом является использование внутренних стандартов, которые, как и определяемая ДНК, участвуют в ПЦР. Используя добавленные внутренние стандарты с разным количеством копий на один образец, можно определить количество копий матрицы, участвующей в реакции. Такой внутренний контроль позволяет: выявить возможное снижение активности реакции ингибиторами, содержащимися в исследуемом образце; учесть эффект неравномерности протекания реакции, так как условия амплификации стандарта и определяемой ДНК или РНК идентичны; в значительной степени абстрагироваться от изучения закономерностей протекания реакции, так как основным алгоритмом расчета конечного результата является совпадение сигнала от внутреннего контроля — стандарта и сигнала от определяемого ампликона.
ПЦР в реальном времени
Наиболее технологичным подходом в создании количественного метода является ПЦР в реальном времени. Характерной чертой этого метода является возможность прямого определения продуктов реакции непосредственно в процессе амплификации без последующего электрофореза. Для постановки ПЦР в реальном времени необходим специальный амплификатор, с помощью которого можно детектировать и регистрировать флюоресценцию, отражающую накопление ампликон на каждом цикле амплификации.
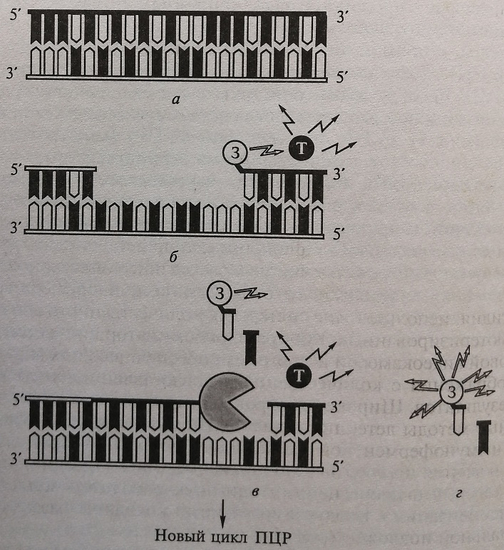
Регистрация накопления продуктов реакции и построение калибровочных кривых происходит по реальным процессам в каждой конкретной пробирке. Используемая для этих целей технология «TaqMan» имеет в основе способность Taq-полимеразы гидролизовать последовательность ДНК в направлении 5'-3'. Принцип работы подобной системы представлен на рис. 5.3:
- в ходе реакции к образцу добавляют специальный зонд модифицированный двумя флюоресцентными красителями (3) и (Т), имеющими близкие максимумы поглощения и флюоресценции света; расстояние между молекулами красителей подобрано таким образом, что происходит перенос энергии от одной молекулы испускающей первичный квант флюоресценции (3), к другой, которая испускает квант света в более длинноволновой области спектра (Т);
- при наличии специфической матрицы в начале амплификации происходит смещение максимума флюоресценции из-за деградации олигонуклеотидного зонда;
- измерение флюоресценции в каждой амплификационой ячейке позволяет рассчитывать количество исходной матрицы, используемой в реакции амплификации. Последняя происходит в приборе, оснащенном устройством освещения возбуждающим светом каждой амплификационной ячейки и многоканальным флюоресцентным детектором. Информацию можно наблюдать на дисплее амплификатора. Для выявления продуктов амплификации используют различные подходы: интеркалирующие метки, к которым относится флюоресцентная метка SYBR Green I, флюоресценция которой значительно возрастает при внедрении ее в двухцепочечные молекулы ДНК. Добавление в реакционную смесь позволяет наблюдать за накоплением продуктов амплификации.
Рис. 5.3. Количественная ПЦР. Схема TaqMan: а – денатурация ДНК; б – отжиг с праймерами и пробой; в – деградация 5'-конца, вызванная Taq-полимеразой; г – детекция сигнала
Другой метод основан на использовании ДНК-зондов, в состав которых входят флюоресцентная метка и гаситель флюоресценции. Когда зонд находится в растворе, гаситель поглощает испускаемое меткой излучение и свечение отсутствует. Когда в ходе ПЦР происходит присоединение ДНК-зонда к комплементарной цепи ДНК, происходит разъединение метки и гасителя, что приводит к увеличению детектируемого свечения. Чем больше ампликонов наработано, тем интенсивнее флюоресценция.
Методы детекции продуктов амплификации
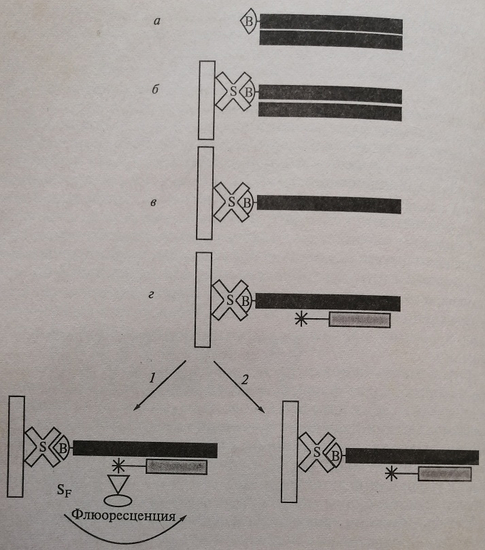
Для детекции и регистрации продуктов амплификации можно использовать различные методы: электрофоретическое разделение ампликонов с последующей их визуализацией окрашиванием, например, бромидом этидия; использование систем для количественного анализа – компьютеризированных УФ-трансиллюминаторов с встроенной Цифровой видеокамерой и программ, обеспечивающих анализ видеоизображения с количественным представлением и распечаткой результатов. Широкое распространение получают гибридизационные методы детекции в планшетном формате с использованием иммуноферментной стадии с флюорогенными субстратами. Для выявления продуктов амплификации (рис. 5.4, а) или прямого измерения флюоресценции олигонуклеотидного зонда после его гибридизации с продуктами реакции в жидкой фазе, либо на специальной подложке (рис. 5.4, б).
Рис. 5.4. Шашечная схема детекции продуктов ПЦР: а – ПЦР с биотинилированными праймерами; б – гибридизация продукта ПЦР на плашку со стрептавидином; в – щелочная денатурация, отмывка комплементарной цепи ДНК; г – гибридизация со специальным зондом, меченным флюоресцентным маркером; 1 – иммуноферментная детекция с использованием флюорогенного субстрата; 2 – прямая детекция флюоресцеинмеченого зонда; В – биотин; S – стрептавидин; SF – меченный флюоресцентной меткой субстрат для ИФА
К другим методам анализа ампликонов относят высокоэффективную жидкостную хроматографию, капиллярный электрофорез, масс-спектрометрию. Аналогичные методы используют в биологических устройствах микросистемах-биочипах. Большинство био-чипов является устройствами для детекции продуктов амплификации и технические принципы их работы будут описаны далее.
Особенности и преимущества ПЦР
Они заключаются в высокой специфичности и чувствительности метода, что и позволяет использовать малое количество (0,01-0,1 мл) любого исследуемого материала, в том числе и гистологические препараты. Ни один из существующих в настоящее время методов не обладает большей чувствительностью, чем методы с ПЦР.
Специфичность методов с ПЦР определяется правильно избранным участком ДНК для каждого аналита или возбудителя и уникальной структурой искусственно синтезируемых праймеров, используемых при амплификации.
Точность ПЦР обеспечивается применением в процедуре анализа положительных и отрицательных контролей, хотя вопросы стандартизации и контроля качества остаются пока еще открытыми. Но именно потому, что чувствительность ПЦР очень высока, существует опасность получения ложноположительных результатов в результате переноса на предметы, оборудование, реагенты как самой матрицы ДНК, так и (что наблюдается гораздо чаще) ампликонов.
Приборы, оборудование и другие средства для ПЦР
Особенности постановки ПЦР требуют соблюдения определенных правил, поэтому организация лаборатории для ПЦР регламентируется рядом нормативных документов, утвержденных Госсанэпиднадзором Министерства здравоохранения Российской Федерации. Для ПЦР-лаборатории необходимо иметь 2-3 комнаты общей площадью не менее 60 м2, оснащенных водопроводом и приточно-вытяжной вентиляцией. В случае использования электрофореза для разделения ампликонов три процедуры (подготовка анализируемых проб, амплификация и детекция результатов) должны быть физически изолированы друг от друга для предотвращения контаминации, и проводиться в разных помещениях, оснащенных предбоксами. Если комнаты для подготовки проб и амплификации в крайнем случае могут быть совмещены и разграничены на зоны за счет установки дополнительных ПЦР-боксов или ламинарных шкафов, то комната для электрофореза должна находиться как можно дальше от первых двух и иметь не связанную с другими зону вентиляции. Должны быть предусмотрены помещения для переодевания персонала, хранения верхней одежды, приема нищи, складское помещение для лабораторных материалов. Каждая рабочая комната должна иметь источник УФ-излучения с длиной волны около 260 нм.
Облучение, инактивирующее ДНК-матрицы, необходимо проводить в течение 1 ч до начала работы и в течение 1 ч после ее окончания. При работе с биоматериалом необходимо использовать резиновые перчатки, так как анализируемые пробы являются потенциально инфицированным материалом, способным длительное время сохранять и передавать вирусы гепатитов, HIV и других возбудителей вирусных инфекций. При работе с потенциально инфицированным материалом необходим автоклав. При работе с трансиллюминатором необходимо пользоваться защитным экраном или специальной защитной маской, защитными очками, так как ультрафиолетовое излучение вызывает ожоги лица и слизистой глаз. Все лабораторное оборудование, пипетки, штативы, посуда, рабочие растворы должны быть строго стационарными. Запрещается их перемещение из одного помещения в другое. Использованные наконечники, пробирки, другие загрязненные предметы инактивируют погружением в специальный раствор, вызывающий деградацию ДНК и утилизируют. Рабочую поверхность стола обрабатывают дезинфицирующим средством.
Минимальный комплект при электрофоретической детекции результатов включает следующие лабораторные приборы и оборудование: амплификатор; термостат для термоподготовки проб; настольную центрифугу типа MiniSpin; центрифугу-вортекс; камеру для электрофореза 9 х 13 см; источник питания для электрофореза; трансиллюминатор; комплект одноканальных полуавтоматических дозаторов на объемы доз от 0,5 до 1000 мкл; подставку для пробирок на 0,5 мл; охладитель для пробирок; штативы для дозаторов; штативы с крышкой на 30 пробирок по 1,5 мл; ламинарный бокс для ПЦР; документирующую систему типа «DNA Analyzer» – отечественный программный продукт для документирования картины электрофореграмм с результатами ПЦР, их учета, обработки и длительного сохранения изображения в памяти компьютера.
Основным прибором для постановки ПЦР является амплификатор, или термоциклер, в гнезда которого устанавливают специальные амплификационные пробирки, изготовленные из теплопроводного пластика, или предметные стекла. В эти пробирки с ПЦР-смесью вносят необходимое количество образца с выделенной ДНК. После этого пробирки, закрытые крышками, помещают в амплификатор. Он представляет собой программируемый термостат.
Устройство амплификаторов разнообразно. Они отличаются друг от друга количеством программируемых блоков, системами охлаждения (водяное, воздушное, фреоном, с использованием полупроводниковых кристаллов), способами обогрева (передача тепла через пробирки с жидкостью или воздушная передача тепла в микрокалориметр для обогрева образцов срезов, тканей, мазков), диапазоном поддерживаемой температуры, точностью поддержания температуры, скоростью нагревания и охлаждения блоков, количеством платформ, на которых происходит амплификация от одной и той же (для увеличения производительности) или по разным (для одновременного анализа разных аналитов или возбудителей инфекционных болезней в одних и тех же пробах) программам, режимами регулирования смены температуры в пробах, объемом памяти при программировании работы амплификатора.
Современные амплификаторы оснащены нагревающимися крышками и позволяют работать без добавления минерального масла. Лаборатория-пользователь может выбрать амплификаторы со сменными блоками для пробирок по 0,5 или 0,2 мл на различное количество образцов, для плашек на 96 или 384 лунки. Кроме того, устройство некоторых амплификаторов зависит и от способа детектирования продуктов амплификации.
При проведении ПЦР в реальном времени фирма «BioRad» рекомендует амплификатор «ICycler IQ», в котором существует возможность подключения оптического блока, позволяющего регистрировать образующиеся ампликоны в ходе реакции. При этом на дисплее отражается концентрация продуктов амплификации в виде графика изменения флюоресцентного сигнала. Если в ходе анализа используют образцы с известной концентрацией ДНК (калибраторы), то результат сопоставляют с динамикой сигнала от калибраторов, и, таким образом, становится возможным количественный анализ нескольких вариантов обработки информации в режиме реального времени, включая автоматический расчет кривых плавления ДНК.
Анализатор «Light Cycler System» представляет собой высокоскоростную систему для ПЦР. Требуемая температура в камере достигается в течение нескольких секунд при скорости изменения ее 20 °С в секунду. ПЦР происходит в специальных капиллярах из боросиликатного стекла, которые вмещают 20 мкл пробы. Капилляры имеют очень высокое соотношение «поверхность/объем» для создания быстрого равновесия между воздухом и компонентами реакции. Такая комбинация с использованием быстрого нагревания воздухом и высокого соотношения площади поверхности капилляра к объему позволяет завершить 1 цикл ПЦР менее чем за 30 с, а 30-40 циклов за 20-30 мин. Свойства боросиликатного стекла капилляров позволяют использовать их в качестве кювет для измерения флюоресценции.
Для выявления продуктов амплификации методом электрофореза в агарозном геле используют электрофоретические камеры, представляющие собой готовые к работе системы. Формат геля определяет пропускную способность камеры, т. е. количество образцов для разделения.
Трансиллюминаторы («столики с подсветкой») представляют собой несложные приспособления, предназначенные для просмотра гелей, а также для документации результатов, если составляют часть документирующей системы. Их главной особенностью являются специальные лампы (4-6 шт.), излучающие ультрафиолетовый свет различной интенсивности.
Формат геля в электрофоретической камере должен соответствовать размеру окна для просмотра гелей в трансиллюминатоп В последние годы большое внимание уделяют модификации модернизации методов регистрации результатов ПЦР. Разработай широкий спектр устройств, позволяющих перевести изображение геля в цифровой формат и отказаться от фотодокументации результатов.
Гибридизационные методы регистрации результатов позволяют существенно повысить специфичность определения, а выполнение в планшетах делает возможными стандартизацию и автоматизацию процесса. В зависимости от метки, входящей в олигонуклеотидный зонд, используют различные способы детекции гибридизационного комплекса (прямое измерение флюоресценции иммуноферментный анализ). Гибридизационные системы детекции на планшетах явились прообразом при создании современных ДНК-биочипов. Оптические биосенсоры не требуют каких-либо модификаций ампликона или зонда, а позволяют определять очень малые (в пикограммах) количества фрагментов нуклеиновых кислот, иммобилизованных на поверхности оптической кюветы, свойства которой дают возможность проводить в ней несколько сотен определений после циклов регенерации по завершении каждого определения.