Потенциометрия для определения аналитов в биоматериалах
Принцип метода
Электрохимические методы исследования основаны на электрохимических процессах, которые происходят на границе раздела фаз на электродах, погруженных в водный раствор, и связаны с изменениями структуры, химического состава или концентрации анализируемого вещества.
Потенциометрия объединяет методы, основанные на измерении электродвижущих сил (потенциалов) обратимых электрохимических реакций, протекающих на границе погруженных в раствор электродов.
Известно много различных электрохимических устройств, основанных на принципах потенциометрии, объединяемых общим названием «электроды». В клинической лабораторной диагностике наиболее часто применяют приборы для исследования кислотнощелочного состояния, рН-метрические и ионоселективные электроды.
Электрод для измерения pH, по существу, является ионоселективным электродом, который обладает специфической чувствительностью к водородным ионам (рис. 2.1.). Электрический потенциал, измеряемый в этих методах, возникает на границе двух сред в том случае, когда ионы одного заряда проникают через эту границу легче, чем противоположно заряженные. Это различие может быть обусловлено свойствами специальной мембраны (перегородки), разделяющей растворы (фазы), или тем, что ионы одного заряда диффундируют из раствора с большей концентрацией в раствор с меньшей концентрацией быстрее, чем ионы противоположного заряда. В первом случае говорят о мембранном, или фазовом, потенциале, во втором – о диффузионном.
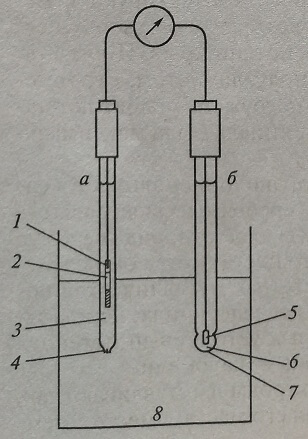
Рис. 2.1. Схема электрохимической ячейки для измерения pH: а – каломельный электрод (референтный); б – электрод для индикации pH; 1 – ртуть; 2 – хлорид ртути Hg2Cl2; 3 – насыщенный раствор хлорида калия КС1; 4 – жидкое сочленение; 5 – Ag/AgCl (внутренний электрод); 6 – референтный раствор; 7 – стеклянная ионоселективная мембрана; 8 – исследуемый раствор
В аналитических целях измеряют мембранный потенциал, а диффузионные потенциалы обычно являются только помехой, поэтому измерительные электроды или, как их иногда называют, ячейки, конструируют так, чтобы диффузионный потенциал как можно меньше сказывался на результатах измерения. Мембрана может быть пористой (например, изготовленной из эфиров целлюлозы) или непористой – стеклянной или из нейтрального носителя – поливинилхлорида.
Стеклянные электроды – это ионоселективные электроды, в которых чувствительным элементом является перегородка, изготовленная из специального сорта стекла, состав которого определяет свойства электрода.
К таким электродам относятся электроды для определения pH (чувствительные к концентрации ионов водорода) и некоторых одновалентных катионов, например для определения иона натрия.
Электрическая цепь ионоселективного электрода имеет следующую схему: по одну сторону ионоселективной (т. е. избирательно пропускающей определенные виды ионов) мембраны находится эталонный раствор, по другую – исследуемый. Оба раствора посредством солевых мостиков, т.е. трубочек, заполненных раствором соли (обычно хлоридом калия), контактируют с металлическими электродами, на границе которых с раствором всегда одна и та же разность электрических потенциалов. Иногда такой металлический электрод называют полуэлементом. Его материал и состав раствора, в который он погружен, подбирают таким образом, чтобы величина этого потенциала была максимально устойчивой.
В ионоселективных электродах, как правило, используют в качестве полуэлементов серебряные (хлорсеребряные электроды) – кусочки серебряной проволоки, покрытые слоем хлорида серебра. Исправный полуэлемент обычно темного цвета. Когда он портится, хлорид серебра осыпается и видна светлая металлическая поверхность. Реже, в основном в научных исследованиях, используют каломельные полуэлементы, в которых устойчивый потенциал образуется на границе ртути и ее соли – каломели.
Конструктивно ионоселективные электроды изготавливают так, что эталонный раствор (или заменяющая его масса) вместе с мембраной объединены в один блок с металлическим электродом (полуэлементом), к которому подведен электрический провод. Вторая половина электрической цепи также изготовлена в виде отдельного блока, который называется электродом сравнения и референтным. Пример такого электрода показан на рис. 2.2.
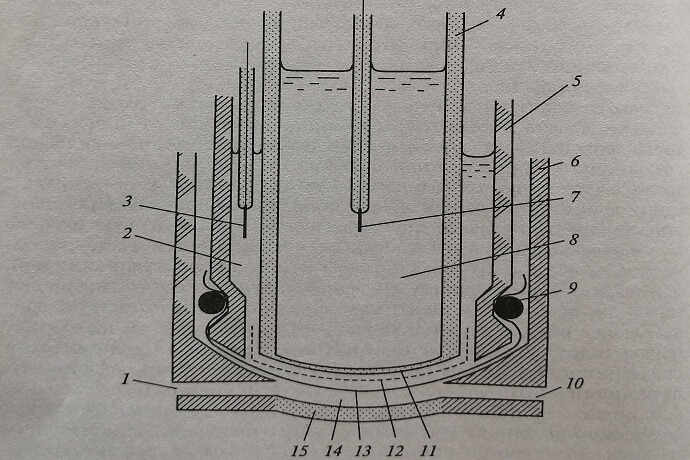
Рис. 2.2. Схема устройства электрода рС02: 1 – ввод пробы; 2 – бикарбонат натрия; 3 – референтный электрод (Ag/AgCl); 4 – стеклянная капсула электрода; 5 – пластик; 6 – оболочка электрода; 7 – внутренний электрод (Ag/AgCl); 8 – фосфатный буфер; 9 – кислородное кольцо; 10 – выход пробы; 11 – pH-чувствительная стеклянная мембрана; 12 – пористая оболочка; 13 – проницаемая для С02 мембрана (силиконовая резина); 14 – кювета; 15 – стеклянное окно
Часто несколько ионоселективных электродов, например определения натрия, калия и хлора, объединяют в один агрегат. В этом случае достаточно одного, общего для них электрода сравнения. На границе растворов электролитов разных концентраций разделенных перегородкой с избирательной проницаемостью ионы из более концентрированного раствора диффундируют в менее концентрированный. Но через полупроницаемую перегородку могут проходить ионы только одного заряда, в данном случае – положительного. Поэтому на границе раздела возникает разность потенциалов — положительные ионы прошли через нее, отрицательные остались в более концентрированном растворе, разбавленный раствор приобретает положительный заряд, концентрированный — отрицательный. Эта разность потенциалов препятствует диффузии новых порций ионов, таким образом разность концентраций способствует перемещению ионов, а разность электрических потенциалов препятствует этому.
Изменение концентрации ионов в одинаковое количество раз вызывает одинаковое изменение электрического потенциала, независимо от того, какой ион и в каком диапазоне концентраций исследуют, имеет значение только заряд иона. Так, изменение концентрации натрия со 150 до 165 ммоль/л, т.е. на 10 %, вызывает такое же изменение электрического потенциала, как изменение калия от 5,0 до 5,5 ммоль/л, хотя в первом случае концентрация возрастает на 15 ммоль/л, а во втором всего на 0,5 ммоль/л. В этом заключается принципиальное преимущество потенциометрических методов по сравнению, например, с фотометрическими — точность определения всегда пропорциональна концентрации, она не зависит от диапазона – идет ли речь о нормальных или патологических величинах.
Ионоселективный электрод измеряет не общую концентрацию вещества, а так называемую активность иоца, которая, хотя обычно пропорциональна общему содержанию, но зависит от многих факторов: связи ионов с каким-либо компонентом биологической среды, другими ионами или белком, влияния ионной силы раствора, а также от того, что измеряют не общее содержание иона в единице объема, а концентрацию его в свободной воде. Пространство физически занятое другими молекулами, в первую очередь большими молекулами белка, а также липопротеинами, исключают из расчета. В условиях патологии, при гиперпротеинемии или, особенно, при гиперлипидемии, их влиянием нельзя пренебрегать. Так, массовая концентрация воды сыворотки крови у здоровых людей обычно около 0,93 кг/л, но в некоторых случаях может падать и до 0,80 кг/л. Поэтому активность иона в биологической среде никогда не равна его концентрации, причем коэффициент активности – отношение активности к концентрации — несколько варьирует.
Ионометры (приборы, которые считывают данные ионоселективных электродов) калибруют так, чтобы измерялась активность иона, а на шкале выдавались значения концентраций. Такая калибровка возможна только при совершенно определенных условиях: величине pH, концентрации других ионов, содержании белка, температуре. Изменение любого из этих параметров приводит к ошибке вследствие нарушения калибровки.
Согласно рекомендациям Международной федерации клинической химии и лабораторной медицины по применению ионоселективных электродов для анализа электролитов в крови и калибровочном растворе содержание воды должно составлять 1 0,93 ±0,005 кг/л, pH 7,40±0,05, концентрация альбумина, общего белка, холестерина и триглицеридов – в пределах референтных величин. Результаты выдаются в единицах концентрации вещества, моль/л, в расчете на один литр «стандартной плазмы» или на воду, содержащуюся в плазме.
Калибровку электрода необходимо проводить ежедневно по двум точкам по промышленно изготовляемым калибровочным растворам с указанием в паспорте концентрации в плазме или в воде плазмы. В постоянной и систематической калибровке нуждаются все электроды, срок работы каждого из них ограничен. Они очень чувствительны к попаданию посторонних веществ – щелочей, кислот, дезинфицирующих агентов, а также к нагреванию. Особую опасность представляют поверхностно-активные вещества, которые могут попасть в пробы, если используется недостаточно чистая посуда.
Промывка растворами, не предусмотренными инструкцией, чревата разрушением устройства. Белковые молекулы, адсорбируясь на поверхности электродов, могут быть причиной неверных показаний, их удаляют многократным промыванием или разрушая протеолитическими ферментами (пепсином).
Области применения в клинической лабораторной диагностике
Потенциометрический метод анализа электролитов обладает рядом преимуществ, перед колориметрическими и пламенно-фотометрическими методами. В отличие от последнего это – полностью безопасный микрометод. Ионоселективные анализаторы — настольные малогабаритные приборы, позволяющие устанавливать уровень функционально активных ионов. Электроды с использованием потенциометрии применяют в полуавтоматических и автоматических анализаторах – ионометрах для определения pH растворов, а также для определения электролитов – ионов натрия, калия, кальция, лития, хлоридов, общего С02 в сыворотке, плазме, цельной крови, моче, почечных диализатах, поте.
Метод определения ионов без разведения биожидкости называется прямой потенциометрией, в случае разведения биожидкости перед определением метод называется непрямой потенциометрией. Без этих анализаторов не может работать экспресс-лаборатория, обслуживающая операционные блоки, реанимационные отделения, отделения неотложной терапии и «искусственной» почки; дежурные лаборатории.
В лабораториях нашей страны работают отечественные микроанализаторы ионоселективные ЭЦ-59 (ООО «Квертимед») для быстрого и прямого определения ионов натрия и калия, известен анализатор «АнИон» (Беларусь) для одновременного определения ионов натрия, калия, хлоридов, лития, кальция и pH, ана-
лизаторы зарубежного производства. Ионоселективные электроды на основе потенциометрии в виде модулей (блоков) включают в общее устройство различных биохимических автоанализаторов, в том числе и в линии срочного анализа. Разработан метод прямой потенциометрии с использованием «сухой» химии — потенциометрические слайды для определения натрия, калия, хлоридов.




