Технологии «сухих тестов» для исследований крови и других биологических жидкостей
Особенности биохимического анализа крови
Ранее всего были разработаны методы «сухой химии» для определения глюкозы в крови. В настоящее время исследование как глюкозы, так и различных других аналитов в крови может быть выполнено на диагностических полосках, многослойных пластиковых элементах – биосенсорах, с помощью специальных картриджей, содержаших сухие реактивы.
Принцип метода исследования глюкозы с помощью диагностических полосок и слайдов практически совпадает с методом, используемым для определения глюкозы в моче – это специфический глюкозооксидазный – пероксидазный метод с окислением хромогена – индикатора (о-толидина, тетраметилбензидина) н образованием окрашенного соединения, изменяющего окраску истовой зоны.
Для оценки концентрации глюкозы в исследуемом образце окраску тестовой зоны визуально сравнивают с окраской зон цветной шкапы, нанесенной на пенал для хранения полосок, либо полоску или слайд помещают в отражательный фотометр для измерения результата. Изменение окраски пропорционально концентрации глюкозы. Структура и состав элементов диагностической полоски для исследования глюкозы, как и других аналитов в крови, отличается от таковых в диагностических подосках для мочи, поскольку различаются состав и вязкость этих биожидкостей.
Отличаются соответственно виды и состав контрольных и калибровочных материалов. При использовании глюкометров после нанесения капли капиллярной (или венозной) крови врач, лаборант или сам пациент, строго соблюдая время, указанное в инструкции, не удаляя каплю крови, помещает полоску в прибор.
Характеристика диагностических систем
Примеров диагностических полосок отечественного и зарубежного изготовления для определения глюкозы в крови очень много: полоски «ДИАГЛЮК» производства ООО «Биосенсор АН», «Глюкофотохром-БП-М» для глюкометра, изготовленного ЗАО «Биоприбор», «Асси-Chek» для анализатора «Асси-Chek», «Accutrend Glucose» для глюкометра «Accutrend GCT», полоски «Betachek» для одноименного глюкометра», «Опе-Touch» для глюкометра «One-Touch II» и др.
Следует обратить внимание на особую технологию полосок «Betachek». Каждая полоска содержит две тестовые зоны на глюкозу, расположенные на полоске параллельно. В связи с иммобилизацией в них различных редокс-индикаторов зоны окрашиваются в различные цвета: одна в разные оттенки розового, другая – синего. Технология этих полосок позволяет лучше воспринимать оттенки цвета людям со сниженным цветоощущением, что очень важно для самоконтроля уровня гликемии больными диабетом, У которых часто наступают нарушения зрения. На современных диагностических полосках результат определения глюкозы в цельной крови можно получить очень быстро: в зависимости от полоски и прибора от 12 с до 1 мин.
Одной из первых аналитических систем для определения нескольких аналитов в цельной крови, сыворотке или плазме по- явилась система «Reflotron» на основе диагностических полосок «Reflotest». Каждая из полосок «Reflotest» является монотестом – она предназначена для анализа одного отдельного аналита. Визуальное считывание результатов при их применении невозможно Они служат лишь для измерения на приборе «Reflotron».
Схема устройства полоски представлена на рис. 7.4. Сверху каждая из них плотно закрыта фольгой, удаляемой перед выполнением исследования. Все реактивы для проведения реакции иммобилизованы на пластиковой подложке белого цвета, хорошо отражающей свет. На нижней стороне подложки к полоске прикреплена магнитная лента, несущая всю необходимую информацию о тесте, для которого она предназначена: тип теста; продолжительность инкубации и фазы реакции; длина волны измерения; количество измерений, которые необходимо выполнить и временные интервалы между ними; способ расчета результатов после измерения отраженного света; факторы перерасчета результатов из единиц СИ в обычные единицы. Используя эти данные, микропроцессор, встроенный в отражательный фотометр «Reflotron», автоматически контролирует работу прибора в процессе анализа. С обоих сторон полоска имеет по одному отверстию, что позволяет помещать ее на штифты в кюветной камере прибора в точно определенное положение, что обеспечивает правильное положение тестовой зоны, с которой считывается результат, под детекторами фотометра, а магнитной ленты – над сенсором, который считывает ее код.
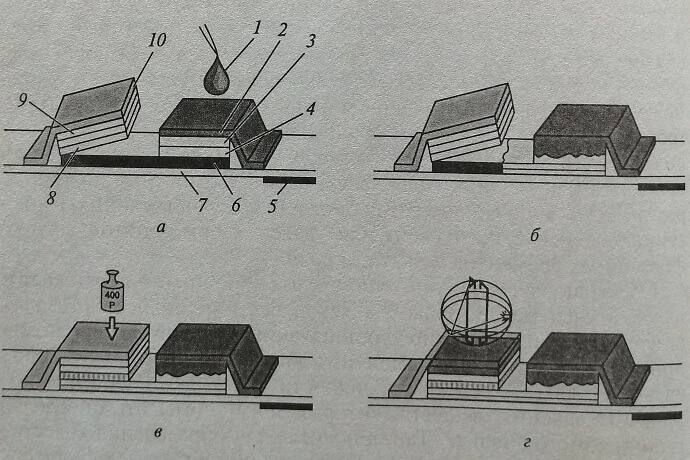
Рис. 7.4. Схема устройства диагностической тест-полоски для исследования крови «Reflotest»: а – нанесение крови на тестовую зону полоски; б – эритроциты отделяются от плазмы крови, плазма вытекает вниз в резервуар для плазмы; в – вид полоски в камере отражательного фотометра, слои с реактивами погружены в резервуар для плазмы; г – развитие окраски в индикаторной зоне полоски и измерение отраженного света; 1 – проба крови; 2 – защитное покрытие; 3 – материал для отделения плазмы от клеток крови; 4 – дополнительный реагент; 5 – магнитный код; 6 – транспортный слой для плазмы крови; 7 – подложка; 8 – слой с реагентом 1; 9 – слой с реагентом 2; 10 – прозрачная пленка
После снятия фольги можно заметить, что элементы полоски, иммобилизованные на подложке, разделены на две части. В правой части находится выступ – зона для нанесения биожидкости, покрытая сеткой из стекловолокна. Окраска этой зоны различна в зависимости от биожидкости, которую можно использовать для определения данного аналита на этой полоске, и сразу правильно ориентирует оператора.
В том случае, когда полоска может быть использована только для работы с сывороткой или только с плазмой, зона для нанесения биожидкости окрашена в желтый цвет. Из 16 аналитов таких только две – для калия и холестерина липопротеидов высокой плотности (ЛПВП). В полосках для остальных 14 аналитов эта зона окрашена в красный цвет, и это означает, что кроме сыворотки и плазмы первичной биожидкостью, которую наносят на эту зону, может быть цельная капиллярная или венозная кровь. Однако устройство полоски таково, что определение компонента при использовании цельной крови (за исключением гемоглобина) происходит в плазме, и это не следует забывать при интерпретации результатов. Зона для введения биожидкости многослойна. Нанесенная на нее сетка служит для удаления эритроцитов, других форменных элементов и частиц крови.
Поступающая в нижние слои плазма либо просто перетекает в находящийся между правой и левой частями полоски отдел — резервуар для плазмы, либо до попадания в резервуар для плазмы приходит в соприкосновение с иммобилизованными внутри слоев зоны для нанесения биожидкости реактивами, способствующими удалению веществ, которые могут помешать определению искомого аналита. Так, в полоске для определения холестерина липопротеидов высокой плотности внутри зоны для нанесения биожидкости иммобилизованы декстран и сульфат магния, которые осаждают хиломикроны – триглицериды и липопротеиды низкой и очень низкой плотности. В резервуар для плазмы поступает плазма только с липопротеидами высокой плотности. В полоске для определения активности панкреатической амилазы в этой зоне иммобилизованы два вида различных моноклональных антител для удаления из плазмы слюнного изофермента амилазы. В результате плазма поступает в резервуар только с панкреатическим изоферментом амилазы.
В полоске для определения гемоглобина внутри зоны для нанесения крови иммобилизованы реактивы для выполнения теми глобинцианидного метода, а для определения креатинина в эту зону нанесена креатинамидогидролаза, избавляющая вытекающую в резервуар плазму от присутствующего в ней креатина. Левая часть полоски (индикаторная зона) для всех тестов кроме гемоглобина представлена несколькими лепестками носителей реактивов, прикрытыми прозрачной пленкой. После того, как полоска с нанесенной на нее биожидкостью – кровью, сывороткой или плазмой – в объеме 32 мкл не позднее, чем спустя 15 с после нанесения, помещается в кюветную камеру рефлектометра, крышка фотометра закрывается и придавливает эти лепестки с иммобилизованными в них реактивами, погружая их в резервуар для плазмы. Реактивы растворяются и запускается реакция.
В случае гемоглобина вытекающий после нанесения крови цианметгемоглобин попадает в разделенные друг от друга фольгой наподобие сот микрокюветы, отражающийся от них свет измеряется при длине волны 567 нм. В других методах измеряется свет, отражающийся от индикаторного лепестка, который в результате реакции изменяет окраску. Этот индикаторный слой частично поглощает свет, а отраженный от него свет измеряется фотодетекторами, позволяющими регистрировать его на длинах волн 565, 642 и 950 нм, у которых спектральная чистота поглощенного света имеет такие же хорошие качества, как и у светофильтров. Измерение Отраженного света происходит с высокой точностью и хорошей воспроизводимостью.
Фотометр позволяет проводить как кинетические измерения, так и измерения в конечной точке реакции. Кюветная камера может быть термостатирована при трех температурах: 25, 30 и 37 °С. Расчет результатов после измерения отраженного света выполняется автоматически микропроцессором.
При разработке этой технологии для многих аналитов (глюкозы, триглицеридов, холестерина, мочевины, билирубина, гемоглобина) использовались аналитические принципы, применявшиеся в обычных биохимических исследованиях с жидкими реактивами. Для определения иона калия, креатинина, у-глутамил-трансферазы и аминотрансфераз – АсАТ и АлАТ – были разработаны методы, основанные на абсолютно новых аналитических принципах. Можно выделить несколько групп методов.
1. Специфические ферментативные методы с сопряженными реакциями, катализируемыми рядом ферментов, в конечном итоге с образованием пероксида водорода. В катализируемой пероксидазой реакции образующийся атомарный кислород окисляет восстановленную форму бесцветного индикатора, иммобилизованного в верхнем лепестке в левой части полоски, в голубой цвет. Отражающийся от этой индикаторной части свет измеряется при длине волны 642 нм. Такой принцип применяется в полосках Reflotest» для значительного количества аналитов – субстратов глюкозы, креатинина, триглицеридов, холестерина, холестерина липопротеидов высокой плотности, мочевой кислоты), измеряемых в конечной точке реакции. Аналогичный принцип используется в кинетических методах определения активности трех ферментов: АсАТ (субстрат – аланинсульфинат), АлАТ (субстрат – аланин) и креатинкиназы (субстрат – креатинфосфат). Специфическая реакция в них запускается воздействием на субстрат определяемого фермента сыворотки или плазмы и в результате серии сопряженных реакций приводит к образованию пероксида водорода. В катализируемой пероксидазой реакции бесцветная восстановленная форма индикатора приобретает при окислении синий цвет, измерения проводят отражательным фотометром при длине волны 567 нм.
2. Образование окрашенных в красно-фиолетовый цвет диазосоединений при взаимодействии определяемых компонентов (глюкуронида билирубина) или продуктов распада специфических субстратов под действием измеряемых ферментов (например, индоксила под действием а-амилазы или панкреатической амилазы и а-глюкозидазы) с диазониевыми солями. Измерение отраженного света проводят при длине волны 567 нм.
3. Методы, основанные на изменении окраски индикаторов pH: под действием уреазы мочевина гидролизуется с образованием углекислого газа и аммиака, который, проникая в забуференный индикаторный слой, вызывает изменение его окраски от желтого до зеленого или синего цвета в зависимости от концентрации мочевины в крови (измерение при длине волны 642 нм); при определении иона калия последний, переходя из водной фазы в органическую, образует комплекс с валиномицином. Индикатор pH, растворенный в органической фазе, освобождает при этом протон и окрашенный в голубой цвет анион. Измерение отраженного от индикаторного лепестка света проводят при длине волны 642 нм.
4. Гемиглобинцианидный метод для определения гемоглобина.
5. Метод с синтетическим хромогенным субстратом – у-глутамил-3-карбокси-1,4-фенилендиамином для определения активности у-глутамилтрансферазы. Под действием у-глутамилтранс-феразы хромогенный субстрат гидролизуется и у-глутамиловый остаток переносится на глицилглицин с образованием у-глута- милглицилглицина, а освобождающийся 3-карбокси-1,4-фени- лендиамин в присутствии N-метилантраниловой кислоты окисляется феррицианидом калия с образованием вещества, окрашенного в зеленовато-голубой цвет. Кинетическое измерение отраженного от индикаторного лепестка света проводят при длине волны 642 нм.
Время измерения результатов варьирует для различных аналитов от 120 с (гемоглобин, у-глутамилтрансферазы) до 230). Перед внедрением этих тестов для каждого из них был проведено тщательное изучение влияния таких факторов, как гематокрит, гемолиз, липемия (для сыворотки), билирубин в патологических концентрациях; восстанавливающих веществ, аскорбиновой кислоты, различных антикоагулянтов и большого перечня лекарств. Для данной системы выпускают специальные контрольные материалы с аттестованными значениями аналитов в нормальном и патологическом диапазонах. Система «Reflotron» предназначена для количественного определения аналитов с высоким уровнем качества и аналитической надежностью, что позволяет использовать эту технологию не только для лабораторной диагностики, но и для слежения – мониторинга за результатами в процессе лечения пациентов.
Система «Seralyzer» использует диагностические полоски для биохимических компонентов (субстраты, ферменты, лекарства), предназначенные для работы с 10 мкл сыворотки или плазмы для кинетических измерений и измерений в конечной точке реакции также на основе отражательной фотометрии (девять светофильтров с длинами волн от 340 нм до 740 нм), Цельная кровь необходима только для определения гемоглобина. Палитра тестов включает те же биохимические исследования, которые были развиты для системы «Reflotron», (кроме у-глутамилтрансферазы, холестерина липопротеидов высокой плотности, калия), а также анализы на альбумин, щелочную фосфатазу, общий белок, кальций, лекарства.
Известны системы с использованием диагностических полосок для небольшого количества исследований, например «Accutrend GCT» фирмы «Roche Diagnostics» для определения глюкозы, триглицеридов и холестерина высокоспецифичными ферментативными методами.
Для определения глюкозы (глюкозооксидазный метод) и лактата применяют диагностические полоски, основанные на электрохимическом принципе измерения, являющиеся биосенсорами. Измерение выполняют с помощью портативного амперометрического прибора. Глюкоза из нанесенной на тестовую зону капли крови гидролизируется с образованием глюконовой кислоты и пероксида водорода, специальные медиаторы (ферроцен) переносят электроны на зонд электрода, с помощью которого измеряется сила возникающего электрического тока, пропорциональная концентрации глюкозы в пробе.
Некоторые из таких приборов уменьшены до размеров кредитной карточки, например глюкометр «Super Glucocard II» или прибор для определения лактата в крови «Lactate PRO». Биосенсоры для этих приборов длиной около 2,0 см, а тестовая зона диаметром около 3,0 мм. В отечественном электрохимическом глюкометре «Сателлит» длина биосенсора составляет около 4 см, а длина тестовой зоны – около 5 мм. Расчет результатов по измеренной силе тока проводят в соответствии с градуировочным кодом, который обозначен на упаковках с биосенсором. Одноразовые биосенсоры герметично упакованы в фольгу по одному.
К таким приборам прилагаются контрольные биосенсоры или биоматериалы в жидком виде, позволяющие гарантировать хорошее качество выполнения измерений.
В качестве «сухих» тестов для биохимических исследований используют также многослойные пленки. Технология была разработана как для полуавтоматических экспресс-анализаторов DT 60, так и для больших биохимических автоанализаторов (в настоящее время — анализаторы «Vitros»). Аналитический элемент размером с почтовую марку представляет собой слайд, вмонтированный в рамку, на обратной стороне которой указан биохимический тест, для которого этот слайд предназначен, и штрих-код. В середине слайда расположен кружок – тестовая зона для нанесения сыворотки или плазмы. В качестве подложки используется негнущийся пластик или аналогичный материал. Для усиления отражения света, что необходимо для процедуры измерения, поры пластика заполняют неорганическим пигментом, чаще всего двуокисью титана. В этом случае подложка играет роль отражательного слоя. Реагентная часть системы состоит из нескольких слоев пленок, в которых иммобилизованы реактивы в сухой форме.
Иногда в систему включены дополнительные промежуточные слои, предназначенные для определения, разрушения и маскировки интерферирующих веществ, содержащихся в исследуемой пробе, а также верхний, распределительный, слой, обеспечивающий равномерное распределение биожидкости по поверхности слайда и более равномерное проникновение ее в реактивный слой. Он действует как микрофильтр, удаляющий мелкие частицы и крупные молекулы, такие, как белки. Этот слой также содержит белое диффузно распределенное в нем отражающее вещество, которое обеспечивает отражение света во время колориметрии через прозрачную основу. Отдельные слои с помощью самоклеящихся пленок или одновременно все слои с помощью специальной рамки объединены в слайд. Различают три типа слайдов: для биохимических тестов, иммунохимических определений (отражательная фотометрия) и электролитов (потенциометрия).
«Сухие иммунохимические тесты»
Под понятием «сухая иммунохимия» объединяют аналитические устройства, в которых иммобилизованы в сухой форме реактивы для проведения гомогенного и гетерогенного иммуноанализа в пористом матриксе с применением моноклональных и поликлональных антител для специфического связывания с исследуемым аналитом. Это могут быть диагностические полоски или тест-кассеты. Наиболее часто используют два вида этих устройств: «проточный тип» и тесты, основанные на латеральном, или поперечном, токе на диагностических полосках и кассетах.
В первом случае пористый матрикс образует реакционную зону и действует как твердая фаза в варианте гетерогенного иммуноанализа. Антитело ковалентно связано с поверхностью пористого матрикса. При нанесении пробы на матрикс содержащийся в ней аналит связывается с иммобилизованным антителом. Добавление второго меченого антитела формирует «сэндвич» и привязывает метку к месту иммобилизации первого антитела. Оценку результата по окрашенной метке выполняют визуально. В качестве метки при этом можно использовать окрашенные частицы латекса, коллоидального золота.
При постановке иммуноферментных реакций окраска выявляется после добавления к связанному с искомым аналитом антитела, конъюгированного с ферментом, соответствующего субстрата. На этом принципе основано обнаружение и полуколичественное определение ряда компонентов (Д-димера, С-реактивного белка) на карточках «NycoCard». Карточка отмечена названием компонента, для которого она предназначена, и имеет шесть лунок (каждая для одного анализа), содержащих пористую мембрану с иммобилизованными антителами к исследуемому аналиту.
В случае превышения концентрации аналита в крови или сыворотке, нанесенной в лунку, порогового значения (например, 10 мг/л для С-реактивного белка) аналит связывается с иммобилизованными на мембране моноклональными антителами, специфичными к одному его эпитопу. После добавления конъюгата моноклональных антител с частицами коллоидального золота (размером 3-5 нм), специфично связывающихся с другим эпитопом молекулы аналита, образуется «сэндвич», в котором реализуется оптический эффект связанного в нем коллоидального золота. После промывки ячейка приобретает различные оттенки красного цвета. Окрашивание сравнивают с прилагаемой к данному тесту полуколичественной шкалой. Возможно количественное определение аналита с помощью отражательного фотометра, имеющего оригинальную конструкцию: ячейку в карточке не помещают в кюветную камеру ридера, а на нее накладывают соединенный с ним детектор.
Концентрацию важного для диагностики нарушений в системе гемостаза Д-димера можно определить аналогичным способом в диапазоне от 0,5 мг/л до 8,0 г/л. На этом принципе основано несколько «сухих» тест-систем для обнаружения антител к антигенам вирусов H1V1/HIV2 или раздельного обнаружения антител к этим вирусам.
Другой тип иммуноаналитических устройств – тесты, основные на латеральном, или поперечном, токе на диагностических полосках и кассетах. В них нанесенная на тестовую зону проба с искомым аналитом выступает в роли растворителя и в связи с хроматографическими свойствами носителя движется по участку пористого матрикса, на котором в высушенной форме расположены необходимые для соответствующей иммунохимической реакции реактивы (антигены, меченые и другие антитела и т.д.).
Эти тесты, как правило, выполняют в один этап, анализ завершается в течение несколько минут. Подобно другим вариантам «сухих» технологий в данном имеются как монотесты, предназначенные для обнаружения одного аналита, так и политесты для выявления целой панели аналитов. Так, панель «М1» двухэтапного иммунохроматографического теста для выявления инфаркта миокарда насчитывает четыре маркера повреждения сердечной мышцы: миоглобин, легкие цепи миозина, КК MB и тропонин, для каждого из которых в случае положительной реакции обнаруживается отдельная окрашенная полоса.
В серии тестов «Status DS» для скрининговых исследований при наркоманиях и токсикоманиях имеются иммунохроматографиче- ские кассеты для обнаружения лекарств и наркотиков на одно вещество (или его метаболиты), на 2, 3, 4, ..., 10 аналитов (метадон, опиаты, кокаин, марихуана, фениелидин, амфетамины, барбитураты, трициклические антидепрессанты, метамфетамины, бензодиазепины).
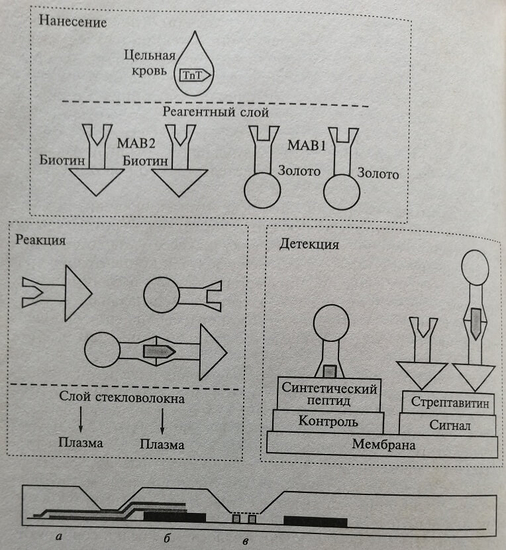
Один из наиболее распространенных аналитических принципов носит название «GLORIA» (Gold Labeled Optical Rapid ImmunoAssay) — быстрое иммуноисследование с оптически считываемой меткой коллоидальным золотом. Впервые эта технология была описана для диагностических «сухих» тест-систем «ТгорТ» на кассетах для выявления миокардиального тропонина Т.
Принцип метода заключается в следующем (рис. 7.5). Тест-кассета имеет три отделения:
- аппликационная зона – место нанесения 150 мкл капиллярной или венозной крови. В этой зоне на ворсинчатых элементах иммобилизованы два вида антител к двум различным эпитопам молекулы тропонина Т: моноклональные биотинилированные мышиные антитела и антитела к другому эпитопу молекулы, меченные коллоидальным золотом. В несвязанном состоянии метка – коллоидальное золото – себя не проявляет. После нанесения крови на аппликационную зону растворенные ею антитела транспортируются в следующую зону;
- зона реакции, где происходит связывание тропонина Т с Двумя указанными антителами с образованием «сэндвича», если он присутствует в концентрации выше порогового значения 0,1 нг/мл. «Сэндвич» в крови, непрореагировавшие антитела и кровь в реакционной зоне проходят через находящиеся в ней стекловолокна, отделяясь от эритроцитов. Далее плазма, «сэндвичи» и свободные антитела достигают третьей зоны;
- зона детекции, в которой находятся две полосы. Одна из них – контрольная. В этой области кассеты иммобилизован синтетический пептид – аналог тропонина Т. Поступившие в зону детекции непрореагировавшие, меченные золотом, антитела связываются с этим веществом.
Рис. 7.5. Механизм реакции «GLORIA» и схема устройства аналитической тест-кассеты: а – зона нанесения крови; б – реакционная зона; в – зона детекции
В результате коллоидальное золото проявляет свою окраску в виде контрольной полоски красного цвета. При хорошей стабильности реактивов и правильной постановке теста эта полоса должна появляться всегда, независимо от результата (положительного или отрицательного). Рядом с ней в зоне детекции на так называемой сигнальной линии иммобилизован стрептавидин, который связывает, с одной стороны, непрореагировавшие биотинилированные антитела, а с другой – «сэндвичи» тропонина Т с такими же антителами (биотинилированный конец) и антителами, меченными золотом. В результате коллоидальное золото в этом состоянии может быть обнаружено визуально по окрашенной в красный цвет тестовой полосе, что свидетельствует о положительном результате.
Время считывания результата после нанесения крови – от 3 до 15 мин, оно регистрируется обязательно секундомером и должно быть внесено в специальную наклейку на кассету, на которой выполнен анализ. Таким образом, в случае, если концентрация тропонина Т в крови выше порога чувствительности теста (0,1 нг/мл), появляются две таких полосы — тестовая (сигнальная) и контрольная. Скорость появления тестовой полосы зависит от концентрации тропонина Т: чем выше его концентрация, тем быстрее она появляется.
В тестах, предназначенных для выявления антител, используют антигены, конъюгированные с коллоидальным золотом (например, на кассетах «Uni-Gold НIV») или с коллоидальным селеном (например, в тесте «Dainabot Determine HIV1/2»). В этом случае антигены, иммобилизованные в тестовой зоне на нитроцеллюлозе, представляют собой рекомбинантные или синтетические белки, соответствующие иммунодоминантным участкам искомых антигенов (например, в случае HIV1 это могут быть иммунодоминантные участки оболочечных гликопротеинов gp41, gpl20, при HIV2 – пептид gp36). Аналогичные белки сорбируются на полоске в области контрольной линии (внутренний контроль), кроме того, на полоске абсорбированы и антитела к IgG человека. В технологии «GLORIA» биожидкость при нанесении на полоску растворяет меченные золотом антигены. Присутствующие антитела к HIV1 и/или HIV2 связываются с меченными золотом антигенами и образуют красную полосу в тестовой зоне.
Иммунохромато-графические тесты могут быть основаны на принципе иммуноферментного анализа. Так, диагностическая полоска «Micral» содержит антитела к альбумину, меченные р-га- лактозидазой. После погружения полоски в мочу в связи с хроматографическими свойствами носителя альбумин достигает зоны, где находятся ворсинки, на которых иммобилизованы конъюгированные с ферментом антитела к альбумину. Образуется растворимый комплекс: «альбумин + конъюгированные антитела». Далее этот комплекс и непрореагировавший конъюгат антител продвигаются к зоне реакции через промежуточную зону («ловушку»), в которой иммобилизован альбумин человека. С ним связывается избыток конъюгата антител, а комплекс альбумина с антителами нему, меченными р-галактозидазой, достигает реакционной зоны. Здесь конъюгированная с антителами, связавшимися с альбуми ном Р-галактозидаза становится доступной для реакции с субстратом – хлорфенолом красным-Р-галактозидом. В результате его гидролиза образуется хлорфенол красный, окрашивающий тестовую зону в красный цвет. Для полуколичественной оценки результата интенсивность окраски сравнивают со шкалой, нанесенной на пенал для полосок.
«Сухие тесты» для обнаружения «скрытой крови» в кале
В зависимости от принципа, можно выделить две основные группы методов обнаружения «скрытой крови» – гемоглобина – в кале на основе «сухих» тестов: тесты, использующие псевдопероксидазные свойства гемоглобина (реакция с гваяковой смолой или ортотолидином) и иммунохимические тесты.
Все тесты на «скрытую кровь» в кале выполняют только специалисты, имеющие медицинское образование. «Сухие» тесты с гваяковой смолой основаны на модификации реакции Грегора. Гемоглобин, обладая пероксидазными свойствами, в присутствии пероксида водорода катализирует превращение фенольных соединений в гваяковой смоле в хиноны, имеющие голубую окраску. В состав набора реактивов для этих тестов входят: упакованная в непроницаемую для бактерий извне бумажную или картонную карточку (например, тест «Haemoccult» или «Hexagon OBScreen») хроматографическая бумага; картонные или другие шпатели; реактивы – активаторы реакции (раствор цитрата в этаноле); раствор пероксида водорода в этаноле, развивающий реакцию.
Тест выполняется в картонных картах, которые могут быть открыты с обеих сторон. Одна сторона предназначена для лаборанта или врача, осуществляющего взятие материала для исследования. При ее открытии можно видеть два круга или квадрата хроматографической бумаги (тестовые зоны), на каждый из которых шпателем, вложенным в набор, равномерно наносят из подозрительного участка кал в пределах, ограниченных кругом или квадратом, слева и из 4-5 участков справа. Упаковку закрывают и передают врачу, который открывает ее с обратной стороны и добавляет раствор пероксида водорода. Результат считывают визуально спустя 30 с и не позднее 10 мин с момента нанесения пробы. Присутствие «скрытой крови» обнаруживают по голубому окрашиванию тестовой зоны.
«Сухие» тесты с гваяковой смолой обладают некоторыми недостатками: невысокой чувствительностью и специфичностью (влияние диеты – пероксидаз, содержащихся в пище, в необработанных фруктах и овощах, ложноположительная реакция наблюдается при приеме аскорбиновой кислоты, препаратов железа). Ряд лекарств – ацетилсалициловая кислота, индометацин, фенилбутазон, кортикостероиды и резерпин могут вызвать кровотечение из желудочно-кишечного тракта. Следовательно, за три дня до исследования необходимо назначить особую диету и отменить лекарства.
Тест на диагностических полосках «ОК test» (OK 8) основан на реакции обладающих псевдопероксидазными свойствами гемоглобина и миоглобина с ортотолидином и куменпероксидом, которыми пропитана реагентная зона (положительная реакция на пероксидазу эритроцитов). После нанесения кала на окошко тест- карты полоску «okPHAN» помещают индикаторной зоной вниз и оставляют для протекания реакции на 30 с. Далее цвет индикаторной зоны сравнивают с цветной шкалой на этикетке пенала. Обладает высокой чувствительностью к гемоглобину. Реакция может быть положительной в присутствии пероксидаз бактерий, грибов и некоторых лекарств.
Иммунохимические тесты для обнаружения «скрытой крови» в кале основаны на иммунологической реакции гемоглобина человека с моноклональными антителами, меченым лигандом, обеспечивающим визуализацию положительной реакции. Чаще всего используют иммунохроматографические тесты в кассетах с поперечным током реакционной смеси через пористый матрикс. Различают два основных вида технологий иммунохимических тестов на гемоглобин в кале.
В технологии «GLORIA» используются двойные антитела к разным эпитопам молекулы гемоглобина. Вторая группа тестов основана на реакции гемоглобина с антителами, иммобилизованными на латексных частицах, окрашенных в голубой цвет (набор реактивов «Hexagon OBTI»). Эти антитела иммобилизованы в тестовой зоне, и в случае присутствия в кале «скрытой крови» образующийся комплекс «антиген-антитело» окрашивает тестовую зону в голубой цвет.
Избыток антител, иммобилизованных на латексных частицах, движется к контрольной зоне, в которой иммобилизованы антитела к мышиному IgG против гемоглобина человека, т. е. против тех антител к гемоглобину человека, которые иммобилизованы на латексных частицах, окрашенных в голубой цвет. В результате связывания антител на латексных частицах с этими мышиными антителами образуется контрольная полоса, окрашенная в голубой цвет, которая должна образовываться всегда при правильной постановке теста. Таким образом, в случае присутствия «скрытой крови» в кале (при положительном результате) образуются две окрашенные в голубой цвет полосы.
Как правило, в состав наборов реактивов для этих тестов входят и пробирки для сбора кала, содержащие обычно трис-буфер pH 7,5 и аппликационную палочку (аппликатор), закрепленную в завинчивающейся крышке. После внесения кала аппликатором в буфер пробирку закрывают той же крышкой. Для нанесения нескольких капель экстракта кала на тестовую зону, предназначенную для пробы, верхний конец крышки пробирки отламывают. Ответ в таких тестах готов спустя 2-5 мин. Но отрицательно результат обязательно должен быть подтвержден спустя 10 минут. Эти тесты высокоспецифичны для всех подтипов гемоглобин человека, нет интерференции с гемоглобинами крови различных видов животных кроме приматов.
«Сухие тесты» для коагулологических исследований
Наряду с иммуноаналитическими технологиями обнаружения отдельных компонентов и показателей состояния системы гемостаза в «сухих» технологиях для коагулологических исследований преобладают клоттинговые (от англ. clot – сгусток, сверток) технологии, основанные на образовании в каскаде свертывания сгустка фибрина.
Ранее всего для этих целей в конце 1990-х гг. разработаны прибор и полоска «CoaguChek РТ» для определения протромбинового времени в 25 мкл капиллярной крови. По аналогии с принятым самоконтролем концентрации глюкозы в крови этот прибор и полоски РТ предназначены и для самостоятельного контроля протромбинового времени пациентами, принимающими антикоагулянты.
В полоску вмонтирован прозрачный капилляр, внутри которого иммобилизован кроличий тромбопластин и находятся мельчайшие частицы окислов железа, которые придают капилляру серую окраску. После того как полоску помещают в прибор - отражательный фотометр, на ее тестовую зону наносят кровь. Попадая в электромагнитное поле, которое создается под капилляром, окислы железа вращаются по определенной траектории, и, таким образом, при попадании света от источника можно зарегистрировать определенный сигнал от отраженного света.
После взаимодействия крови с тромбопластином в капилляре полоски протромбин превращается в тромбин, последний в присутствии ионов кальция вызывает превращение фибриногена в фибрин. Образующиеся сгустки фибрина наматываются на металлические частицы окислов железа, приостанавливают их вращение в магнитном поле, вызывая образование из них конгломератов, отражение света от которых имеет другую характеристику, чем при первоначальном измерении.
Далее разница в результатах измерения отражения света преобразуется в окончательный показатель протромбинового времени, который может быть с помощью этого прибора выражен во всех приемлемых для этого показателя единицах: секундах, процентах содержания факторов протромбинового комплекса у здоровых людей (по Квику), в величине отношения протромбинового времени у пациента к аналогичному показателю у здоровых людей или в виде международного нормализованного отношенй. Результаты последних 60 измерений хранятся в памяти прибора.
Другой вариант клоттингового метода определения протромбинового времени использован в так называемой картриджной технологии «сухих» тестов на другом приборе «CoaguChek Pro System». Картридж представляет собой похожее на миниатюрную кассету устройство с несколькими полостями, в которых содержатся лиофилизированные реактивы, иногда и растворитель, необходимые для выполнения теста.
При введении в картридж пробы биожидкости она растворяет все реагенты в последовательности, определяемой расположением каналов, соединяющих полости (камеры) картриджа, подвергается воздействию реагентов и результат анализа может быть зарегистрирован оптически или электрохимически. Чаще всего применяют миниатюрные картриджи из прозрачного пластика, содержащие все необходимые для анализа реактивы, вызывающие образование окрашенного соединения. По измерению светопоглощения этого соединения в измерительном приборе можно рассчитать концентрацию аналита. Определение протромбинового времени с помощью этого теста начинается с помещения предназначенного для него прозрачного картриджа в прибор.
Картридж состоит из ячейки для пробы, реакционной камеры и реакционного «пути». После считывания кода и номера анализа картридж прогревается в приборе, капля свежей капиллярной или венозной крови помещается в ячейку для пробы. Под действием капиллярных сил кровь движется в реакционную камеру, где смешивается с реактивами и начинает свертываться. Кровь продолжает двигаться по реакционному пути до тех пор, пока не завершится образование сгустка. Лазерная оптическая система осуществляет слежение за током крови, конечная точка реакции характеризуется остановкой тока крови. Время с момента нанесения крови до детекции образования сгустка — протромбиновое время.
Следует особо отметить для этой системы, что прослеживае- мость результатов, получаемых для протромбинового времени на ней с помощью картриджной технологии, была достигнута путем сравнения результатов с данными механического клоттингового теста в пробирках и сравнения с описанной выше технологией для протромбинового времени на полосках с использованием сертифицированного в рамках Всемирной организации здравоохранения (ВОЗ) референтного калибровочного материала «CRM 149 S».
Существуют электронные контрольные картриджи, позволяющие ежедневно проводить контроль качества на двух уровнях значений протромбинового времени, а кроме того, есть и контрольные материалы для этой системы.
Таким образом, описанная система основана на достаточно высокоорганизованной технологии, которая иногда заявляется как «золотой стандарт» применительно к коагулологическим исследованиям, которые характеризуются особыми требованиями к аналитической фазе – взятию, обработке и хранению материи перед исследованием. В данном случае система для анализа результатов лечения не требует обработки крови, получения плазмы каких-либо манипуляций с ней, хранения, транспортировки и большей вероятностью и достоверностью может отражать истинное состояние исследуемого показателя системы гемостаза в крови пациента.