Электрофоретическое исследование сывороточных белков
Принцип метода
Белки являются амфотерными электролитами; т. е. каждый белок может обладать как кислыми, так и щелочными свойствами в зависимости от pH среды, в которой он находится. В кислых растворах белки ведут себя как щелочи, т. е. движутся в электрическом поле к катоду; в щелочных растворах они ведут себя, как кислоты и передвигаются к аноду. При электрофорезе белковых растворов обычно пользуются щелочными буферными растворами, в которых большая часть белков ведет себя как кислоты и движется к аноду.
Скорость движения различных белков в электрическом поле различна и зависит от отношения величины заряда белка к его массе. В строго одинаковых условиях электрофореза эта скорость является величиной постоянной для каждого индивидуального белка. В сложных белковых смесях, таких, как сыворотка крови, присутствует несколько десятков индивидуальных белков, которые путем электрофореза можно разделить на четыре основные группы: альбумины, а-, р- и у-глобулины. Эти фракции делятся на ряд подфракций: а, аr-глобулины и т. д. При рН=8,6 все эти белки в электрическом поле движутся по направлению к аноду, поскольку они обладают в этих условиях отрицательным зарядом. При этом наиболее быстро движутся альбумины, затем а-глобулины, за ними – глобулины и, наконец, у-глобулины (рис. 2).
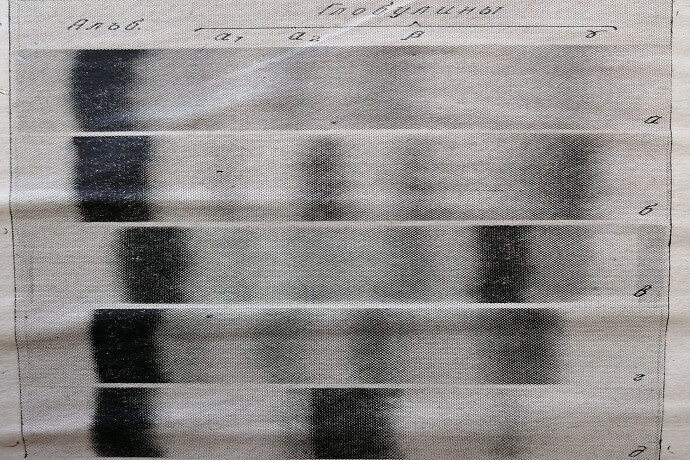
Рис. 2. Электрофореграммы белков сыворотки крови здорового человека (а) и лиц, страдающих различными заболеваниями (б–д).
Аппаратура
- Прибор для электрофореза на бумаге: ЭФА-1.
- Фотоэлектроколориметр для определения количества элюированного из электрофореграмм красителя или специальный прибор (денситометр), позволяющий определять содержание красителя прямо на бумаге без предварительного его извлечения.
Посуда
- Пробирки с притертыми пробками на 15-20 мл.
- Пробирки химические.
- Склянки с притертыми пробками на 30 мл.
- Микропипетки на 0,1 мл.
- Пипетки на 2, 5 и 10 мл.
- Мерный цилиндр на 50 мл.
Реактивы
- Веронал.
- Мединал.
- Бромфеноловый синий.
- Сулема.
- Ледяная уксусная кислота.
- Сине-черный краситель.
- Метиловый спирт.
- Вазелиновое масло для пропитывания фореграмм перед пропусканием их через денситометр.
- 4% раствор углекислого натрия.
- 0,01 н. и 0,005 н. растворы едкого натра.
- Хроматографическая фильтровальная бумага № 4 М, выпускаемая Ленинградской бумажной фабрикой имени Володарского.
- Веронал-мединаловый буферный раствор с pH = 8,6. Состав буфера: 10,32 г мединал а растворяют в 300 мл дистиллированной воды, добавляют 1,84 г веронала, нагревают на водяной бане до растворения веронала. Доводят объем раствора дистиллированной водой до 1 л и тщательно взбалтывают.
- Растворы для окраски электрофореграмм:
а) Окраска бромфеноловым синим. Состав краски: растворяют 0,5 г бромфенолового синего й 10 г сулемы в 20 мл ледяной уксусной кислоты с добавлением 20–50 мл воды; после растворения доводят объем до 1 л дистиллированной водой; несвязавшуюся с белками краску отмывают 2% раствором уксусной кислоты.
б) Окраска сине-черным красителем (амидошварцем). Состав краски: растворяют 0,2 г кислотного синечерного красителя в 100 мл ледяной уксусной кислоты и добавляют 900 мл метилового спирта. Электрофореграмму промывают метиловым спиртом, содержащим 10%' уксусной кислоты. - Растворы для элюирования окраски:
а) щелочной метанол: 4% раствор углекислого натрия (ЫагСОз) и метиловый спирт в отношении 1 : 1 или
б) 0,005 или 0,01 н. раствор едкого натра.
Ход анализа
Электрофорез проводят на полосах бумаги, ширина и длина которых зависит от конструкции прибора. Для прибора ЭФА-1 полосы 3,5X44 см. Вся бумага должна быть нарезана одинаково: либо вдоль, либо поперек. На бумаге не должно быть складок или загрязнений. На каждой полосе простым карандашом проводят поперечную тонкую полоску, отмечая середину, и на одном из концов на расстоянии 6–12 см от края – вторую полоску – будущее место нанесения сыворотки. Все записи делают также простым карандашом на расстоянии 5–9 см от того же края. Затем полоску помещают в камере таким образом, чтобы концы ее были погружены в жидкость, налитую во внутренние кюветы; при этом конец ее, на котором сделаны записи, должен быть обращен к катоду. Кюветы предварительно заполняют буферным раствором до одинакового уровня.
Наносить сыворотку нужно на влажную бумагу, поэтому последнюю предварительно смачивают буферным раствором и слегка отжимают между листами фильтровальной бумаги.
На бумажную полосу обычно наносят 0,01 или 0,005 мл негемолизированной цельной сыворотки, которую отмеряют при помощи обычной микропипетки емкостью на 0,1 мл. Лучше наносить сыворотку на середину бумажной полосы не в виде капли, а в виде поперечной полоски при помощи шлифованного предметного стекла (ширина 1,5 см). Для этого исследуемую пробу размазывают по краю стекла, а потом, повернув стекло каплей вниз, прикладывают его под острым углом к поверхности бумаги и придерживают в этом положении несколько секунд, пока сыворотка не впитается в бумагу.
Электрофоретическое разделение сыворотки на бумаге можно проводить в течение 6–24 часов при градиенте потенциала от 3 до 8 V на 1 см пути тока.
Режим работы прибора вырабатывается для каждого частного случая и зависит от силы и напряжения тока, природы и pH буферного раствора, длины и ширины бумажных полос, их количества, а также от толщины бумаги и температуры. Если, например, в аппарате находится четыре бумажные полосы, каждая шириной в 3,5 см, то допустима сила тока в 6 мА и электрофорез длится 10 часов. Некоторые исследователи проводят электрофорез на холоде (3–10°), однако можно получить хорошие результаты, проводя электрофорез и при комнатной температуре (даже если она равна 25°).
По окончании электрофореза выключают ток, вынимают бумажные полосы и помещают их на рамочку для просушивания. Недопустимо при этом, чтобы стекло касалось тех участков бумаги, где может быть белок Ра.Полоску с бумажными полосами помещают в термостат при 90° на 10 минут.
Окраску фореграмм производят погружением электрофореграммы в ванночку с красителем. При этом нельзя допускать, чтобы бумажные полосы складывались или мялись в тех местах, где может быть белок. Нужно избегать также и накладывания одной бумажки на другую. При окраске бромфеноловым синим электрофореграммы погружают в краситель на 25 минут, затем краситель сливают и в кювету с фореграммами наливают 2% раствор уксусной кислоты на 30 минут. Промывающую жидкость несколько раз меняют до тех пор, пока участки бумаги, свободные от белка, не станут совершенно белыми.
При окраске кислотным сине-черным красителем бумажки помещают в раствор на 20 минут и затем в промывную жидкость на 30 минут. Сменяют промывную жидкость несколько раз.
После промывания фореграммы высушивают при комнатной температуре. После окраски на электрофореграмме выявляется четыре пятна, соответствующих альбумину, а-, (3- и у-глобулинам. Часто а-глобулины разделяются на (ц- и аг-глобулины; 3-глобулины на две фракции подразделяются реже.
Определение соотношения количеств белка в отдельных фракциях проводят либо с помощью денситометра, либо путем элюирования краски из бумажных полос. Первый способ проще и менее трудоемок, второй более точный.
Определение соотношения количеств белка в отдельных фракциях с помощью денситометра
Перед обработкой бумажных лент на денситометре их пропитывают вазелиновым маслом. При этом необходимо избегать образования пузырьков воздуха. Избыток масла удаляют путем промокания между двумя листами фильтровальной бумаги. Подготовленную полоску вставляют в денситометр так, чтобы против щели находился неокрашенный участок бумаги. Писчик денситометра настраивают на нуль, после чего включают записывающее, а потом протягивающее устройство. Полученная кривая позволяет судить о количестве фракции и вычислить соотношения между содержанием белка в них. Для этого проводят основную линию, соединяющую начало и конец кривой, и полученную площадь делят на участки вертикальными линиями, проведенными из точек минимумов между белковыми пиками. Количество белка в каждой фракции пропорционально площади этой фракции. Для определения этих площадей можно пользоваться планиметром, но точнее их можно определить весовым способом. В последнем случае вырезают всю кривую (или копию ее, переведенную на плотную бумагу) и взвешивают на торсионных весах. Полученную величину принимают за 100%. Затем разделяют кривую на намеченные ранее участки по минимумам между пиками, взвешивают каждый из них в отдельности и вычисляют процентное содержание белка в каждой фракции.
Определение соотношения отдельных фракций путем извлечения краски из бумаги и колориметрического определения ее количества
Электрофореграмму разрезают на поперечные полосы шириной 0,5 см и помещают в отдельные пробирки. В каждую пробирку добавляют в зависимости от типа колориметра, на котором производят определение, от 1,5 до 5 мл экстрагирующего раствора. Кислотный сине-черный краситель элюируют 0,1 н. раствором едкого натра. Бромфеноловый синий элюируют 0,005 н. раствором едкого натра или щелочным метанолом. Элюиция протекает при комнатной температуре в течение часа. Окраску жидкости в пробирках колориметрируют с нейтральным фильтром при помощи фотоэлектроколориметра ФЭК-М на правом барабане в кюветах, с рабочей длиной в 20 мм.
При извлечении бромфенолового синего 0,005 н. раствором едкого натра окраска элюата постепенно изменяется и поэтому необходимо колориметрировнть пробы сразу же после окончания элюиции. В щелочном метаноле окраска очень стабильна и не изменяется в течение нескольких дней.
На основании полученных данных строят кривую распределения краски по длине электрофореграммы и получают картину, подобную вычерченной денситометром. По этой кривой определяют соотношение отдельный фракций совершенно также, как и по денситометру.
Описанный способ весьма трудоемок. Легче разделить электрофореграмму по границам между фракциями и элюировать каждую из полученных фракций в отдельности. Электрофореграмму разрезают по этим границам на четыре–пять частей. Каждую часть помещают в колбочку. К альбуминовому участку прибавляют 30 мл, а к глобулиновым – по 10 мл 0,005 н. раствора едкого натра; Контролем служит 0,005 н. раствор щелочи. Колориметрируют при тех же условиях. После колориметрирования общее количество найденной краски принимают за 100 и вычисляют процентное содержание отдельных фракций.
Бромфеноловый синий неравномерно связывается с различными фракциями сывороточных белков, поэтому большинство исследователей умножают полученные для глобулинов величины на коэффициент 1,6. Однако разные глобулины обладают, по-видимому, различными коэффициентами, которые изменяются при разных заболеваниях. Поэтому некоторые авторы не рекомендуют пользоваться коэффициентом, а считают более правильным определять при данном способе окраски соотношение между отдельными фракциями сывороточных белков у группы здоровых людей и в Дальнейшем изучать отклонения от этого соотношения при том или ином заболевании.
При помощи электрофореза на бумаге определяется лишь соотношение между отдельными фракциями сывороточных белков. Параллельно этому необходимо каким-либо иным методом (по Кьельдалю, рефрактометрически и т. д.) определить общее содержание белка и вычислить абсолютное количество в крови отдельных фракций сывороточных белков.
Расчет
При количественном определении белковых фракций сыворотки крови, основанном на элюировании краски с полоски бумаги, производят сначала расчет относительных процентов. Для этого показания фотоэлектроколориметра (умноженные на 1000 для простоты расчета) при колориметрировании фракции альбуминов умножают на 3, так как альбумины элюированы 30 мл раствора, а остальные фракции – 10 мл. К полученному произведению прибавляют показания всех глобулиновых фракций.
Например, показание ФЭК для альбуминов составляет 0,255.
255X3=765.




