Электрофоретическое исследование тканевых белков
Принцип метода
Тот же, что и предыдущего.
Аппаратура
- Стеклянный гомогенизатор (можно изготовить в стеклодувной мастерской из толстого стекла) с моторчиком мощностью 25V, укрепленном на металлическом штативе, включают в сеть через реостат.
- Центрифуга с охлаждением.
- Аппарат Боброва для вливаний. Если аппарата Боброва нет, используют обычную склянку с тубусом, поместив ее на 1–2 м выше стола.
- Аппарат для электрофореза на бумаге и вся аппаратура, которая необходима для проведения электрофореза белков сыворотки крови.
Посуда
- Конические колбы на 100 мл с притертой пробкой.
- Та же, что и в предыдущем методе.
Реактивы
- 0,85% раствор хлористого натрия.
- Эфир (для наркоза или обычный серный эфир).
- Бутиловый спирт.
- Жидкий азот или сухой лед.
- Те же, что и в предыдущем методе.
Ход анализа
Экстрагирование белков. Промывание органов от крова (перфузия органов)
Для того чтобы удалить из органа белки сыворотки, которые могут значительно исказить электрофоретическую картину собственных белков органов, необходимо предварительно отмыть исследуемый орган от крови. Лучше всего это сделать путем перфузии. Нужно отметить, что при перфузии возможно удаление также и некоторой части белков органа, однако эти потери настолько незначительны, что практически ими можно пренебречь.
Перфузию лучше всего проводить при помощи аппарата Боброва. В место иглы иногда пользуются канюлей, на шланге ближе к канюле хорошо поместить стеклянный кран или перекрывать его с помощью пеана.
Перфузию проводят физиологическим раствором.
1. Перфузия печени крыс через верхнюю полую вену:
- немедленно после умерщвления вскрывают брюшную и грудную полости животного, поворачивают его головой к экспериментатору и осторожно, приподняв пинцетом диафрагму, обрезают все видимые тяжи, идущие от нее к печени;
- накладывают лигатуру на верхнюю полую вену как можно ближе к печени;
- для удаления пузырьков воздуха открывают кран перфузирующего устройства так, чтобы жидкость текла не очень сильной струей;
- делают надрез на верхней полой вене ниже лигатуры, стараясь произвести его одним движением ножниц;
- вставляют канюлю в разрез вены; для этого нужно, чтобы ток жидкости из канюли в этот момент был не очень сильным, но достаточным для удаления вытекающей из разреза крови с таким расчетом, чтобы разрез был хорошо виден экспериментатору; направив ток жидкости на место разреза, тем самым расширяют его и легко входят канюлей в отверстие вены;
- хорошо затягивают лигатуру на вставленной канюле, сразу после этого печень начинает набухать и бледнеть; во время перфузии хорошо слегка массировать отдельные места печени: это ускоряет перфузию; перфузия считается законченной, когда печень приобретает бледно-желтую окраску без красных или розовых участков.
2. Перфузия почек крыс через брюшную аорту:
- после вскрытия брюшной полости животное кладут головой от экспериментатора;
- накладывают лигатуру на брюшную аорту;
- открывают кран перфузионного аппарата; перфузию проводят не канюлей, а толстой иглой от шприца;
- вставляют иглу в брюшную аорту и завязывают на ней лигатуру; перфузия закончена, когда почки приобретают желто-серую окраску;
3. Прижизненная перфузия всего организма.
Иногда необходимо исследовать одновременно два или несколько органов. В этом случае удобно перфузировать целиком все животное. Кроме того, при такой перфузии легко отмыть от крови мозг и другие органы, трудно промываемые иным путем. Обычно эту операцию проводят под наркозом. У крыс лучше всего проводить такую перфузию через верхнюю полую вену. Для хорошей перфузии необходим большой напор жидкости, который может обеспечить аппарат Боброва.
Вскрывают грудную полость. Накладывают лигатуру на верхнюю полую вену у ее впадения в сердце. Канюлю вводят в нее так же, как и при перфузии печени. Лигатуру завязывают, после чего верхнюю полую вену вскрывают выше места введения канюли. При таком способе перфузии легко отмыть от крови легкие, мозг, а также все внутренние органы.
Гомогенизирование тканей
После перфузии орган извлекают, слегка подсушивают на фильтровальной бумаге, освобождают от соединительной ткани и измельчают ножницами (все операции производят при охлаждении). Затем 8–10 г кашицы переносят в гомогенизатор добавляют необходимое количество жидкости и гомогенизируют 3–5 минут, также при охлаждении.
В стеклянном гомогенизаторе хорошо измельчаются печень, почки, мозг, легкие; мышцы лучше гомогенизировать в специальном гомогенизаторе с металлическими ножичками.
Извлечение растворимых белков
Способы извлечения белков из органов различны для разных органов, а также и для одного и того же органа в зависимости от цели исследования. Опишем три основных способа, служащих для извлечения растворимых белков из печени и почек.
Первый способ – извлечение белков физиологическим раствором. 8 г печени гомогенизируют с 4 мл физиологического раствора. Гомогенат выливают в коническую с притертой пробкой колбочку ёмкостью 100 Мл (предварительно охлаждённую) и добавляют 3-4 мл эфира. Встряхивают. Эфир поглощается гомогенатом. Добавляют еще 3-4 мл эфира, снова встряхивают и так повторяют много раз, добавляя постепенно все большие и большие порции эфира до тех пор, пока он поглощается гомогенатом. Гомогенат при этом густеет и увеличивается в объеме. Когда эфир после встряхивания сразу начинает отслаиваться на поверхности гомогената, обработку эфиром прекращают. Загустевший гомогенат центрифугируют при 3–4°. Если в лаборатории нет центрифуги с охлаждением, можно обычную небольшую центрифугу поместить в холодильник. Можно поступить и иначе: центрифугирование вести в больших гильзах и пространство между гильзой и вставленной в нее пробиркой забить льдом, снегом или смесью их с небольшим количеством хлористого натрия. В последнем случае нужно следить, чтобы гомогенат в пробирке не успел замерзнуть.
Центрифугировать необходимо в течение 20 минут при 2500–3000 об/мин. После центрифугирования в пробирке образуется три слоя: верхний – эфир, средний – нерастворившаяся «пробка» и нижний – экстракт. Нижний слой осторожно отсасывают из-под «пробки». Для этого можно воспользоваться пастеровской пипеткой или любым капилляром с загнутым концом. Избегать попаданий кусочков «пробки» в экстракт.
Полученный таким образом экстракт обычно бывает прозрачный или слегка опалесцирующий. Его уже можно употреблять для электрофоретических или других исследований, однако в нем содержится большое количество очень неустойчивого белка, легко выпадающего в осадок. Чтобы освободить экстракт от этого белка, раствор помещают в центрифужную пробирку и нагревают в водяной бане при 37° в течение 15 минут, затем вынимают пробирку (осторожно, не встряхивая!) и оставляют при комнатной температуре на 15-30 минут до тех пор, пока образовавшийся осадок не начнет отстаиваться. После этого (не встряхивая!) осторожно помещают пробирку в центрифугу и центрифугируют без охлаждения в течение 7 минут при 2500 об/мин. Совершенно прозрачный экстракт содержит около 2% белка. Он может храниться до следующего дня в холодильнике, однако для электрофореза на бумаге лучше его употреблять в день получения.
Второй способ – извлечение физиологическим раствором после замораживания. 8 г печени гомогенизируют с 8 мл физиологического раствора. Гомогенат переливают в ступку и туда же наливают жидкий азот. Быстро, пока гомогенат не замерзнет, его растирают жидким азотом, дают ему несколько оттаять при комнатной температуре и не совсем оттаявшую кашицу снова замораживают жидким азотом. Эту процедуру производят трижды. После последнего замораживания накрывают ступку часовым стеклышком и помещают в холодильник в отделение для льда. На следующий день дают гомогенату оттаять при комнатной температуре, встряхивают его с равным объемом эфира и центрифугируют при охлаждении в течение 30 минут при 2500–3000 об/мин. Полученный прозрачный экстракт содержит около 4% белков, т. е. больше, чем экстракт, полученный первым способом. При электрофорезе на бумаге белки в нем хорошо разделяются.
Вместо жидкого азота можно растирать гомогенат с сухим льдом.
Третий способ – извлечение с применением бутаанола. Этот способ рекомендуется в том случае, если необходимо более полно экстрагировать белки, в частности альбумин из печени. 4 г кашицы печени гомогенизируют с 4 мл физиологического раствора и 4 мл бутанола. Полученный густой гомогенат переносят в центрифужную пробирку и центрифугируют с охлаждением в течение 15 минут при 2500-3000 об/мин. Отсасывают нижний слой жидкости из-под нерастворившейся «пробки» и переносят в центрифужную пробирку. Встряхивают экстракт с равным объемом эфира и центрифугируют 5 минут при охлаждении. Капилляром с помощью насоса отсасывают верхний: слой эфира и тонкую пленочку, иногда образующуюся на границе двух слоев. Еще два раза встряхивают экстракт с равным объемом эфира для удаления оставшегося бутанола. Полученный таким образом экстракт из печени содержит больше альбуминов и а-глобулинов, чем экстракт, полученный первым и вторым способами, но глобулины в нем при электрофорезе менее четко отделяются друг от друга.
Получение экстрактов из других органов
Хорошее электрофоретическое разделение белков получается при экстрагировании белков из почек по первому и второму способам. Второй способ с успехом применяют также для экстракции белков из мозга. Есть основание думать, что оба эти способа будут пригодны для экстракции белков из слизистой желудочно-кишечного тракта, легких и других органов.
Экстракцию проводят следующим образом. Ткань растирают в ступке с фосфатным буфером pH=7,2 и оставляют на 4–24 часа при температуре 3–4 или 20°. Затем смесь центрифугируют от 30 до 90 минут при 1200– 22 000 g. Полученный центрифугат подвергают электрофорезу на бумаге.
Электрофорез на бумаге полученных, экстрактов тканевых белков. Так как содержание белка в тканевых экстрактах меньше, чем в сыворотке, их нужно наносить на бумагу в больших количествах. Экстракты из печени и почек, содержащие 2–4 части белка, наносят обычно по 2 раза на одно место, беря каждый раз по 0,02 мл. Всю операцию нанесения экстракта нужно выполнять возможно скорее, так как бумажные полосы подсыхают и нанесенные белки могут быть смыты новыми порциями впитывающегося буфера. Это очень нежелательно, особенно при работе с тканевыми белками. Для быстрого нанесения белков необходимо иметь несколько микропипеток – по числу исследуемых жидкостей. Лучше всего в камеру, имеющую шесть полос, наносить следующие растворы: 1) сыворотка нормального животного; 2) и 3) две параллельные полосы, на которые наносится экстракт ткани нормаль-ного животного; 4) и 5) две полоски с экстрактом той же ткани больного животного; 6) сыворотка того же больного животного. Нанесение проводят не последовательно на каждую полоску, а параллельно, т. е. сначала наносят белки по первому разу на все полоски, а затем по второму разу наносят экстракты из органов (если необходимо, можно наносить и по третьему разу и т. д.). Жидкость в пипетки лучше набирать один раз и оставлять пипетки в горизонтальном положении, спуская постепенно по 0,02 мл для каждого нанесения.
После окончания нанесения немедленно закрывают камеру крышкой и включают ток. Напряжение 220 V при силе тока 4–8 мА. Прибор оставляют включенным на 16–18 часов. По окончании электрофореза фореграммы просушивают и окрашивают так же, как это описано в предыдущем методе.
Оценка электрофореграмм и разделение их на фра к ц и и. В экстрактах из таких органов, как печень и почки, обнаруживается много белковых фракций, приблизительно одинаковых по содержанию белка, так что в ряде случаев трудно идентифицировать ту или иную фракцию.
Чтобы быть уверенным в правильности такой идентификации, всегда необходимо параллельно с тканевым экстрактом подвергать электрофорезу сыворотку нормального животного, где идентификация фракций не представляет трудности. На рис. 3 видно, что при сопоставлении электрофореграмм печени крыс с электрофореграммой их сыворотки становится легко узнать отдельные фракции. Если обозначить белковые фракции печени буквами русского алфавита, то фракцией А обозначается то место электрофореграммы печени, которое соответствует месту расположения сывороточного альбумина.
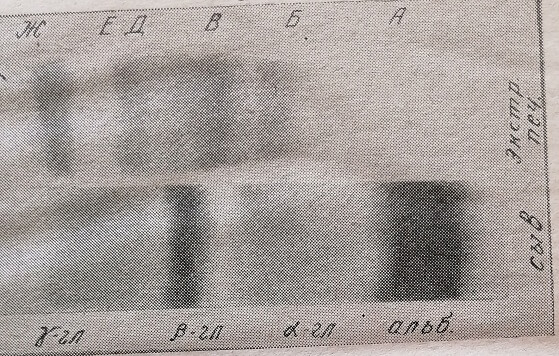
Рис. 3. Электрофореграммы на бумаге растворимых белков печени.
Фракцией Б обозначается место электрофореграммы, соответствующее а-глобулинам, т. е. расположенное между А и В. Фракция В всегда четко выражена, и ее легко найти по характерному расположению на границе между а- и р-глобулинами сыворотки. Фракция Д расположена напротив р-глобулинов сыворотки. Фракцию Ж также легко узнать, так как обычно она располагается за пределами у-глобулинов сыворотки и часто делится на два пика. Фракция Е хорошо выражена и легко определяется по расположению в зоне у-глобулинов ближе к р-глобулинам сыворотки. Что касается фракции Г, которая хорошо отделяется от других при электрофорезе по методу подвижных границ, при электрофорезе на бумаге она чаще всего сливается с фракцией В или Д.
В экстрактах, полученных описанными выше методами из почек крыс, при электрофорезе на бумаге легко обнаружить 6 белковых фракций. При электрофорезе в аппарате Тизелиуса всегда четко выявляется еще одна фракция, обозначаемая первой фракцией, так как она движется к аноду быстрее сывороточного альбумина. Ввиду очень незначительного содержания белка в этой фракции (1–3% общего количества в экстракте) при электрофорезе на бумаге ее обнаружить не удается. Фракция II, имеющая подвижность альбуминов, обычно обнаруживается и при электроферезе на бумаге (рис. 4). Следующий за ней пик – фракция III – не имеет аналогов в сыворотке, ее узнают по расположению в зоне а-глобулинов. Характерное расположение на границе между а- и р-глобулинами сыворотки- имеет всегда хорошо выраженная функция IV. Фракции V и VI двигаются при электрофорезе параллельно, соответственно р- и у-глобулинам сыворотки.
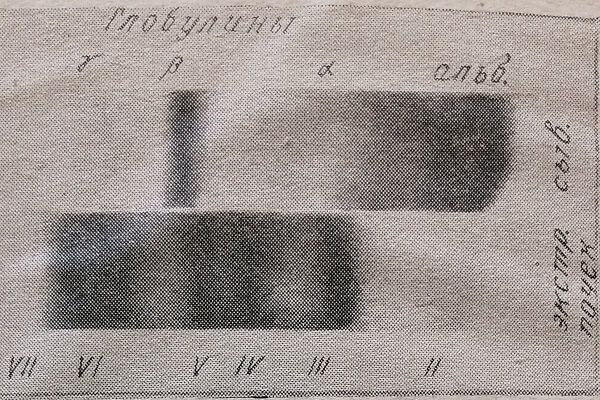
Рис. 4. Электрофореграммы на бумаге растворимых белков почек и сыворотки крыс.
Последняя, VII, фракция, так же как и в печени, располагается за пределами у-глобулинов сыворотки и обычно благодаря электроосмосу смещается на бумаге в сторону катода.
Определение соотношения количеств белка в отдельных фракциях
Полученные фореграммы обрабатывают так же, как и фореграммы, полученные после электрофореза сывороточных белков, с той лишь разницей, что при разделении фореграмм на отдельные фракции к каждому добавляют по 5 мл элюирующей жидкости.
Расчет
Количество белка в отдельных фракциях вычисляют так же, как это указано для расчета белковых фракций сыворотки крови. Однако не следует при расчете использовать коэффициент 1,6, рассчитанный для сывороточных белков.




