Техника определения сухой массы клеток крови
Приготовление препаратов для интерференционной микроскопии (общие требования)
Приготовление препаратов для интерференционной микроскопии требует строгого выполнения определенной технологии. Необходимо поддерживать на постоянном уровне pH среды и осмотическое давление, условия фиксации и промывки препаратов. Ошибки на этом этапе приводят к нарушению целостности клеточных мембран, выходу внутриклеточного содержимого или, наоборот, проникновению веществ, содержащихся в среде, внутрь клетки, что существенно искажает значения измеряемых показателей. При недостаточном промывании на поверхности клеток могут оставаться адсорбированные посторонние вещества, завышающие истинную величину сухой массы. Следует помнить и о том, что самые разнообразные изменения в биологических объектах, в том числе и в клетках крови, может вызывать фиксация. Так, формалин, проникая в клетку, химически связывается с ее веществом. Кислые фиксаторы гидролизуют белки и нуклеиновые кислоты, спиртовые – растворяют липиды, водные – углеводы. Фиксация приводит к денатурации белков, в результате чего препарат становится менее гомогенным. Она часто изменяет величину показателя преломления объекта и удельного приращения показателя преломления.
Следовательно, для получения сопоставимых и надежных результатов нужно строго соблюдать технику приготовления препаратов. При этом ошибка в измерениях количества плотных веществ в клетке не превысит 15–20%.
Забор крови и приготовление препаратов для определения сухой массы эритроцитов
Для определения сухой массы эритроцитов забор осуществляется следующим образом. Делается прокол пальца на глубину 2–3 мм. Чтобы клетки находились на некотором расстоянии, удобном для интерферометрии, капля крови, свободно вытекающая из ранки смешивается на предметном стекле с раствором Хэнкса без индикатора или с фосфатным буфером (pH 7,2–7,4) в соотношении 1:2 или 1:3. Из разведенной капли крови готовятся тонкие мазки на чистых хорошо обезжиренных предметных стеклах без царапин. Мазки высушиваются на воздухе. Для лучшей сохранности препаратов их следует фиксировать в абсолютном метиловом спирте в течение 3–5 минут.
Интерферометрические измерения эритроцитов проводятся в камере. Для ее изготовления на мазок в его тонкой части наносится капля дистиллированной воды и покрывается покровным стеклом. Для предохранения препарата от высыхания во время измерений края камеры герметизируются вазелином.
У животных (мышей и крыс) кровь забирается из хвостовой вены, а препараты готовятся описанным выше способом.
Забор материала и приготовление препаратов для изучения сухой массы лимфоцитов
Проведение интерферометрических исследований лимфоцитов возможно только на чистой популяции лимфоидных клеток, поэтому их необходимо выделить из крови и кроветворных органов.
Известно, что клетки крови различаются по таким интегральным показателям, как размеры, плотность, электрический заряд, свободная энергия клеточной поверхности и др. Установлено, что эти физические характеристики клетки коррелируют с особенностями ее структуры и функции. На основании различий физических свойств разработан целый ряд способов фракционирования гетерогенных клеточных популяций. Одним из них является метод изоплотностного осаждения (получение фракций клеток с одинаковой плотностью). Его физическая сущность состоит в следующем. Клетка, помещенная в градиент плотности и находящаяся под действием центробежной силы, движется через градиент до тех пор, пока не достигнет слоя, плотность которого равна или больше плотности данной клетки. В этом положении равнодействующая сил, приложенных к клетке, равна нулю, в связи с чем клетка не будет менять своего положения. Наиболее часто используется разделение двух типов клеток, имеющих плотности Pi и Рг на слое вещества с плотностью Рз, причем Р1<Рз<Рг. В этом случае после центрифугирования клетки с плотностью Рг окажутся в осадке, а с плотностью Pi в интерфазе между слоем жидкости, в которой первоначально были клетки, и слоем вещества с плотностью Рг.
Метод изоплотностного осаждения нашел широкое применение для выделения лимфоцитов периферической, крови. Однако его использование требует выполнения целого ряда условий, необходимых для сохранения жизнеспособности клеток в процессе процедуры фракционирования. Эти требования изложены в работах Leif (1970), Kneece, Leif (1971), Williams, Shortman (1972), Rikwood (1978), Bast et al. (1979), Hokland, Heron (1980) и др. и приведены в обзоре А. Ю. Сунгурова (1983). Главными из них являются: использование изоосмотичной, нетоксичной, легко отделяемой от клеток, минимально вязкой среды, стабильной при физиологических значениях pH; плавность изменения скорости вращения центрифуги, умеренные перегрузки; отсутствие агрегации клеток. Несоблюдение этих условий может привести к повреждению клеток, появлению артефактов, затрудняющих оценку и интерпретацию полученных результатов.
Из градиентформирующих сред, использующихся для выделения лимфоцитов, наибольшее применение нашла смесь, состоящая из фиколла и гипака.
Фиколл представляет собой полисахарид, с молекулярной массой 300–400 тыс. дальтон. Гипак (изопак) – это метриозат, или диазотриозат натрия, имеющий плотность 1,200 г/мл. Основная смесь состоит из 10 частей 34% гипака (32,8% изопака) и 24 частей 8–9% раствора фиколла, приготовленных на дистиллированной воде. Плотность смеси должна равняться 1,077 г/мл.
В состав градиента вместо гипака (изопака) могут входить другие рентгеноконтрастные вещества с высокой плотностью. Например, часто используется смесь из 12 частей 9% фиколла и 5 частей 33,9% верографина (плотность 1, 077 г/мл).
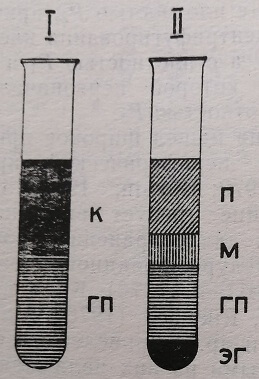
Рис. 18. Выделение лимфоцитов крови на градиенте плотности крови, нанесенной на градиент до центрифугирования; 11 – кровь после центрифугирования; К – кровь; ГП – градиент плотности; П – плазма; М – интерфазный слой мононуклеаров; ЭГ – осадок эритроцитов и гранулоцитов
Забор крови для выделения лимфоцитов производится из пальца (или пятки у новорожденных детей) в количестве 1>5 2 капилляров для СОЭ, которые предварительно промываются раствором гепарина. Гепарин готовится на среде 199 в концентрации 20 ед/мл. Взятая кровь тщательно смешивается с 10% раствором желатины и гепарина (концентрация 20 ед/мл) в соотношении 2:1:1.
Перед проведением исследования раствор верографина (15,2%) подогревается до комнатной температуры и разливается в преципитационные пробирки из оргстекла. Кровь, разведенная гепарином и желатиной, с помощью пастеровской пипетки осторожно наслаивается таким образом, чтобы соотношение градиент – клеточная взвесь было равно 5:1. Пробы центрифугируются при комнатной температуре 17–20 минут с центробежным ускорением 400 g <1500–2000 об/мин). В результате клетки, имеющие различную удельную плотность, разделяются. Лимфоциты и моноциты остаются на поверхности градиента. Эритроциты и гранулоциты.
Полученные интерфазные кольца вместе с верхним слоем жидкости осторожно, чтобы не захватить раствор верографина, отсасываются пастеровской пипеткой и переносятся в пробирки со средой 199 для отмывания клеток от градиента. Клеточная взвесь центрифугируется 5–10 минут при 400 g. Затем надосадочная жидкость отсасывается, а клетки ресуспендируются в 0,5 мл среды 199.
Для определения числа оборотов в данных условиях центрифугирования можно использовать формулу:
g= 1,1 N*R • 10-5 (м • с-2), (13)
где N – число оборотов в минуту;
R – радиус оси вращения до интерфазы;
g – центробежная сила.
При выделении лимфоцитов в результате технических погрешностей возможна общая потеря клеток, а также селективное уменьшение какой-либо из лимфоидных субпопуляций. Чтобы судить о качестве выделения лимфоцитов, необходимо определить процент их выхода и жизнеспособность.
С этой целью для выделения лимфоцитов берется строго определенный объем крови. Параллельно осуществляется забор крови для подсчета количества лейкоцитов и гемограммы. Определяется относительное и абсолютное содержанке лимфоцитов.
Осадок выделенных мононуклеаров ресуспецдируется в среде 199, равной по объему взятому количеству крови. В полученной взвеси подсчитывается число лейкоцитов, делаются мазки, определяется лейкограмма.
Зная абсолютное количество лимфоцитов в 1 мм крови и в 1 мм3 окончательной взвеси, процент их выхода рассчитывается по формуле.
При соблюдении техники выделения лимфоцитов п их выхода колеблется от 70 до 90%.
Забор крови для определения сухой массы лимфоцитов у лабораторных животных (мышей и крыс) осуществляется из бедренных сосудов после вскрытия сосудистого пучка в паховой области.
Клетки костного мозга получают из метафиза бедренной кости, вымывая их с помощью иглы, насаженной на шприц, смесью из 0,5 мл среды 199, 2 капель 10% раствора желатины и 2 капель гепарина (в концентраций 20 ед/мл). Выделение лимфоцитов осуществляется также методом изоплотностного осаждения.
Из клеток тимуса в связи с тем, что почти все они являются лимфоцитами, сразу готовится взвесь, которой заполняются камеры.
Определение сухой массы лимфоидных элементов производится в специальных камерах. Для их изготовления проволока диаметром 0,1 мм наматывается на предметное стекло и покрывается покровным стеклом размером 24х24 мм.
Края с трех сторон заливаются парафином. Полученная камера (рис. 19) заполняется взвесью лимфоцитов, и оставшийся край герметизируется парафином.

Рис. 19. Камера для определения сухой массы лимфоцитов
Принципиальное устройство и подготовка интерференционного микроскопа к работе
Определение сухой массы клеток крови производилось нами на поляризационно-интерференционном микроскопе Biolar PI фирмы PZO (ПНР). Приводим его описание.
Принцип действия поляризационно-интерференционного микроскопа Biolar PI с двумя двупреломляющими призмами показан на рис. 20, а его общий вид на рис. 21, 22. Призма W1 (в интерференционной головке) и WY (в объективе) вместе с поляроидами Р и А и щелью 5, помещенной в фокусе конденсора К и установленной параллельно преломляющей грани призмы W1, образуют как бы двойной поляризационный интерферометр. Призма W2 имеет сравнительно большой преломляющий угол ф2; она находится непосредственно за последней линзой объектива ОЬ и может вращаться вокруг его оси, причем плоскость Я2, в которой перемещаются интерференционные полосы этой призмы, совпадает с фокусом F' объектива ОЬ. В интерференционной головке находится двупреломляющая призма имеющая значительно меньший двупреломляющий угол щ.
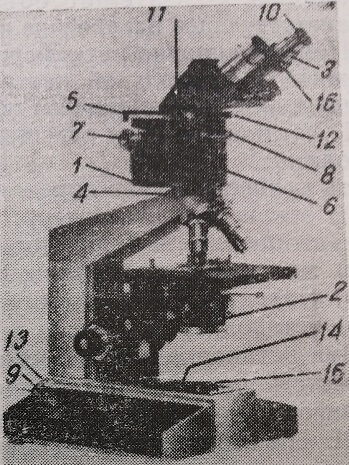
Рис. 21. Поляризационно-интерференционный микроскоп. 1 – интерференционная головка; 2 –конденсор со щелью; 3 – вспомогательный микроскоп; 4 – зажимной винт; 5 – рычаг переключения призм; 6 – накатное кольцо для передвижения призм в направлении, параллельном оптической оси; 7 – вороток микрометрического винта для передвижения призм в направлении, вертикальном к оптической оси; 8 – анализатор в оправе; 9 – патрон лампы; 10 – окуляр вспомогательного микроскопа; 11 – бинокулярная насадка; 12 – зажимной винт окулярной насадки; 13 – осветитель; 14- вороток диафрагмы поля; 15 – гнездо светофильтра; 16 – диоптрическое кольцо тубуса насадки

Рис. 22. Вид нижней части микроскопа со вставленным конденсором и щелевой диафрагмой. 17 – поляризатор; 18 – воротки для регулирования ширины щели; 19 – затенители для ограничения длины щели; 20 – держатель подъемника конденсора; 21 – зажимной винт конденсора; 22 – вороток перемещения конденсора; 23 – регулировочные винты конденсора
При вращательном движении призмы W2 изменяется величина раздвоения изображения. А именно, если эта призма установлена так, что ее преломляющий угол фг направлен так же, как преломляющий угол ф1 призмы Wi, то получается максимальное раздвоение изображения, являющееся суммой раздвоений даваемых каждой призмой в отдельности.
Если же призма W& установлена так, что ее преломляющий угол фг направлен в противоположном направлении по отношению к преломляющему углу, то получается результирующее раздвоение г изображения, равное разности раздвоений Т1 и г2.
В промежуточном положении, когда преломляющая грань призмы W2 находится под углом 45° к преломляющей грани призмы Wu получаем результирующее раздвоение г, равное раздвоению г и которое дает только призма W1.
Таким образом, поворачивая призму W2 вокруг оси объектива ОЬ, получаем три разных величины раздвоения изображения. Следовательно, в зависимости от ширины исследуемого объекта можно быстро подбирать соответствующее раздвоение изображения.
Поляризационно-интерференционный микроскоп требует сложной и тщательной настройки. Его подготовка к работе осуществляется следующим образом.
I. Устанавливается освещение по Келлеру. Перед этим необходимо:
а) привести рычаг переключения призм в положение 0;
б) отключить анализатор;
в) отключить поляризатор от конденсора;
г) максимально раздвинуть щеки щелевой диафрагмы;
д) максимально раздвинуть ограничители ширины щели;
е) установить конденсор в верхнее положение.
При установке освещения по Келлеру для измерения сухой массы эритроцитов применяются объектив 100 и окуляр 8, а лимфоцитов – объектив 40 и окуляр 12.
1.1. На столик микроскопа следует поместить препарат и установить резкость изображения.
1.2. Необходимо добиться центрального расположения конденсора относительно поля зрения. Для этого:
а) нужно максимально закрыть ирисную (полевую) диаффрагму; g
б) вертикально перемещать конденсор до появления в поле зрения кромок диафрагмы;
в) вывести апертуру диафрагмы в середину поля зрения, затем закрыть диафрагму.
1.3. Необходимо добиться центрального расположения нити накала осветительной лампы. С этой целью:
а) один из окуляров следует заменить вспомогательным микроскопом, который перемещается до тех пор, пока не будет достигнуто резкое изображение выходного зрачка объектива;
б) установить нить накаливания осветительной лампы в центре поля зрения вспомогательного микроскопа передвижением осветителя.
1.4. Расположить щеки щелевой диафрагмы симметрично по отношению к центру поля зрения на расстоянии 3–5 мм друг от друга в кажущемся поле зрения.
1.5. Установить поляризатор.
II. Настройка микроскопа для измерения сухой массы клеток методом однородного поля с большим раздвоением Измерение выполняется так:
II.1. Рычаг переключения призм переводится в положение I .
II.2. Препарат передвигается так, чтобы объектив находился над участком предметного стекла, на котором нет неоднородности (чистое стекло).
II.З. Анализатор устанавливается на значение шкалы 45°, поляризатор – на значение 135° (обозначение X).
II.4. Положение конденсора в держателе регулируется так, чтобы изображение щели диафрагмы было параллельно нулевой полосе интерференции.
II.5. Ширина щели устанавливается так, чтобы она из цветной полосы отделяла только пурпурный цвет. Для этого изображение щели нужно навести на первую цветную полосу, перемещая двупреломляющую призму. Ограничители длины щели диафрагмы следует сдвинуть так, чтобы изображение вырезаемой полосы не было длиннее диаметра зрачка объектива. Поле зрения, наблюдаемое через окуляр, должно полностью окрашиваться в пурпурный цвет.
Неоднородность окраски поля зрения можно устранить:
- горизонтальным и вертикальным перемещением двупреломляющей призмы;
- сужением щели диафрагмы;
- настройкой освещения и применением матового стекла.
II.6. Вспомогательный микроскоп заменить окуляром. Вынести препарат в поле зрения объектива и навести на резкость.
При смене объектива нужно проверить при раздвинутых щеках диафрагмы конденсора и отключенном анализаторе установку освещения по пунктам 1.1 и 1.2, а также выполнить операции, приведенные в пунктах II.5 и II.6.
Далее, перевести рычаг переключения призм в положение 3 и установить поляризационно-интерференционные объективы так, чтобы его интерференционные полосы, наблюдаемые при помощи вспомогательного микроскопа, были направлены параллельно интерференционным полосам призмы, находящейся в интерференционной головке. Прикрыв щель конденсора, необходимо «вырезать» пурпурный цвет первого порядка интерференции. Затем, поворачивая оправу объектива при введенном в поле зрения препарате, нужно добиться необходимой степени раздвоения клеток. Если при этом поле
зрения становится неоднородным, следует довести его до первоначального однородного состояния. Итак, поляризационно-интерференционный микроскоп настроен для работы методом однородного поля с большим раздвоением изображения,
Однако, прежде чем приступить к измерению сухой массы клеток, необходимо определить межполосное расстояние. Оно является характеристикой основной двупреломляющей призмы Wi. Призма 12. находящаяся в поляризационно-интерференционном объективе, не имеет влияния на величину t. Вместе с тем межполосное расстояние зависит от длины волны применяемого света. Поэтому определение межполосного расстояния проводится для призмы № 3 при длине волны 546 нм, которая используется для измерения сухой массы клеток. В этом случае оно заключается в отсчете на барабане микрометрического винта величины перемещения основной двупреломляющей призмы W1. Производится определение разности двух наиболее крайних положений призмы, при которых получается темное поле зрения, и отсчитанная разность положения делится на количество затемнений поля зрения минус одно.
Определение сухой массы эритроцитов
Для изучения содержания плотных веществ в клетке лучшим методом является измерение в однородном интерференционном поле с большим раздвоением изображения при длине волны монохроматического света 546 нм.
Большое раздвоение изображения (для призмы № 3 оно составляет 6,5 мкм) позволяет более точно определить разность оптического пути, а использование зеленой линии излучения лампы (Я = 546 нм), лежащей в области наибольшей чувствительности человеческого глаза, дает возможность наиболее точно уловить изменения освещенности.
После тщательной настройки микроскопа и вычисления межполосного расстояния на предметный столик помещается приготовленная камера. Исследования проводятся под масляной иммерсией (п – 1,555) при увеличении. Измеряется диаметр и разность оптического пути для 50 произвольно выбранных эритроцитов.
Разность оптического пути определяется следующим образом (рис. 23) :
- Для двупреломляющей призмы устанавливается нулевое положение Р0, при котором , достигается максимальное затемнение фона поля зрения и максимальное просветление клеток.
- Передвижением двупреломляющей призмы при помощи микровинта вправо и влево достигается максимальное затемнение одного изображения клетки, а затем другого, и снимаются показания микровинта. Для каждого изображения производится три измерения и находится среднее значение Р1 и Рг.
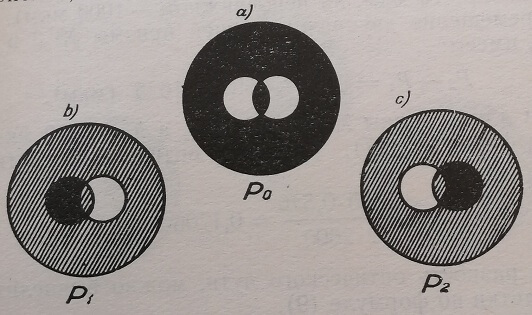
Рис. 23. Измерение разноса оптического пути в однородном интерференционном поле методом затемнения одного из раздвоенных изображений исследуемого объекта (эритроцита).
a) Ро – нулевое положение двупреломляющей призмы;
b) Р1 – максимально затемнено левое изображение;
c) Р2 – максимально затемнено правое изображение
Чтобы рассчитать площадь клетки, нужно найти ее радиус, который равен половине диаметра при условии, что эритроцит имеет форму правильного двояковогнутого диска. Для эллипсоидных эритроцитов диаметр определяется как среднее арифметическое от суммы максимального и минимального размеров. Величина диаметра измеряется с помощью окуляр-микрометра.
Для примера допустим, что диаметр эритроцита равен 7,5 мкм. Следовательно, его площадь будет составлять:
3 = 3,14* (-) =44,16 (мкм2).
Определение сухой массы лимфоцитов
Ход определения сухой массы лимфоцитов аналогичен описанному для эритроцитов. Однако используется увеличение 12X40.
После определения разности оптического пути (рис. 24) и диаметра лимфоцита величина его сухой массы вычисляется по формуле (12).
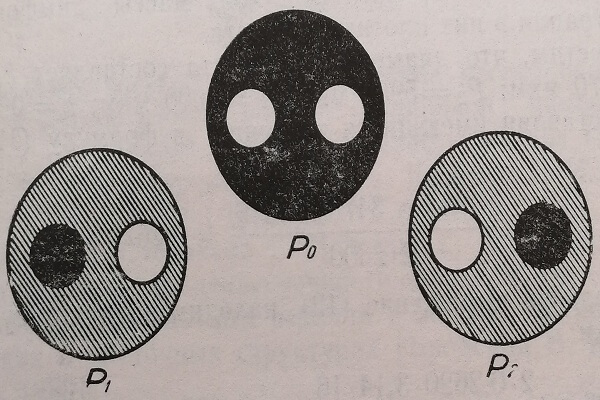
Рис. 24. Измерение разности оптического пути в однородном интерференционном поле методом затемнения одного из раздвоенных изображений исследуемого объекта (лимфоцита).
Р0 – нулевое положение двупреломляющей призмы;
Р1 – максимально затемнено левое изображение;
Р2 – максимально затемнено правое изображение
Если допустить, что лимфоциты имеют сферическую форму, то их площадь и объем можно рассчитать на основе диаметра.
Используя выражение (12), находим величину сухой массы клетки.




