Токсоплазмоз
Токсоплазмоз – паразитарное заболевание человека и животных— представляет собой одну из наиболее распространенных инвазий. Его возбудитель Toxoplasma gondii (Nicolle et Manceaux, 1908) встречается во всех географических районах и характеризуется широким спектром естественных хозяев – диких животных и птиц. Однако только кошки и некоторые дикие представители семейства кошачьих являются окончательным (полным) хозяином токсоплазм, так как именно в организме этих животных токсоплазмы проделывают половой цикл развития. В организме других представителей животного мира, включая человека (их называют промежуточными хозяевами) наблюдается лишь бесполый жизненный цикл токсоплазм.
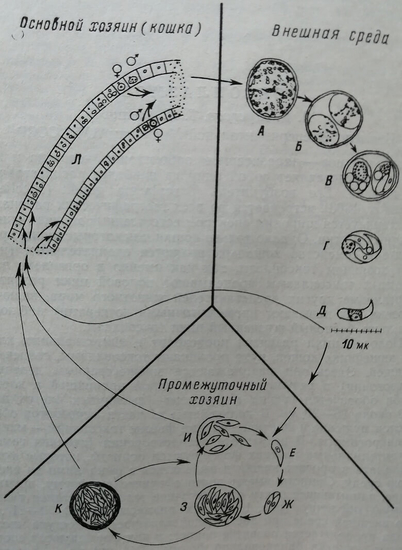
Половой цикл развития происходит в эпителиальных клетках кишечника кошек, куда проникают токсоплазмы, съеденные с пищей. Здесь они размножаются множественным делением (шизогония) в результате чего из одной проникшей в клетку особи образуется группа мерозоитов – вытянутых клеток длиной около 15-20 мк. В дальнейшем из части мерозоитов образуются мужские и женские половые формы токсоплазм – микро- и макрогаметы. В результате оплодотворения (слияния гамет; в эпителиальных клетках формируются ооцисты, которые могут выпадать в просвет кишки и выделяться с фекалиями во внешнюю среду. Ооцисты имеют почти сферическую форму, крупное ядро, занимающее почти все клеточное тело и отчетливо различимую оболочку (рис. 1, а). Их размеры 10-12X9-11 мк. Во внешней среде при достаточной влажности и доступе кислорода продолжается развитие ооцист: в них формируются спорозоиты – клетки банановидной формы (7X4 мк) по 4-8 спорозоитов в каждой ооцисте (рис. 1, б-д).
Рис. 1. Жизненный цикл токсоплазм (по Френкель и др., 1972).
Ооцисты и спорозоиты – наиболее устойчивая стадия развития токсоплазм. В песке и почве они могут сохраняться месяцами, образуя стойкие очаги инвазии, которые трудно удалить. Отсюда через пищеварительный тракт или через повреждения кожи и слизистых оболочек ооцисты попадают в opганизм кошек или промежуточных хозяев, в том числе человека, домашних сельскохозяйственных животных. Frenkel (1974 г.) считает, что высокое иногда, содержание токсоплазмы в говядине и особенно в баранине и свинине, изготовлено контактом животных с ооцистами, распространяемыми кошками.
В организме промежуточного хозяина происходит бесполый цикл развития токсоплазм – размножение посредством продольного делении эндодиогении. В результате ряда делений из спорозоитов образуются питающиеся формы токсоплазм – грофозопты, их называют так же пролиферативными формами из-за способности многократно делиться с образованием массивных паразитарных скоплений (псевдоцист). Трофозоиты имеют дугообразную форму, которой паразит обязан своим названием (токсон, по-гречески – дуга). Один конец паразита заострен, другой несколько округлен (рис. 1, е): размеры трофозоитов 2X7 мк. При окраске но Романовскому-Гимзе цитоплазма трофозонтов приобретает голубые тона, ядро – рубиновой-красный.
В организме промежуточных хозяев трофозоиты токсоплазмы поселяются и клетках ретикуло-эидотелиальной системы (РЭС), причем дальнейшее развитие может протекать по-разному, в зависимости от вирулептпости штамма и от состояния организма хозяина. В неиммунном или ослабленном организме или при заражении вирулентной культурой трофозоиты, быстро размножаются п клетках РЭС, формируя псевдоцисты (рис. 1, ж, з). При разрушении переполненной паразитами клетки (рис. 1, и) грофозоиты внедряются в новые клетки. Процесс может принять характер сепсиса и закончиться гибелью хозяина.
Чаще, однако, у него развивается резистентность к токсоплазмам. При этом скорость размножения трофозоитов замедляется, значительная часть их отмирает. Сохранившиеся колонии трофозоитов окружаются капсулой, в состав которой входит соединительная ткань хозяина, т. е. формируется истинная циста (рис. 1, к). Наличие соединительноктанной оболочки служит главным отличительным признаком цисты от псевдоцисты, в которой обычно заключены трофозоиты в период их быстрого размножения. В цистах токсоплазмы становятся мельче и теснее прилегают друг к другу. Их границы и световом микроскопе различимы неотчетливо, и вся циста приобретает вид сферического зернистого включения. Истинные цисты могут длительное время сохраняться в организме, не вызывая клинических проявлений, но стимулируя выработку антител.
Трофозоиты и цисты токсоплазм, менее устойчивы во внешней среде, чем ооцисты или сиороцнеты, однако при поедании зараженных ими грызунов или мяса хищными животными или птицами, они становятся источником инвазии. Человек заражается при употреблении в пищу сырого или недоваренного мяса, так как в мясе трофозоиты и цисты погибают лишь при нагревании выше 60 градусов. Замораживание вообще не полностью убивает паразитов, хотя резко сокращает число иных токсоплазм.
Попав в организм промежуточного хозяина, токсоплазмы вновь проделывают описанный неполовой цикл развития. Если же инфицированного промежуточного хозяина (мышей, диких птиц)пожирает кошка, то в ее кишечнике, как и при поедании ооцист вновь появляются половые формы токсоплазм (рис. 1, л) и происходит выделение ооцист во внешнюю среду. По не выясненной пока причине сроки, когда начинается выделение ооцист, зависят от того, на какой стадии развития токсоплазм они были съедены. Если кошка поедает мышей с быстро размножающимися трофозоитами, то она начинает выделять ооцисты через 5-10 дней. При поедании мяса с истинными цистами – через 3-5 дней. Когда же пожираются непосредственно ооцисты, инкубация длится 20-24 дня.
Чаще всего кошки заражаются при охоте, пожирая грызунов или мясо с трофозоитами или цистами. Это особенно относится тс бродячим кошкам; у них антитела против токсоплазм обнару.живаются значительно чаще, чем у домашних (Frenkel, 1974 6). Бродячие кошки – основное звено в эпидемиологии и эпизоотологии токсоплазмоза.
Основные сведения о жизненном цикле токсоплазм и о роли жошек в эпидемиологии токсоплазмоза получены в последние 5 лет (более подробно об этом см. у Д. Н. Засухина и соавт., 1974, и И. Г. Галузо, 1973). Работы последних лет показали, что основной путь заражения токсоплазмами — алиментарный; важное значение имеет проникновение паразитов через повреждения .кожи и слизистых оболочек. Однако возможна передача инфекции также и внутриутробно от матери к плоду. Поэтому в зависимости от пути заражения различают токсоплазмоз приобретенный и врожденный.
Приобретенный токсоплазмоз – наиболее частая форма инвазии. Его частота увеличивается с возрастом. Согласно данным массовых обследований в разных местностях от 10 до 90% взрослого населения инфицировано токсоплазмами.
Чаще всего приобретенный токсоплазмоз взрослых протекает без клинических проявлений. Нередко незамеченным остается и момент заражения. О состоявшемся заражении судят обычно по сероконверсии, т. е. по появлению антител против токсоплазм в крови людей, бывших до этого серогенетивиыми в отношении данного паразита.
Случаи манифестирующего приобретенного токсоплазмоза взрослых редки. Они протекают как острая инфекция с лихорадкой и очаговыми поражениями печени, легких, головного мозга, глаз. Крайне редко, как правило, у ослабленных лиц, возникает генерализованный токсоплазмоз, с кожными высыпаниями, текущий по типу сепсиса с множественными очаговыми поражениями внутренних органов. В таких случаях возможен и смертельный исход. При более благоприятном течении инфекции, в конце острого периода или при субклиническом течении острой инфекции наблюдается генерализованный или локализованный лимфаденит, иногда с наличием паразитов в лимфатических узлах.
У лиц, перенесших токсоплазмоз, появляются специфические антитела и возникают гиперчувствительность к токсоплазменному антигену, о которой судят по кожно-аллергическим пробам. Пока еще не ясно как действуют механизмы иммунитета при токсоплазмозе. О них судят по косвенным признакам, например, по случаям обострения инфекции под действием иммунодепрессантов (кортизон) на организм хозяина и по защищенности людей и животных, обладающих специфическими антителами, от повторного заражения.
Врожденный токсоплазмоз возникает вследствие внутриутробного инфицирования плода от матери, заразившейся во время беременности. Заражение матери опасно для плода на всех этапах беременности. Большинство матерей, рождающих детей с острым врожденным токсоплазмозом, переносят бессимптомную инфекцию во время беременности, о чем судят по сероконверсии. В то же время у женщин, перенесших токсоплазмоз до беременности и уже имеющих антитела, риск родить пораженного ребенка крайне низок (Д. Н. Засухин, 1969; Frenkel, 1974).
Патогенез врожденного токсоплазмоза, в основном, такой же как и приобретенной инфекции взрослых. Однако из-за общей иммунологической незрелости плодов и новорожденных у них наблюдается более тяжелая инфекция, нередко с обширными поражениями глаза и головного мозга, иногда с развитием энцефалита и перивентрикулярных некрозов. У новорожденных, инфицированных внутриутробно, болезнь может протекать подостро. Frenkel (1974 а) связывает такое течение с пассивной иммунизацией плода от матери и с постепенным развитием у ребёнка собственного активного иммунитета, что ведет к ослаблению тяжести болезненного процесса. Подострая или хроническая инфекция может протекать со специфическим ретинохориоидитом или менинго-энцефалитом.
Особенности жизненного цикла токсоплазмы, эпидемиологии и эпизоотологии токсоплазмоза, а также большое число скрытых и субклинических форм этой инвазии определяют основные направления борьбы с токсоплазмом: а) разрыв разных звеньев в цепи передачи токсоплазм (борьба с бродячими кошками, профилактика и лечение домашних; борьба с загрязнением кормов и пастбищ ооцистами через кошек; правильная организация обработки и разделки мяса; достаточная термическая обработка мясной пищи); б) выявление серонегативных по токсоплазмозу беременных женщин, профилактика их заражения; в) выявление иммунной прослойки среди населения и инфицированности токсоплазмами домашних и сельскохозяйственных животных.
В системе перечисленных мероприятий, так же как и при диагностике острого токсоплазмоза у заболевших, основную роль играет лабораторная диагностика. Можно выделить две группы методов лабораторной диагностики токсоплазмоза: паразитологические (прямые) и иммунологические (непрямые).
Первые направлены на выделение и идентификацию паразитов вторые позволяют судить об имеющейся или перенесенной инфекции на основании серологических реакций и кожно-аллергических проб.
Паразитологические методы
Объектом исследования с помощью паразитологических методов являются кровь, спинномозговая жидкость, материал биопсий (лимфатические узлы, миндалины, кусочки мышц), взятых от людей с острым заболеванием, а также пробы мяса домашних и сельскохозяйственных животных, органы диких животных, преимущественно мышевидных грызунов и фекалии кошек. Эти объекты исследуют с помощью прямого микроскопирования или используют для заражения животных с целью выделения культуры токсоплазм. Поскольку исследуемый материал бывает беден паразитами, нередко перед постановкой биопробы на животных его обогащают для того, чтобы сконцентрировать находящиеся в нем токсоплазмы.
Прямое микроскопирование
Микроскопированию с целью диагностики подвергаются: а) фиксированные и окрашенные мазки и оттиски; б) нативные препараты.
а) Мазки и оттиски готовят из пунктатов лимфатических узлов или из биопсированных узлов и миндалин, из крови, околоплодной жидкости, из осадка спинномозговой жидкости, полученного при центрифугировании, а также из внутренних органов (брюшина, селезенка, головной мозг) подопытных животных, чаще всего, белых мышей. Препараты окрашивают по Романовскому-Гимзе (после предварительной фиксации метиловым спиртом или смесью равных частей спирта с эфиром), или обрабатывают люминесцирующими сыворотками по методу Кунса. В этом случае требуется фиксация спиртом или ацетоном 10-30 мин.
Препараты следует просматривать тщательно, так как токсоплазм в материале, как правило, бывает мало. При изучении препаратов, окрашенных по Романовскому-Гимзе, следует помнить, что трофозоиты токсоплазм, встречающиеся в организме промежуточных хозяев, морфологически сходны с некоторыми другими простейшими – Nosema, Besnoitia, Sarcocystis, Hepatozoon, Klossiella. Краткая характеристика этих паразитов приведена в таблице.
Для обработки по Кунсу производство Института эпидемиологии и микробиологии им. Гамалея выпускает антитоксиплазменную люминесцирующую сыворотку. Сыворотку в рабочем разведении (указывается на ампулах) наносят на препарат и инкубируют 30 мин при 37°, после чего препарат промывают фосфатным буфером (pH = 7,2) и слегка подсушивают. Микроскопирование проводят в люминесцентном микроскопе с объективами 40х, 60х или 90х. Люминесцирующая сыворотка вызывает яркое зеленоватое свечение периферии клетки паразита, тогда как ее центр остается темным. Следует, однако, помнить что при изготовлении мазка или оттиска некоторые паразиты могут деформироваться. Кроме того, в препарате могут оказаться образования, неспецифически связывающие люминесцирующие сыворотки, главным образом частицы клеточного детрита и зерна лейкоцитов.
Побочному свечению частиц детрита можно придать коричневатый оттенок, если специфическую антитоксоплазменную сыворотку смешать с альбумин-родаминовым конъюгатом (так же выпускается институтом им. Гамалея) в пропорции, указанной на ампулах.
б) Нативные препараты для микроскопирования готовят из фекалий кошек При исследовании на ооцисты и спороцисты токсоплазм. Этот способ разработали в последние годы Dibey, Frenkel. В виду важности его значения приводим подробно технику приготовления препаратов (Dubey, 1973).
Фекалии собирают в сосуд (емкостью около 250 мл), добавляют воду и оставляют, прикрыв, на 1-2 часа для размягчения кала. Избыток воды сливают в дезраствор, и фекалии эмульгируют в густую пасту, медленно добавляя около 10 объемов раствора сахарозы удельного веса 1,15. Полученную суспензию фильтруют через 1-2 слоя марли в центрифужные пробирки емкостью 10-45 мл. Пробирки заполняют не более чем на 1-2 см, чтобы предотвратить разбрызгивание инфекционного материала.
Пробирки с суспензией центрифугируют 10 мин при 1000-3000 об/мин. В растворе сахарозы ооцисты и спороцисты токсоплазм всплывают кверху, а более плотные частицы кала оседают на дно. Пестеровской пипеткой берут 1-2 капли верхнего слоя центрифугата, помещают на предметное стекло, накрывают покровным и оставляют на 5 мин для иммобилизации частиц исследуемого материала, после чего проводят микроскопическое исследование.
Для приготовления раствора сахарозы удельного веса 1,15 рекомендуют в 100 мл воды растворить 53 г сахара и в качестве консерванта добавить 0,8 мл 80% фенола.
При микроскопировании нативного препарата следует помнить, что неспорулированные ооцисты токсоплазм имеют сравнительно небольшие размеры (примерно в 2 раза крупнее эритроцита), и что в фекалиях кошки встречаются, как правило, ооцисты других простейших, токсокар и изоспор. Эти ооцисты
в 4-8 раз крупнее ооцист токсоплазм и лежат в разных плоскостях фокуса микроскопа. Поэтому при микроскопировании кошачьих фекалий сначала используют увеличение 100х, чтобы выявить крупные ооцисты, а затем увеличение 400х. Обнаружение в кале ооцист диаметром 10-12 мк позволяет поставить предварительный диагноз токсоплазмоза. Окончательный диагноз должен быть подтвержден биопробой на животных.
Биологические пробы на лабораторных животных
Для биологических проб используют, главным образом, белых мышей и кошек. Мышей заражают парентерально или скармливая им исследуемый материал. При парентеральном заражении внутри- брюшинное введение более удобно для выделения токсоплазм из проб, не загрязненных бактериями. При этом способе можно использовать инокулят большего объема, чем при подкожном. Последнее более удобно при введении материала, слегда загрязненного бактериями.
а) Парентеральное заражение. При исследовании кусочков органов и тканей (биопсированные лимфатические узлы, плацента, пробы мяса, кусочки мозга, селезенки, печени, взятые от трупа, и т. п.) готовят взвесь на физиологическом растворе с добавлением антибиотиков. Поскольку подобный материал бывает беден токсоплазмами, прибегают к его обогащению путем переваривания желудочным соком.
Для обогащения Jacobs, Melton (1957) рекомендуют исследуемые кусочки весом 50-100 г измельчить и залить в стеклянном сосуде 10 объемами (по весу) желудочного сока. Взвесь взбалтывают и инкубируют 2 часа при 37". При этом происходит переваривание исследуемой ткани, освобождение цист и разрушение их оболочек. Полученную суспензию фильтруют через 2-3 слоя марли. Фильтрат центрифугируют 15 мин при 2000 об/мин, надосадочную жидкость сливают, а осадок промывают физиологическим раствором, ресуспендируют в двойном его объеме и используют для заражения подопытных животных.
При исследовании спинномозговой или околоплодной жидкости вводят осадок, полученный после 10-15 мин центрифугирования при 2000-3000 об/мин. У больных с подозрением на токсоплазмоз, особенно у лихорадящих, для исследования берут кровь в объеме 3-4 мл. После оседания эритроцитов плазму отсасывают и центрифугируют. Животным вводят осадок, полученный после центрифугирования плазмы, в объеме до 1 мл. Одновременно из осадка клеток белой крови делают мазки для окраски по Романовскому-Гимзе.
Белых мышей можно заражать Парентерально так же и фекалиями кошек при поисках у них ооцист и спороцист. Имея в виду устойчивость ооцист, Dubey, Frenkel (1973) рекомендуют стимулировать освобождение спорозоитов из них при помощи инкубации в 2% серной кислоте 3-5 дней при комнатной температуре. Полученную суспензию нейтрализуют равным объемом 3,3% гидроокиси натрия, разводят в физиологическом растворе и вводят парентерально мышам. Место инокуляции следуетобработать концентрированным раствором йода (7% йода и 5% йодистого натрия в 95% спирта), так как 2% спиртовой раствор йода не убивает ооцист.
Материал, взятый для биологической пробы, желательно использовать немедленно. Допустимо хранение его при 2-4° не более 1-2 суток.
За животными, зараженными парентерально, наблюдают 10-12 дней. Если мыши не заболтают, делают «слепые» пассажи тканью головного мозга и селезенки через каждые 10-12 дней до 3-5 раз. При положительной пробе у мышей может развиться острый токсоплазмоз. Паразиты обнаруживаются в перитонеальном экссудате, а также в печени и селезенке. При наличии в исследуемом материале авирулентных штаммов токсоплазм заболевание подопытных мышей внешне не проявляется. Перитонеальный экссудат обычно не образуется или обнаруживается в небольшом количестве. Цисты токсоплазм в этом случае находят в головном мозгу мышей через 2-3 недели после заражения. Для их выявления кусочек головного мозга раздавливают между предметным и покровным стеклом, фиксируют и окрашивают по Романовскому-Гимзе.
В лабораториях, распологающих возможностью серологического обследования подопытных животных, биопробы с парентеральным заражением белых мышей целесообразно проводить по схеме, которую предлагает Siim (1971): 1) парентеральное введение исследуемой 20% тканевой суспензии; 2) 1-я неделя, исследование перитонеального экссудата; 3) 6-я неделя, серологическая реакция с кровью из хвостовой вены на токсоплазмоз; 4) при положительной реакции — исследование головного мозга на наличие в нем цист, при отрицательной — серия «слепых» пассажей.
б) Энтеральное заражение мышей. Dubey, Frenkel (1973) отмечают, что ооцисты токсоплазм более патогенны для мышей при энтеральном заражении, чем при парентеральном. Поэтому они предлагают при подозрении на наличие ооцист и спороцист у кошек скармливать их фекалии мышам. В кишечнике у мышей, в отличие от кошек, развиваются не половые формы токсоплазм, а трофозоиты, и возможна генерализация инфекции. О развитии инфекции можно с уверенностью судить на 16 день по появлению в крови специфических антител.
Скармливание фекалий следует проводить с соблюдением необходимых мер предосторожности, так как около 10% ооцист может проходить через кишечник мыши без эксцистирования и сохранять инфекциозиость.
И. Г. Галузо с сотр. (1974) предложили применять в качестве подопытных животных 2-6 месячных котят, проверенных копрологически на отсутствие токсоплазм в содержимом кишечника. Исследуемый материал (пробы мяса, кусочки органов животных, трупный материал, биопсированиые лимфатические узлы) скармливают животным. Затем, начиная с 3-го дня, в течение 10 дней ежедневно собирают фекалии кошек и исследуют их так, как описано ранее.
Кроме мышей и кошек для постановки биологических проб используют также 6-8-дневные куриные эмбрионы, которые заражают в хорио-аллантоисную оболочку. Токсоплазмы обнаруживаются в оболочках через 4-6 дней. Используя куриные эмбрионы (так же как и культуры ткани), можно не опасаться возможной спонтанной инвазии токсоплазмами или похожими на них простейшими, что иногда наблюдается у белых мышей.
Иммунологические методы
С помощью иммунологических способов получают косвенное указание на существующую или перенесенную в прошлом токсо- плазменную инвазию. Можно выделить две группы иммунологических методов: а) серологические реакции, б) кожно-аллергические пробы. Среди серологических реакций наибольшее значение имеют реакция связывания комплемента (РСК), реакция с красителем, предложенная Сэбином и Фельдманом (РСФ) реакция непрямой иммунофлуоресценции (РНИФ) и реакция непрямой гемагглютинации (РНГА).
Реакция связывания комплемента проводится по стандартной методике, чаще на холоде. В качестве антигена в ней используют взвеси убитых токсоплазм (см. ниже). От степени очистки паразитов в антигене и от сохранения ими антигенных свойств в значительной степени зависит достоверность РСК при токсоплазмозе. Антитела, выявляемые в РСК, появляются спустя 2-3 недели после заражения и перестают определяться через 2-4 года.
Реакция Себина-Фельдмана основана на том, что живые токсоплазмы, взвешенные в физиологическом растворе в присутствии нормальной сыворотки человека, интенсивно окрашиваются, если во взвесь добавить щелочной раствор метиленовой сини. Полагают, что прокрашиванию способствуют вещества, содержащиеся в нормальной сыворотке человека, так называемый «активатор». Если в эту систему до добавления сини ввести сыворотку, содержащую антитела против токсоплазм, то прокрашивания паразитов не произойдет. Таким образом для проведения РСФ необходимо иметь: а) свежую взвесь живых токсоплазм (ее получают из перитонеального экссудата мышей, убитых на 3-4 сутки после внутрибрюшинного заражения); б) нормальную сыворотку человека, содержащую «активатор»; в) «положительную» сыворотку, содержащую антитела против токсоплазм, и г) испытуемые сыворотку.
РСФ считается одной из лучших серологических реакций на токсоплазмоз. Это подтверждено многолетним опытом (Feldman, 1974) и сопоставлением результатов РСФ с результатами других реакций. РСФ как и РСК становится положительной через 1-2 недели после заражения и сохраняется на протяжении 2-4 лет (рис. 2). Недостатками РСФ являются необходимость постоянно иметь свежую культуру токсоплазм (что представляет опасность для персонала) и техническая сложность постановки самой реакции, так как на ее результаты могут влиять качество метиленовой сини и содержание «активатора» в нормальной человеческой сыворотке. Поэтому в последние годы все более широкое применение приобретают РНИФ и РНГА, с помощью которых получают результаты, во многом совпадающие с РСФ.
Реакция непрямой иммунофлуоресценции
Эту реакцию разработали Weller и Coons. Она основана на том, что иммунный комплекс, который образуется из антител, содержащихся в испытуемой сыворотке, и из антигена, приготовленного из токсоплазм, можно обнаружить при помощи люминесцирующей сыворотки против глобулина исследуемого вида животного. Реакцию проводят на предметных стеклах (Е. А. Шевкунова, Л. И. Виноградова, 1969). На них предварительно наносят капли токсоплазменного антигена (взвесь паразитов), подсушивая и фиксируя их ацентоном 10-20 мин. В таком виде стекла с антигеном можно хранить при +4° несколько месяцев. При проведении РНИФ на каждую каплю антигена наносят по капле испытуемой сыворотки в возрастающих разведениях (1 :2, 1 :4 и выше), после чего инкубируют 30 мин при 37°. Испытуемую сыворотку потом смывают 2-3 порциями фосфатного буфера pH=7,2, после чего на каждую каплю антигена наносят люминесцирующую сыворотку против глобулинов обследуемого вида животного. Если в испытуемой сыворотке содержались антитела плотив токсоплазм, то они образуют иммунный комплекс с фиксированным на стекле антигеном. Его присутствие открывает антивидовая люминесцирующая сыворотка, которая специфически связывается с антителами, фиксированными на антигене. Присутствие комплекса обнаруживается с помощью люминесцентного микроскопа. Титром РНИФ является то наибольшее разведение испытуемой сыворотки, при котором обнаруживается люминесценция антигена. Fuhr (1974) сообщает, что исследуя 399 сывороток больных токсоплазмозом, получил в 79% полное совпадение титров РНИФ и РСФ, а в 97,5% – близкие по величине титры.
Большим преимуществом РНИФ является то, что в отличие от РСФ, она не требует в качестве ингредиента живой культуры токсоплазм. Она легко воспроизводится и может быть использована как при обследовании людей, так и разных представителей животного мира. При этом во всех случаях пригоден один и тот же антиген. Необходимо менять только антивидовую люминесцирующую сыворотку в зависимости от обследуемого вида животных. Антивидовые сыворотки готовит отечественная промышленность.

Рис. 2. Динамика иммунологических показателей при остром и хроническом токсоплазмозе. РК – реакция с красителем; РСК – реакция связывания комплемента; КАП – кожно-аллергическая проба. Пунктиром показаны реакции при переходе инвазии в хроническое течение.
Реакция непрямой гемагглютинации
Для диагностики паразитарных заболеваний, включая токсоплазмоз, РНГА предложили Jacobs, Lunde в 1957 г. В основе реакции лежит способность различных антигенов адсорбироваться на поверхности эритроцитов, особенно, если эритроциты предварительно обработаны таннином. Введение иммунной сыворотки во взвесь эритроцитов, нагруженных антигеном, ведет к агглютинации эритроцитов, так как на их поверхности образуется иммунный комплекс. Степень агглютинации зависит от количества (титра) антител, содержащихся в исследуемой сыворотке. Для проведения РНГА используют эритроциты барана или кролика, реже – резусотрицательные эритроциты человека. В качестве антигена применяют лизаты токсоплазм. Такие антигены готовят Институт им. Гамалея и Одесский завод бактериальных препаратов.
Для постановки РНГА требуется растворимый антиген токсоплазм, так как его необходимо адсорбировать на эритроцитах. Для других серологических реакций (РСФ, РСК, РНИФ) используют корпускулярные антигены, представляющие собой взвесь убитых паразитов. Такие взвеси готовят из перитонеального экссудата белых мышей, из инфицированных культур ткани или куриных эмбрионов. Предложено много способов приготовления токсоплазменных антигенов; они подробно описаны в монографии 3. Р. Сыргабаевой (1974).
Кожно-аллергическая проба
Эта проба основана на способности токсоплазм вызывать у инфицированного хозяина гипер чувствительность замедленного типа к токсоплазменному белку Она развивается через 3-4 недели после заражения и сохраняется, по-видимому, пожизненно. Гиперчувствительность проявляется, в частности, в том, что на месте внутрикожного введения токсоплазменного белка (аллергена) возникает выраженная воспалительная реакция, достигающая максимального развития через 48 часов.
Методика постановки реакции следующая: в кожу ладонной поверхности предплечья или наружной поверхности плеча туберкулиновым шприцем вводят 0,1 мл токсоплазменного аллергена (токсоплазмина). Для контроля на расстоянии 5-7 см от места введения вводят 0,1 мл физиологического раствора. Реакцию учитывают через 24-48 часов. При положительной реакции на месте введения аллергена через 24 часа появляется гиперемия и пальпаторно определяется инфильтрат диаметром от 10 до 20 мм. Через 48 часов инфильтрат не уменьшается. При диаметре инфильтрата менее 10 мм реакция считается отрицательной.
Кожно-аллергическая проба является специфической, но по ней трудно судить об активности процесса из-за длительного ее сохранения. Эта проба имеет важное значение при массовых обследованиях населения на инфицированность токсоплазмами. Более определенное суждение об активности процесса можно получить, применяя кожно-аллергическую пробу в раститровке. Для этого в кожу ладонной поверхности предплечья вводят аллерген в разведениях 1:10, 1:100, 1:1000, 1:10 000, 1 :100. Инъекции делают на расстоянии 2-3 см одна от другой. У лиц без клинических проявлений болезни и при большой давности инфицирования реакция может быть отрицательной даже в разведении 1:10. При недавнем заражении у лиц с клиническими проявлениями инфекции реакция может быть положительной в разведениях 1:10 000 и даже 1:100 000. В ходе лечения положительная реакция может ослабевать или даже становиться отрицательной (в случае применения десенсибилизирующего лечения).
Токсоплазмин, применяющийся для кожно-аллергических реакций выпускает институт им. Гамалея.