Растворы
Выражение концентрации растворов
Растворы разнообразных веществ в воде и органических жидкостях находят в лабораторной практике широкое применение, поэтому лаборанту необходимо уметь приготовлять различные растворы.
Не все вещества растворяются одинаково хорошо в любой жидкости, то есть растворимость различных веществ в тех или иных растворителях различна. Растворимость выражают в количестве вещества в 1 л растворителя. Обычно растворимость твердых веществ увеличивается с повышением температуры, поэтому при приготовлении растворов во многих случаях необходимо призвание. В определенном количестве каждого растворителя может быть растворено не более определенного количества данного вещества.
Если приготовить раствор, содержащий в единице объема наибольшее количество вещества, которое может раствориться при данной температуре, и добавить к нему еще хотя бы небольшое количество вещества, то оно останется нерастворенным. Такой раствор будет называться насыщенным.
Если приготовить при нагревании концентрированный раствор, близкий к насыщенному, а затем быстро, но осторожно охладить полученный раствор, осадок может не выпасть. Если в такой раствор бросить кристаллик соли и перемешать или потереть палочкой о стенки сосуда, то из раствора выпадут кристаллы соли. Следовательно, в охлажденном растворе содержалось соли больше, чем это отвечает ее растворимости при данной температуре. Такие растворы называются пересыщенным и.
Свойства растворов всегда отличаются от свойств растворителя. Раствор кипит при более высокой температуре, чем чистый растворитель. Температура затвердевания, наоборот, у раствора ниже, чем у растворителя.
По характеру взятого растворителя растворы делятся на водные и неводные. К последним принадлежат растворы веществ в таких органических растворителях, как спирт, эфир, ацетон, бензол, хлороформ и т. д. Большинство растворов солей, кислот и щелочей являются водными. Каждый раствор характеризуется концентрацией растворенного вещества, то есть количеством вещества, содержащегося в определенном количестве раствора. По точности выражения концентрации растворы разделяют на приблизительные и точные. Концентрации приблизительных растворов большей частью выражаются в процентах; концентрации точных растворов выражаются в молях на 1 л раствора, эквивалентах на 1 л раствора и титром.
Процентные растворы определяются массовой долей вещества в растворе, выраженной в процентах (т. е. числом г вещества в 100 г раствора). Например, 5% раствор содержит 5 г вещества в 100 г раствора, то есть 5 г вещества и 100-5 = 95 г растворителя.
Молярная концентрация определяется числом молей вещества в 1 л раствора. Так одномолярные (1 М) растворы содержат 1 моль вещества в 1л раствора, двумолярные (2 М) – 2 моль в 1 л и т.д.
Для того чтобы установить, сколько данного вещества находится в 1 л раствора заданной молярной концентрации необходимо знать его молярную массу.
Молярная масса – это масса вещества, взятого в количестве 1 моль и численно равная его относительной молекулярной массе. Например, молекулярная масса NaCl равна 58,45 М, следовательно молярная масса тоже равна 59,45 г/моль. Таким образом, 1 М раствор NaCl содержит 58,45 молей хлорида натрия в 1 л раствора.
Нормальная концентрация (нормальность) выражается числом эквивалентов растворенного вещества в 1 л раствора.
Эквивалентом элемента называют такое количество его, которое соединяется с одним атомом водорода или замещает его в химических реакциях. Так, эквивалент хлора в соединении НС1 равен 1 (1 моль), в соединении H2S эквивалент серы будет равен 7г моль.
Эквивалент сложного соединения — это такое его количество, которое в данной реакции соответствует (эквивалентно) Одному атому водорода.
Так для реакции
Zn =ZnS04+ H2f
1 моль H2SO4 соответствует 2 атомам водорода, следовательно эквивалент равен 3-м моль.
Масса одного эквивалента элемента или соединения называется его эквивалентной массой.
Разберем подсчет эквивалентной массы для различных соединений.
Эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты. Таким образом, эквивалент (а следовательно и эквивалентная масса) не является постоянной величиной для данного соединения, а зависит от реакции, в которую вступает это соединение.
Эквивалентная масса основания равна его молярной массе, деленной на валентность металла. Так, эквивалентная масса гидроксида кальция равна 74: 2 = 37; эквивалентная масса гидроксида натрия 3NaOH = 40: Г= =40.
Так вычисляется эквивалентная масса только для реакций полной нейтрализации. Для реакции неполной нейтрализации величина эквивалентной массы будет другой и зависит от течения реакции.
Эквивалентная масса соли, равна молярной массе, деленной на сумму валентностей всех ионов металла (т. е. на произведение валентностей металла на число его атомов в молекуле).
Так, эквивалентная масса сульфата натрия 3Na2sOi = 142: (1X2) =71; эквивалентная масса сульфата алюминия равна 342: (3X2) =57.
Однако, если соль участвует в реакции неполного обмена, учитывается число атомов металла, участвующих в реакции.
Эквивалентная масса вещества, участвующего в окислительно-восстановительной реакции, равна молярной массе вещества, деленной на число электронов, принятых или отданных данным веществом. Следовательно, прежде чем производить вычисление, необходимо написать уравнение реакции и составить ее баланс.
Эквивалентная масса сульфата меди равна 160. Нормальная концентрация обозначается буквой N (в различных формулах) или буквой «н» – при обозначении концентрации данного раствора. Если в 1 л раствора содержится 0,1 эквивалент вещества, он называется децинормальным и обозначается 0,1 н. Раствор, содержащий 0,01 эквивалент вещества в 1 л раствора, называется сантинормальным и обозначается 0,01 н.
Титр раствора выражается массой вещества в 1 г, содержащихся в 1 мл раствора. В аналитических лабораториях рассчитывают титр по определяемому веществу, который показывает, какому числу определяемого вещества соответствует 1 мл данного раствора.
Расчеты и техника приготовления приблизительных растворов. Хранение растворов
К приблизительным относятся растворы, концентрация которых выражена в процентах.
Приготовленные растворы хранят в бутылях соответствующего размера с подобранной пробкой. Лучше всего хранить растворы в бутылях с притертой пробкой. Однако, есть растворы, как, например, растворы щелочей, которые нельзя закрывать стеклянными притертыми пробками.
Растворы щелочей нельзя хранить в обычной стеклянной посуде длительное время, так как происходит выщелачивание стекла. Поэтому бутыль для хранения раствора щелочи покрывают внутри парафином. Бутыль закрывают пробкой с хлоркальциевой трубкой, заполненной натронной известью для защиты от диоксида углерода.
Перед приготовлением растворов нужно подготовить посуду для приготовления и для хранения их. Если раствор готовится в небольшом количестве, которое будет использовано в течение рабочего дня, его не обязательно переливать в бутыль, а можно оставить в колбе. На бутыль, в которой будет храниться раствор, обязательно наклеивают этикетку с указанием, какой раствор в ней находится и когда он приготовлен.
Например:
Химическая лаборатория
нитрат калия KN03 10%,
6. 09. 81
Если раствор приготовлен для использования в течение рабочего дня, на колбе необходимо написать (специальным восковым карандашом) формулу растворенного вещества и концентрацию раствора, например НС1 5%.
Посуда для приготовления и хранения растворов должна быть чисто вымыта и сполоснута дистиллированной водой.
Для приготовления растворов следует применять только чистые вещества и дистиллированную воду.
Прежде чем готовить раствор, необходимо произвести расчет количества растворяемого вещества и количества растворителя. При приготовлении приблизительных растворов количество растворяемого вещества рассчитывают с точностью до десятых долей, значения молекулярных масс берут округленно до целых чисел, а при расчете количества жидкости доли миллилитра не учитывают. Техника приготовления растворов различных веществ различна. Однако при приготовлении любого приблизительного раствора навеску берут на техно-химических весах, а жидкости отмеривают мерным цилиндром. Ниже мы приводим расчеты и технику приготовления процентных растворов солей, щелочей и кислот.
Приготовление растворов солей
Пример 1. Надо приготовить 2 кг 10% раствора нитрата калия KNO3. Расчет необходимого количества соли производится согласно пропорции:
100 г - 10 г KN03 2000 г—Х г KNO3
X = 200 г KN03.
Воды нужно взять 2000-200=1800 г или 1800 мл.
На техно-химических весах отвешивают необходимое количество соли и переносят ее в колбу или стакан, в котором будут производить растворение. Отмеривают сначала примерно 1/2 необходимого по расчету количества воды. Энергичным помешиванием добиваются полного растворения взятой навески, причем иногда для этого необходимо нагревание. После растворения навески добавляют остальное количество воды. Если раствор мутный, его отфильтровывают через складчатый фильтр в подготовленную бутыль или колбу.
Приготовление растворов щелочей
Расчет количества щелочи, необходимого для приготовления раствора той или иной концентрации, производят так же, как было описано выше для растворов солей. Однако твердая щелочь, особенно не очень хорошо очищенная, содержит много примесей, поэтому рекомендуется отвешивать щелочи на 2-3% больше рассчитанного количества.
Техника приготовления растворов щелочей отличается от техники приготовления растворов солей. При приготовлении растворов щелочей нужно соблюдать следующие правила:
- Кусочки щелочи нельзя брать голыми руками; их можно брать щипцами, пинцетом, а если нужно взять руками, то обязательно в резиновых перчатках. Гранулированную щелочь (в виде маленьких лепешечек) насыпают фарфоровой ложечкой.
- Отвешиваемую щелочь нельзя класть на бумагу; ее можно взвешивать только в стеклянной или фарфоровой посуде.
- Щелочь нельзя растворять в толстостенных бутылях, так как при растворении происходит сильное разогревание и бутыль может лопнуть.
Отвешенное на техно-химических весах количество щелочи помещают в большую фарфоровую чашку или стакан. В эту посуду наливают такое количество воды, чтобы раствор имел концентрацию 35-40%.
Перемешивают раствор стеклянной палочкой, пока вся щелочь не растворится. Затем раствор оставляют стоять до остывания и выпадения осадка. Осадок представляет собой примеси (в основном карбонаты), которые не растворяются в концентрированных растворах щелочей. Оставшуюся щелочь осторожно сливают в другой сосуд (лучше с помощью сифона), куда доливают нужное количество воды.
Раствор щелочи не всегда удается приготовить заданной концентрации, поэтому, приготовив раствор, нужно определить при помощи ареометра его плотность и по таблице найти процентное содержание щелочи.
Приготовление растворов кислот
Чаще всего в лаборатории применяют хлористоводородную, серную, уксусную и азотную кислоты.
Технические кислоты содержат много примесей, поэтому для аналитических работ применяются только чистые кислоты.
Пример 1. Нужно приготовить 2 л 15% раствора серной кислоты. Обычно при расчетах для приготовления кислот используют стандартные таблицы, в которых указан процент раствора кислоты, плотность данного раствора при определенной температуре и количество этой кислоты, содержащееся в 1 л раствора данной концентрации. По таблицам находим, что 15% раствор при комнатной температуре имеет плотность, равную 1,102 и 1 л раствора содержит 165,3 г H2SO4. Нам нужно приготовить 2 л, следовательно нужно взять 165,3X2 = 330,6 т Но концентрированная серная кислота обычно имеет плотность 1,84 и является 98% – 1 л этой кислоты содержит 1799 г H2SO4. Производим расчет:
1000 мл раствора содержат 1799 г H2S04
330,6 г h2so4
Следовательно, надо взять 183 мл концентрированной кислоты и 2000-183 = 1817 мл воды.
Если известна только концентрация кислоты в процентах и ее плотность, но не известно количество грамм кислоты в 1 л раствора, расчет будет несколько более сложным.
Пример 2. Нужно приготовить 1 л 10% раствора хлористоводородной кислоты НС1, исходя из имеющейся 38,0% кислоты с плотностью 1,19. По таблице находим, что 10% раствор кислоты при комнатной температуре имеет плотность 1,05, следовательно 1 л ее будет весить 1,05X1000=1050 г. В этом количестве должно быть чистого хлористого водорода:
Воды нужно взять 1000-232 = 768 мл.
Часто употребляют растворы кислот, концентрация которых выражена 1:Х, где X — целое число, показывающее, сколько объемов воды надо взять на один объем концентрированной кислоты. Например, раствор кислоты 1:5 означает, что при приготовлении раствора смешали 5 объемов воды с 1 объемом концентрированной кислоты.
Пример 3. Надо приготовить 1 л раствора серной кислоты 1:7. Всего будет 1+7 = 8 частей. Каждая часть равна 1000 :8 = 125 мл. Следовательно, нужно взять концентрированной серной кислоты 125 мл, воды 875 мл.
При приготовлении растворов кислот нужно соблюдать следующие правила:
- Раствор нельзя приготовлять в толстостенной бутыли, так как при разбавлении кислот, особенно серной, происходит сильное разогревание. Растворы кислот готовят в колбах.
- При разбавлении нельзя лить воду в кислоту. В колбу наливается рассчитанное количество воды, а затем тонкой струей, постепенно, при перемешивании добавляют нужное количество кислоты. Кислоту и воду отмеривают мерными цилиндрами.
- После того как раствор остынет, его переливают в бутыль и наклеивают этикетку (бумажную этикетку парафинируют); можно сделать этикетку особой краской прямо на бутылях.
- Если концентрированная кислота, из которой будут готовить разбавленный раствор, хранится долгое время, необходимо уточнить ее концентрацию. Для этого измеряют ее плотность и по таблице находят точное содержание кислоты в растворе.
Точные растворы
Концентрацию точных растворов выражают в виде нормальной или молярной концентрации или титром.
Навески для приготовления точных растворов рассчитывают с точностью до четвертого десятичного знака, а молекулярные массы берут с точностью, с которой они приведены в справочных таблицах. Навеску берут на аналитических весах; раствор готовят в мерной колбе, т. е. количество растворителя не рассчитывают.
Приготовленные растворы не хранят в мерных колбах, а переливают в бутыль с хорошо подобранной пробкой. Если точный раствор нужно перелить в бутыль или в другую колбу, поступают следующим образом. Бутыль или колбу, в которую будут переливать раствор, тщательно моют, ополаскивают несколько раз дистиллированной водой и дают постоять в перевернутом виде, чтобы вода стекла, или сушат.
Ополаскивают бутыль 2-3 раза небольшими порциями того раствора, который будут туда переливать, а затем переливают сам раствор.
Точные растворы должны быть по возможности свежими. Каждый раствор имеет свой предельный срок хранения. Растворы при стоянии изменяют свой титр, поэтому их время от времени следует проверять. На каждой бутыли или колбе должна быть надпись с указанием вещества, точной концентрации раствора, времени изготовления и времени проверки титра.
Расчеты при приготовлении молярных или нормальных растворов проводят следующим образом.
Пример 1. Требуется приготовить 2 л 0,5 М раствора Na2C03. Молярная масса Na2C03 равна 106. Следовательно, 1 л 0,5 М раствора будет содержать 106X0,5= =53 г Na2C03. Для приготовления 2 л необходимо взять 53x2=106 г Na2C03. Это количество соли будет содержаться в 2 л раствора.
Пример 2. Требуется приготовить 500 мл 0,1 н. раствора Na2S04. Подсчитываем эквивалентную массу соли.
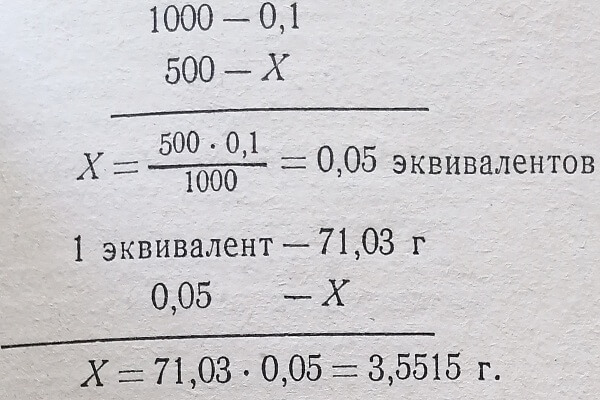
Техника приготовления точных растворов
Приготовление по точно взятой навеске
Для приготовления раствора поступают следующим образом. Мерную колбу тщательно моют хромовой смесью, много раз споласкивают водой из-под крана и затем 3-4 раза дистиллированной водой. На аналитических весах берут на часовом стекле или в бюксе рассчитанную навеску вещества, подлежащего растворению и высыпают ее в мерную колбу через сухую воронку. Пересыпать надо очень аккуратно, чтобы не пересыпать мимо колбы ни одной крупинки. Остатки с часового стекла или из бюкса очень тщательно смывают из промывалки в воронку дистиллированной водой. Затем обмывают внутренние стенки воронки и наружную часть трубки, слегка приподняв ее. Надо следить за тем, чтобы общее количество воды, использованное для обмывания часового стекла или бюкса, а также воронки, занимало не более половины колбы. Колбу закрывают пробкой и осторожным вращательным движением (не переворачивая колбу!) перемешивают содержимое до тех пор, пока навеска полностью не растворится.
После этого доводят колбу до метки дистиллированной водой. Для этого наливают из промывалки воду примерно на 1 см ниже метки. Ставят колбу так, чтобы метка была на уровне глаз, и осторожно по каплям добавляют воду до тех пор, пока нижняя часть мениска не будет касаться метки на шейке колбы (рис. 48). Тщательно закрывают колбу пробкой и перемешивают раствор 12-15 раз.
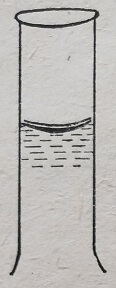
Рис. 48. Положение мениска в мерной колбе.
Не всегда необходимо отвешивать количество вещества, точно равное рассчитанному. Можно взять навеску, близкую к расчетной (расходящуюся с ней в третьем и четвертом десятичных знаках) и взвесить ее с точностью до четвертого знака. Далее раствор готовится так, как было описано выше. Таким образом мы будем иметь раствор, точная концентрация которого нам известна.
Приготовление из фиксаналов
Для приготовления точных растворов различных кислот удобно пользоваться так называемыми фиксаналами, представляющими собой запаянные стеклянные ампулы с точными навесками реактивов. На каждой ампуле есть надпись, показывающая, какое вещество и в каком количестве находится в ампуле. Из фиксаналов можно готовить так же растворы солей и щелочей.
Необходимо помнить, что фиксаналы, содержащие щелочь, пригодны в течение определенного срока. Перед тем, как использовать фиксанал щелочи, надо внимательно осмотреть содержимое ампулы. Раствор должен быть абсолютно прозрачным.
Из фиксаналов можно готовить точные растворы таких солей, которые не удовлетворяют требованиям, предъявляемым веществам, из которых можно готовить точные растворы по точно взятой навеске.
Для приготовления раствора из фиксанала поступают следующим образом (рис. 49).
Рис. 49. Приготовление раствора из фиксанала.
В чисто вымытую мерную колбу вставляют воронку, тщательно вымытую и сполоснутую дистиллированной водой (если в ампуле содержится не раствор, а сухое вещество, то воронка должна быть сухой). Затем в воронку вставляют специальный стеклянный боек (обычно прилагается к коробке с фиксаналами), также сполоснутый дистиллированной водой. Ампулу протирают спиртом, чтобы удалить надпись, и обмывают дистиллированной водой. Затем ее вставляют в воронку так, чтобы она своим тонким, втянутым внутрь дном касалась бойка, приподнимают ее и слегка ударяют о конец бойка. Содержимое ампулы попадает через воронку в колбу. Сбоку в ампуле имеется углубление, в котором пробивают отверстие стеклянной палочкой с заостренным концом. Через это отверстие обмывают дистиллированной водой из промывалки стенки ампулы. Промывать нужно много раз маленькими порциями. После этого споласкивают стенки ампулы снаружи и ампулу выбрасывают. Ополаскивают воронку и боек, затем поднимают воронку и обмывают наружную часть трубки воронки. Обмывают верхнюю часть шейки мерной колбы. Производя все эти операции по промыванию, следят, чтобы количество воды в мерной колбе к концу всех операций не превысило 1/3 объема колбы. Осторожно вращательным движением перемешивают содержимое колбы.
Приготовление растворов по приблизительно взятой навеске
Способ приготовления растворов по точно взятой навеске применим не для всех веществ. Некоторые соли, все щелочи и многие кислоты легко изменяют на воздухе свой состав.
Для получения раствора такого вещества с точно известной концентрацией поступают следующим образом. На техно-химических весах берут рассчитанную навеску с точностью до второго десятичного знака. Растворять навеску можно не в мерной колбе, а в простой плоскодонной и воду отмеривать мерным цилиндром. Если нужно приготовить раствор щелочи, вещества отвешивают несколько больше рассчитанного количества.
Точную концентрацию приготовленного раствора устанавливают объемным путем – титрованием. Таким образом, мы получаем раствор не с точно приготовленной, а с точно установленной концентрацией.
Приготовление точного раствора кислоты из концентрированной кислоты
Как было указано выше, точные растворы кислот готовят из фиксанала. Однако в случае отсутствия фиксанала можно рекомендовать следующий способ приготовления точного раствора кислоты. Измерив плотность концентрированной кислоты, по таблице определяют ее концентрацию и производят расчет.
Сухую бюретку со стеклянным краном споласкивают 2 раза концентрированной кислотой и заполняют как указано в § 34. В мерную колбу наливают около 1/4 объема дистиллированной воды и осторожно выпускают из бюретки концентрированную кислоту с точностью до сотых долей мл. Перемешивают раствор, дают ему остыть и доводят водой содержимое колбы до метки.