Микроскопическое исследование мокроты
Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Предметные и покровные стекла.
- Чашки Петри.
- Зубоврачебные шпатель и игла.
- Черная и белая бумага.
- Микроскоп.
- Газовая или спиртовая горелка.
- Смесь Никифорова.
- Краска Романовского.
- Едкий натр.
- Эозин.
- Желтая кровяная соль.
- Концентрированная соляная кислота.
- Метиленовая синька.
- Вода.
- Спички.
Отбор материала и приготовление препаратов для микроскопического исследования
Мокроту, помещенную в чашку Петри, распластывают с помощью шпателя и иглы до получения полупрозрачного слоя (шпатель и иглу захватывают правой и левой рукой в виде писчего пера); это делают очень осторожно, чтобы не разрушить имеющиеся в мокроте образования. Полупрозрачный слой мокроты изучают с целью выявления в нем линейных и округлых частиц и образований, клочков, отличающихся по цвету и консистенции. Для этого чашку Петри с мокротой располагают попеременно на белом и черном фоне. Найденные образования выделяют из основной массы (слизи, гноя, крови) режущими движениями инструментов, стараясь не повредить выделенные частицы. Полноценным приготовленный препарат будет лишь в том случае, если будут последовательно отобраны все интересующие исследователя частицы и образования. Отобранный материал помещают на предметное стекло. При этом более плотные по консистенции частицы помещают ближе к центру намечаемого препарата, а менее плотные, так же как и слизисто-гнойные, гнойно-слизистые, кровянисто окрашенные образования, — по периферии. Материал покрывают стеклом. Обычно на одном предметом стекле готовят два препарата, что обеспечивает максимальный просмотр отобранного материала. В правильно приготовленных препаратах мокрота не выходит за пределы покровного стекла.
Если мокрота вязкой или тягучей консистенции, то на покровное стекло слегка надавливают, чтобы равномернее распределить материал. Препараты, предназначенные для микроскопического исследования, изучают вначале под малым, а затем под большим увеличением микроскопа при опущенном конденсоре.
Важно уметь находить различные элементы мокроты не только при большом, но и при малом увеличении.
Изучение элементов мокроты, встречающихся в препаратах при микроскопическом исследовании
1. Слизь — волокнистая или сетевидная, вместе с форменными эле¬ментами (лейкоцитами, эритроцитами), сероватого цвета.
2. Эпителий — плоский, круглый (альвеолярные макрофаги), цилиндрический (мерцательный).
Плоский эпителий имеет форму полигональных бесцветных клеток с обильной цитоплазмой и одним ядром.
Эпителий цилиндрический, мерцательный (бронхов) (рис. 51, 3) представляет собой продолговатой формы клетки, один из концов которых сужен, а на другом — тупом — нередко видны реснички; ядро, круглой или овальной формы, расположено эксцентрично в широкой части клетки; цитоплазма содержит мелкую зернистость. Иногда (при бронхиальной астме) эпителий бронхов выявляется в виде железистоподобных образований, которые в свежевыделенной мокроте имеют движущиеся реснички.

Рис. 51. Клеточные элементы в мокроте и эластические волокна: лейкоциты (1), альвеолярные макрофаги (2), эпителий бронхов (3), миелин (4), эластические волокна простые (5), коралловидные (6), обызвествленные (7).
Альвеолярные макрофаги — это круглой формы клетки по размерам в несколько раз больше лейкоцитов, с выраженной зернистостью в цитоплазме, из-за которой в большинстве случаев не видно ядра. Зернистость обычно сероватого цвета. Подвергаясь, жировому перерождению, альвеолярные макрофаги становятся более темными, так как капли жира, накапливающиеся в клетке, сильнее преломляют лучи проходящего через них света.
При наличии угольного пигмента часть зернистости приобретает черный цвет. У курильщиков альвеолярные макрофаги содержат буровато-желтую зернистость. Золотисто-желтая зернистость обусловлена наличием в альвеолярных макрофагах кровяного пигмента, содержащего железо (гемосидерин). С целью обнаружения гемосидерина в мокроте используют химическую реакцию.
Реакция на гемосидерин в мокроте
С препарата, в котором были обнаружены альвеолярные макрофаги с лимонно-желтой или золотисто-желтой зернистостью, снимают покровное стекло. Мокроту подсушивают на воздухе. На 8-10 минут на препарат наливают реактив (смесь равных объемов 3% раствора соляной кислоты и 5% раствора желтой кровяной соли). Через 8-10 минут реактив сливают. Препарат накрывают покровным стеклом и изучают под большим увеличением.
При наличии гемосидерина альвеолярные макрофаги окрашиваются в синий (голубой) цвет (рис. 52).

Рис. 52. Реакция на гемосидерин в мокроте. 1 - до окраски, 2 - после окраски.
3. Миелин (рис. 51, 4) — различной формы матово-серые образования, которые могут находиться в мокроте внеклеточно, а также внутри альвеолярных макрофагов.
Для отличия миелина от капелек жира используют микрореакцию: к материалу, в котором был обнаружен миелин, осторожно прибавляют одну каплю концентрированной H2SO4; при этом миелин окрашивается в оттенки от фиолетового до красного цвета.
4. Нейтрофилы. Морфологически нейтрофилы напоминают лейкоциты, встречающиеся в моче. В гнойной мокроте происходит разрушение лейкоцитов, поэтому в некоторых местах препарата находят зернистую бесструктурную массу (детрит).
5. Эозинофилы. Имеют ряд отличительных от нейтрофилов признаков. Они несколько больше их по размеру, содержат крупную зернистость, благодаря чему выглядят более темными. Их скопления при малом увеличении имеют желтоватый оттенок. Особенно много эозинофилов содержится в желтоватых рассыпчатых клочках мокроты больных бронхиальной астмой. Иногда среди эозинофилов находят кристаллы Шарко-Лейдена. Для более точного распознавания эозинофилов препарат окрашивают.
Техника окраски эозинофилов. Мокроту распределяют по предметному стеклу. Препарат высушивают на воздухе и фиксируют над пламенем горелки. Теплое стекло помещают на 3 минуты в 0,5% спиртовой раствор эозина, а затем промывают водой и красят в течение нескольких секунд 0,5-1% водным раствором метиленовой синьки. Вновь промывают водой, высушивают и изучают под микроскопом с иммерсией. В эозинофилах выявляют красную зернистость (рис. 53). Окрасить эозинофилы можно также способом Романовского. С этой целью препарат окрашивают точно так же, как мазки крови, но только меньше времени (8-10 минут).

Рис. 53. Эозинофильные лейкоциты в мокроте (масляная иммерсия).
6. Эритроциты — неизмененные выглядят так же, как и в моче. В бурых кровянистых частицах они обычно не обнаруживаются.
7. Жирно-зернистые клетки (рис. 54, 1) — округлой формы, в несколько раз больше лейкоцитов, содержат жировые капельки, сильно преломляющие свет.
8. Клетки злокачественных новообразований (рис. 54, 2) — разных размеров, жиро- и вакуольно-перерожденные. Встречаются отдельно и в виде тесных округлых групп или стержневидных образований, луковиц и пр.

Рис. 54. 1 — жирно-зернистые клетки; 2 — железистоподобная группа из атипического эпителия при железистом раке легкого. Нативный препарат. Увеличение 300х. Микрофотография.
9. Эластические волокна (см. рис. 51, 5, 6, 7):
а) простые эластические волокна — блестящие, тонкие, нежные двуконтурные образования, толщина которых равномерна на всем протяжении. Встречаются скоплениями среди гнойных частиц и в мелких плотноватых клочках, в виде обрывков и единичных волокон среди казеозного распада;
б) коралловидные эластические волокна. Представляют собой простые эластические волокна, покрытые мылами. В связи с этим они лишены блеска, грубее и толще простых эластических волокон;
в) обызвествленные эластические волокна. Они грубее и толще простых эластических волокон, часто фрагментированы, некоторые из них напоминают палочковидные образования. Наиболее часто этот вид волокон располагается среди аморфной массы солей извести и капелек жира, что называют обызвествляющим жировым казеозным распадом. Обызвествляющий жировой казеозный распад, обызвествленные эластические волокна, кристаллы холестерина и микобактерии туберкулеза называют тетрадой Эрлиха.
Элементы тетрады Эрлиха легче обнаружить, если при тщательном макроскопическом исследовании мокроты отобрать беловатые рассыпчатые клочки.
В некоторых случаях для отличия коралловидных волокон от обызвествленных используют микрохимическую реакцию. К исследуемому материалу добавляют 1-2 капли 10-20% раствора NaOH; мыла, покрывающие коралловидные волокна, растворяются, и из-под их покрова освобождаются простые эластические волокна; обызвествленные эластические волокна под влиянием воздействия щелочи не изменяются. При обнаружении в нативном препарате эластических волокон препарат обязательно окрашивают по Цилю-Нильсену. В некоторых случаях прибегают к обработке мокроты с целью обнаружения простых эластических волокон.
Техника обработки мокроты с целью выявления эластических волокон. К небольшому количеству мокроты прибавляют равный объем 10% раствора щелочи; смесь нагревают до растворения, а затем разливают в две центрифужные пробирки и центрифугируют, предварительно добавив по 5-8 капель 1% спиртового раствора эозина. Из осадка готовят препарат и рассматривают под микроскопом. Эластические волокна окрашиваются в оранжево-красный цвет (рис. 55).

Рис. 55. Эластические волокна в мокроте.
10. Фибрин — имеет форму тонких волоконец, расположенных параллельными пучками пли сетевидно.
11. Кристаллы гематоидина — ромбовидные или игольчатые, красновато-оранжевого цвета.
12. Холестерин — бесцветные таблички со ступенчатообразными уступами.
13. Кристаллы Шарко-Лейдена (рис. 56) — ромбовидные, бесцветные кристаллы, напоминающие стрелку магнитного компаса.
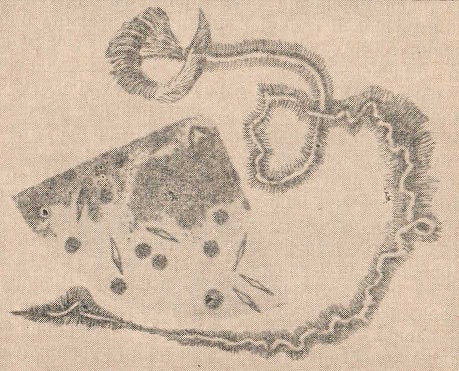
Рис. 56. Эозинофилы, кристаллы Шарко-Лейдена, спираль Куршмана.
14. Кристаллы жирных кислот (рис. 57) — имеют вид длинных слегка изогнутых серых игольчатых образований.
15. Спираль Куршмана (см. рис. 56) — слизистое, спиралевидное закругленное образование, имеющее центральную нить и мантию. В некоторых случаях спираль имеет либо центральную нить, либо мантию. Наряду со спиралью часто в одном и том же препарате обнаруживают эозинофилы и кристаллы Шарко-Лейдена.
16. Пробка Дитриха (см. рис. 57) — беловатого или желтовато-сероватого цвета комочки творожистой копсистенции, иногда со зловонным запахом, сходные по форме с зернами чечевицы. Состоят из кристаллов жирных кислот, нейтрального жира, детрита и скоплений бактерий.

Рис. 57. Пробка Дитриха. Иглы жирных кислот; жир нейтральный; детрит. Нативный препарат. Увеличение 280х.
17. Рисовидные тельца — округлые, плотные образования. Содержат скопления коралловидных волокон, продуктов жирового распада, мыла, кристаллы холестерина и большое количество микобактерий туберкулеза.
18. Друзы актином ицетов (рис. 58) — при малом увеличении представляют собой округлые образования с резко очерченными контурами, желтоватого цвета, с аморфной серединой и с более темной окраской по краям; при большом увеличении центр друзы представляет собой скопление лучистого грибка, нити которого на периферии заканчиваются колбовидными вздутиями. При окраске по Граму нити мицелия грибка грамположительны, а колбовидные вздутия грамотрицательны.

Рис. 58. Друзы актиномицетов.
19. Элементы эхинококка (рис. 59) — хитиновая оболочка эхинококкового пузыря (в тонких местах прозрачна и имеет нежную параллельную исчерченность), крючья и сколексы эхинококка.

Рис. 59. Элементы эхинококка. 1 - пленка эхинококкового пузыря, 2 - крючья эхинококка, 3 - сколексы




