Система эритроцитарной аденилаткиназы
Аденилаткиназа (АК) (КФ 2.7.4.3) катализирует реакцию АТФ+АМФ=2АДФ.
Впервые генетически детерминированный полиморфизм эритроцитарной аденилаткиназы (АК) описали R. Fildes и Н. Harris (l966). Авторы применили метод электрофореза в крахмальном геле с последующим выявлением активности АК. Было найдено три фенотипа АК: АК-1, АК-2-1 и АК-2. При исследовании гемолизатов: эритроцитов крови не связанных родством англичан установлено, что приблизительно 90% лиц обладают фенотипом АК-1 и около 10% – фенотипом АК-2-1. Фенотип АК-2 встречается довольно редко (0,5–1%) и при первичном популяционном обследовании он был выявлен только у 5 человек.
В семейных обследованиях, а также исследованиях пар мать – ребенок выявлена строгая генетическая обусловленность вариантов АК. Не было установлено статистически достоверных различий в частоте встречаемости фенотипов АК среди лиц различного пола. Все эти данные дали возможность создать формально-генетическую гипотезу, согласно которой варианты АК контролируются аллельными генами АК1 и АК2 в соответствующем ауто-сомальном генном локусе без доминирования. По этой гипотезе, фенотипы АК-1 и АК-2 являются гомозиготными по соответствующим аллелям, а фенотип АК-2-1 – гетерозиготным по аллелям АК1 и АК2.
Для выявления генетически обусловленных типов АК предложено несколько электрофоретических методов.
Метод R. Fildes и Н. Harris (1966) – горизонтальный электрофорез в геле крахмала с использованием прерывистой буферной системы pH 7,0. Электродный буфер: 0,41 М лимонной кислоты в 1 л дистиллированной воды, доведенной до pH 7,0, 1 N NaOH. Гелевый буфер: 0,005 М хлорида гистидина в 1 л дистиллированной воды. Электрофорез проводят в течение 4–5 ч при напряжении 10 В/см с усиленным циркуляционным охлаждением.
Метод J. Bowman и соавт. (1967) – вертикальный электрофорез в крахмальном геле с применением непрерывной фосфатной буферной системы pH 6,2. Электродный буфер: 0,25 М фосфатный буфер. Гелевый буфер: переходный буфер, разведенный дистиллированной водой 1:10. Электрофорез проводят 14– 16 ч при напряжении 5–6 В/см и температуре +4–6 °С.
Метод Н. Sonneborn и W. Renninger (1971) – электрофорез на ацетатцеллюлозных пленках или мембранах. Используют 0,02 М фосфатный буфер с pH 6,4. Электрофорез проводят 80–90 мин при напряжении на клеммах 300 В.
Метод G. Bauer и соавт. (1972) – горизонтальный высоковольтный электрофорез в тонкослойном крахмальном геле с применением непрерывной фосфатной буферной системы pH 6,2. Электрофорез проводят при напряжении 12–14 В/см с усиленным циркуляционным охлаждением.
Метод G. Radam и Н. Strauch (1968) – горизонтальный электрофорез в крахмальном геле при различной молярной концентрации переходного буфера на электродах. К достоинствам метода следует отнести его быстроту, четкость разделения групповых изоферментов АК, а также возможность многорядного нанесения исследуемых образцов гемолизатов в блок крахмального геля. Электродный буфер: 0,33 М фосфатный буфер pH 6,5 (31,75 г КН2Р04 и 17,9 г Na2HP04 в 1 л дистиллированной воды). В катодной ванне используют этот буфер, а в анодной – разведенный да концентрации фосфатных электролитов, равной 0,066 М. В качестве гелевого буфера применяют тот же фосфатный буфер, но разведенный до концентрации электролитов, равной 0,00375 М. Электрофорез проводят 3 ч при напряжении 7 В/см и температуре +4–6 °С.
Метод Н. Норре и соавт. (1972) – горизонтальный электрофорез в ПААГ-блоках. Доказано, что полиакриламидные гели обладают максимальной разрешающей способностью. Однако различные катализаторы и регуляторы полимеризации, входящие в состав ПААГ, резко снижают активность многих эритроцитарных ферментов (КФЭ, ФГМ, АК, ФГД, ГПТ и др.), что делает невозможным выявление их групповых изоферментов. Сильными ингибиторами ферментативной активности являются персульфат аммония (надсернокислый аммойий), цианагум-41 и ТЭМЭД. дл устранения неблагоприятного влияния этих компонентов Пддр на активность ферментов Н. Норре и соавт. (1972) предложила использовать предварительное диффузное промывание таких гелей в дистиллированной воде с последующим насыщением их гелевыи буфером. Методика разработана для выявления в ПААГ групповых изоферментов не толькко АК, но и других эритроцитарных ферментов. Применяют 5% ПААГ, который получают при смешивании равных объемов четырех водных растворов: а) 20% раствор акриламида и 0,8% раствор N', N'-метиленбисакриламида, б) 1,6% раствор цианагума-41 (диметиламинопропионитрил), в) 0,03% раствор красной кровяной соли (феррицианид калия), г) 0,48% раствор персульфата аммония. После заливки растворов гелевую кювету плотно закрывают притертой стеклянной пластинкой поставляют на свету (для фотополимеризации) на 1–17г ч. Затем кюветы с ПААГ на 12 ч помещают в сосуд с дистиллированной водой, а потом на неделю в сосуды с соответствующими гелевыми буферами, причем буферные растворы за это время меняют не менее 5 раз. Скорость промывания гелевых блоков, насыщения гелей буферными растворами зависит как от объема самих буферных растворов, так и скорости их циркуляции вокруг гелевых блоков. Готовые для электрофореза блоки полиакриламида хранят при -f-40– 8 °С в буферных растворах, содержащих консервант (мертиолят, азид натрия и др.).
Для электрофоретического разделения групповых изоферментов АК Н. Норре и соавт. (1972) использовали непрерывную фосфатную буферную систему, предложенную G. Radam и Н. Strauch (1968), с небольшими изменениями: переходный буфер – 0,2 М натриево-калиевый фосфатный буфер pH 6,2 (на катоде), на аноде – «катодный» переходный буфер, разведенный дистиллированной водой 1:4. В качестве гелевого буфера использовали «катодный» переходный буфер, разведенный дистиллированной водой 1:10. Для электрофореза применяли ПААГ-блоки размером 20Х14x0,4 см. Одновременно исследовали 30 образцов (три ряда по 10), причем стартовые щели для внесения гемолизатов располагались в 7; 12 и 18 см от катодного края гелевого блока. Электрофорез проводили 15 ч при напряжении 4 В/см и температуре +4 °С.
Активность АК выявляли, используя либо метод инкубации в жидкой реакционной среде, либо метод агаровой аппликации. В первом случае состав инкубационной среды был следующим: 100 мл 0,05 М трис-НС1-буфер (pH 7,1) содержал 20 мг нитросинего тетразолиевого (НСТ), 3 мг ФМС, 25 мг НАДФ, 90 мг глюкозы, 20 мг MgCl2 6Н2О, 20 мг АДФ, 160 ед дрожжевой гексокиназы (0,035 мл) и 80 ед Г6ФД (0,035 мл). Время инкубации 1–IV2 4 при 37 °С до появления хорошо выраженных зон фиолетового формазана, выпавшего в местах активности АК.
При агаровой аппликации использовали 20 мл 0,1 М трис буфера (pH 8,0), добавляли в него 100 мг растворимого агара и кипятили на водяной бане до полного растворения агара. После охлаждения в раствор добавляли 40 мг глюкозы. 10 мг АДФ, 2 мг НАДФ, 2 мг ФМС, 2 мг МТТ, 0,7 ед Г6ФД и 1,4 ед гексокиназы. После растворения реагентов теплый раствор агара заливали на поверхность гелевого блока и инкубировали 20–30 мин при 37 °С.
Принцип выявления активности АК основан на следующих биохимических реакциях. К образовавшемуся в местах проявления активности АК АТФ добавляют глюкозу, которая в присутствии гексокиназы образует АДФ и Г6Ф. Последний в присутствии Г6ФД, НАДФ образует 6-фосфоглюконат и НАДФН2. В свою очередь восстановленная форма кофермента в присутствии ФМС и МТТ дает цветовую реакцию, конечный продукт которой – зерна нерастворимого формазана фиолетового цвета.
Кроме трех обычных фенотипов эритроцитарной АК (АК-1, АК-2-1 и АК-2), были найдены и довольно редкие атипичные варианты, передающиеся по наследству. Так, J. Bowman и соавт. (1967) описали две семьи, у членов которых наблюдалась наследственная передача двух новых необычных фенотипов фермента, названных авторами фенотипами АК-3-1 и АК-4-1. Уже само обозначение этих фенотипов свидетельствовало о том, что они генотипически являются гетерозиготными по основному, наиболее распространенному аллелю АК1 и атипичным аллелям, названным соответственно аллелями АКг и АК4.
Проведенные в последнее время семейные обследования свидетельствуют о возможности наследственной передачи еще одного, по-видимому, крайне редкого атипичного гетерозиготного фенотипа АК-3-2.
Спектры групповых изоферментов трех основных и двух редких атипичных фенотипов эритроцитарной АК показаны на рис. 16. При электрофорезе в крахмальном и полиакриламидном геле почти все групповые изоферменты либо располагаются около стартовых лунок, либо мигрируют с различной скоростью к аноду.
Частота встречаемости основных аллелей АК1 и АК2 среди различных европейских популяций отличается исключительной стабильностью, причем частота встречаемости аллеля АЮ (95–97%) превалирует над частотой встречаемости аллеля АК2 (2,9–4,5%). Этим объясняется значительное преобладание гомозиготного фенотипа АК-1 (90–92%) над гетерозиготным фенотипом АК-2-<1 (7– 7,5%) и особенно гомозиготным фенотипом АК-2 (0,1 – 0,5%). Популяционно-генетические исследования наследственного полиморфизма системы АК, проведенные за последнее время, показали, что среди негроидных и особенно монголоидных популяций частота встречаемости аллеля АК2 значительно ниже, чем в европеоидных популяциях. Более того, например, у индейцев Северной Америки, эскимосов и лопарей аллель АК2 вообще не выявлен и во всех этих популяциях в 100% случаев наблюдается гомозиготный фенотип АК-1.
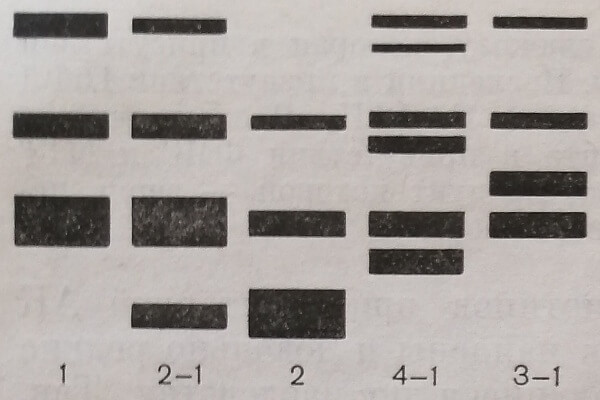
Рис. 16. Схематическое изображение трех основных (1,2-1,2) и двух атипичных фенотипов (4-1, 3-1) латкиназы
Исходя из относительной мономорфности этой эритроцитарвои 1 2-1 2 4-1 3 ферментной системы,
имеющей, как мы говорим, «неблагоприятную» по информативности частоту встречаемости ее основных аллели, вероятность исключения мужчин, ложно указанных в качестве отца того или иного ребенка, при использовании только системы АК будет довольно низкой. Например, по данным J. Bowman и соавт. (1967), для европеоидных популяций средняя процентная вероятность исключения мужчин, не являющихся отцами тех или иных детей, составляет 4,28; для негроидных и монголоидных популяций она значительно ниже и соответственно 0,59 и 0%. Однако редкие атипичные аллели этой ферментной системы (АК3 и АК4), обусловливающие появление редких гетерозиготных фенотипов АК-3-1, АК-4-1, АК-3-2, АК-4-2, а также еще более редких гомо- или гетерозиготных фенотипов АК-3-3, АК-4-4 и АК-3-4, могут быть использованы при условии их обнаружения у ребенка и его предполагаемого отца в качестве достоверного признака, который свидетельствует о том, что предполагаемый отец является фактическим отцом данного ребенка.
Как и в большинстве других генетически детерминированных системах крови человека, в генном локусе ферментной системы АК выявлен довольно редкий атипичный «скрытый» или «немой» аллель АК°, генетически не реализующий появление групповых изоферментов АК, а, следовательно, снижающий активность АК приблизительно в 2 раза при условии его гетерозиготности с одним из основных аллелей АК1 или АК2 этой системы. Таким образом, при исключении возможности отцовства или материнства по этой ферментной системе в случаях противоположной гомозиготности системы АК у ребенка и его предполагаемого отца (или матери) судебно-медицинский эксперт должен обращать внимание на выраженность групповых изоферментов АК в противоположных гомозиготных фенотипах системы для того, чтобы не «пропустить истинную гетерозиготность маскирующуюся гомозиготностью. При подозрении на действие в обследуемой семье аллеля АК° эксперт должен провести количественный анализ активности АК у всех проходящих по делу лиц, а если это возможно, и у их ближайших родственников.
Определенный интерес для генетиков и судебных медиков представляют наблюдения Ch. Salmon и соавт. (1968). В крови одной женщины, не имевшей в анамнезе темотрансфузий, авторы нашли эритроциты с различной трупповой характеристикой по системе АВО и АК. Одна группа эритроцитов крови этой жещины содержала «сильный» антиген Ai и имела аденилаткиназный фенотип АК-2-1, в другой группе эритроцитов находился исключительно «слабый» антиген А (близкий к Ах) и они относились к фенотипу АК-1. По 13 другим эритроцитарным системам крови обе группы эритроцитов были однородными. На протяжении 6 лет наблюдения первая популяция эритроцитов (Ai, АК-2н1) составляла в разные годы 33,51–44% всей массы эритроцитов. Эти наблюдения, несомненно, свидетельствуют о тесном сцеплении генных локусов систем АВО и АК и расположении их на одной и той же аутосомальной хромосоме. По-видимому, у данной женщины в определенный период по каким-то причинам произошел перекрест хромосом (кроссинговер) и в результате наступило мутационное изменение некоторых наследственных признаков. В дальнейшем в результате многократных митозов нормальной и мутантной клетки возникли два клеточных клона, один из которых обусловливал продукцию нормальных эритроцитов крови, а другой обладал свойствами мутантной клетки. Дальнейшие исследования полностью подтвердили генетическую корреляцию генных локусов систем АВО и АК.
Итак, в настоящее время основным методом определения групп АК остается электрофорез в крахмальном геле с различными модификациями. Разрешающая способность метода позволяет эксперту четко диагностировать три основных фенотипа этой системы. Однако для выявления атипичных фенотипов АК 1-го генного локуса этой системы, а также фенотипов АК 2-го и 3-го генных локусов, открытых сравнительно недавно, разрешающая способность метода, по мнению некоторых авторов, может быть недостаточной для проведения экспертизы.
В последние годы разработаны и другие методы электрофоретического разделения изоферментов АК: на
татцеллюлозных мембранах, целлогеле и в тонком слое геля агарозы.
Однако многие исследователи справедливо указывают что лучшие результаты разделения изоферментных
спектров не только системы АК, но и многих других генетически детерминированных систем получают при электрофорезе на ПААГ-блоках, из которых удалены различные регуляторы и катализаторы полимеризации гелей, прежде всего ТЭМЭД, цианогум-41 и персульфат аммония, являющиеся ингибиторами активности многих эритроцитарных ферментов, в том числе и АК. Но, по нашему мнению, методики предварительного вымывания избытка регуляторов и катализаторов полимеризации ПААГ, предложенные Н. Норре и соавт. (l972), не решают проблемы использования этой среды для выявления большинства эритроцитарных изоферментов. Эти методы чрезвычайно трудоемки, требуют большого количества гелевого буфера, меняющегося не менее 5 раз в течение одной недели, продолжительны по времени (на подготовку одного гелевого блока затрачивается, как минимум, неделя). Кроме того, длительное пребывание ПААГ в буферных растворах приводит к разбуханию блоков, снижению разделительных свойств.
Наиболее эффективными являются такие механизмы полимеризации ПААГ, в которых вообще не участвуют ингибирующие активность многих эритроцитарных ферментов катализаторы и регуляторы полимеризации гелей (ТЭМЭД, цианогум-41 и персульфат аммония). Опыты показали, что ПААГ, полученные по методу G. Pals и J. Pronk (l979), не нуждаются в предварительной длительной обработке, предшествующей использованию их для выявления групповых изоферментных спектров, поскольку входящие в состав таких гелей реагенты пе являются ингибиторами ряда ферментов. Для приготовления гелей на 100 мл соответствующей смеси акриламида, N', N'-метиленбисакриламида и буферных электролитов требуется 0,13 мг FeS04-7Ha0, 19 мг аскорбиновой кислоты и 0,12 мл 3% перекиси водорода.
Качество разделения групповых изоферментов многих эритроцитарных ферментов, а так же и изоферментов АК, в таких гелях не уступает разделению в гелях, полученных при помощи ингибирующих ферментативную активность регуляторов и катализаторов полимеризации ПААГ.




