Система эритроцитарной глутамат-пируват-аминотрансферазы
Глутамат-пируват-аминотрансфераза (ГПАТ) выполняет в организме важную функцию в обмене углеводов и метаболизме аминокислот – катализирует обратимую реакцию переноса аминной группы.
ГПАТ является одним из ферментов, существующих в двух структурах клетки – цитоплазме (растворимая форма) и митохондриях (нерастворимая форма). В зрелых эритроцитах крови человека имеется только цитоплазматическая растворимая форма этого фермента.
Впервые генетически детерминированный полиморфизм эритроцитарной ГПАТ описали S. Chen и Е. Giblett (1971). С помощью вертикального электрофореза гемолизатов эритроцитов в крахмальном геле авторы установили, что в эритроцитах крови различных людей можно выявить три различных изоферментных спектра. Семейные обследования, а также обследования пар мать – ребенок, проведенные авторами, отчетливо свидетельствовали о простом аутосомальном кодоминантном порядке наследования вариантов фермента, согласующемся с формально-генетической гипотезой контролирования полиморфизма двумя аллельными генами ГПАТ1 и ГПАТ2 в соответствующем генном локусе без доминирования. Согласно этому полиморфизм системы ГПАТ проявляется тремя фенотипами: двумя гомозиготными – ГПАТ-1 и ГПАТ-2 и одним гетерозиготным – ГПАТ-2-1.
Для выявления групповых изоферментов ГПАТ используют в основном метод вертикального или горизонтального электрофореза в крахмальном геле, предложенный Е. Giblett (1971), S. Chen и соавт. (1972).
Для электрофореза используют непрерывную трис-цитратную буферную систему pH 7,5. Электродный буфер: 0,1 М триса и 0,028 М лимонной кислоты. Гелевый буфер: электродный, разведенный дистиллированной водой 1:10. Электрофорез проводят 17–18 ч при +4–6 °С и напряжении 10–12 В/см.
Существуют два метода выявления групповых изоферментов ГПТ – «ультрафиолетовый» по S. Chen и Е. Giblett (1971) и формазановый по J. Kompf (1972).
«Ультрафиолетовый» метод. В 100 мл 0,1 М трис-HCl- буфера pH 8 содержится 0,2 М DL-аланина, 0,0087 М а-котоглютаровой кислоты, 0,001 М восстановленного НАДН2 и 8 ME активности ЛДГ на 1 мл раствора. Крахмальный гель инкубируют в этой реакционной смеси в течение 3 ч при 37 °С. После инкубации гель промывают в дистиллированной воде и подвергают ультрафиолетовому облучению в темной комнате. При этом изоферментные элементы электрофоретически разделенной ГПАТ проявляются в виде нефлюоресцирующих участков на равномерном голубом флюоресцирующем фоне остальной поверхности крахмального геля. Принцип выявления изоферментов ГПАТ состоит в следующем. Посскольку ГПАТ катализирует обратимую реакцию перехода Галанина и а-кетоглутарата в пируват и L-глутамат, то в присутствии ЛДГ образовавшийся пируват переходит в L-лактат. Последний в свою очередь, окисляет флюоресцирующую в ультрафиолетовых лучах восстановленную форму НАДН2 в окисленную форму НАД, которая не флюоресцирует.
Этот метод не лишен недостатков, сводящихся в основном к трудностям регистрации результатов исследования (фотографирование в темном помещении нефлюоресцирующих изоферментов и нестойкость нефлюоресцирующих зон).
Формазановый метод позволяет легко фотографировать изоферментные спектры, которые достаточно стабильны и четки.
Формазановый метод. Инкубационная смесь содержит 360 ME активности ЛДГ и 50 мл 0,2 М трис-цитратного буфера, в котором растворено 0,4 г L-аланина, 0,05 г а-кетоглутаровой кислоты, 0,03 г НАДФ, 0,003 г ФМС, 0,004 МТТ, 0,002 г пиридоксаль-5-фосфата. Крахмальный гель инкубируют в этой реакционной смеси 2–3 ч при 37 °С до появления четких фиолетовых формазановых зон в местах проявления изоферментной активности. Некоторые авторы предлагают, кроме формазанового метода, использовать аппликацию в агаре.
Принцип цветовой формазановой реакции выявления ферментативной активности ГПТ следующий. Образующийся в процессе переноса аминогрупп пируват в присутствии ЛДГ переходит в L-лактат, который в присутствии пиридоксаль-5-фосфата восстанавливает окисленную форму НАДФ в восстановленную форму ЦАДФН2. Восстановленный НАДФН2 в присутствии ФМС и МТТ дает цветовую реакцию, в результате в осадок выпадают нерастворимые фиолетовые гранулы формазана.
Активность цитоплазматической ГПАТ в гемолизатах эритроцитов крови человека определяют колориметрическим методом. Принцип определения активности ГПАТ заключается в следующем. В результате реакции, которую катализирует ГПАТ, образуется пируват. Последний в реакции с динитрофенилгидразином образует гидразон. Гидразон экстрагируют из гемолизатов толуолом и к вытяжке для наступления цветовой реакции добавляют концентрированную щелочь. Интенсивность появившегося в результате такой обработки коричневого окрашивания экстракта пропорциональна количеству пирувата, образовавшегося в результате реакции транс-аминирования, а следовательно, и активности эритроцитарной ГПАТ.
Для исследования необходимы следующие реагенты. 1. Трис- НС1-буфер: 0,1 М раствор триса, доведенный до pH 7,8 НС1. 2. Раствор субстрата: 100 мМ L-аланина и 35 мМ а-кетоглутарата (натриевая соль) растворяют в трис-НС1-буфере и доводят до pH 7 8 0,2 М NaOH. 3. Красящий реагент: 0,1% 2,4-динитрофенилгидразин в 20% НС1. 4. Щелочной раствор: 2,5% КОН в 95/о этаноле. 5. Кислотный раствор: 100% трихлоруксусная кислота.
Две пробирки (опытная и контрольная) подогревают на водяной бане до 37 °С, в опытную пробирку добавляют 0,5 мл субстрата и через 10 мин в обе пробирки – по 0,5 мл гемолизата. Добавляют каплю кислотного раствора в контрольную пробирку сразу, а в исследуемую через 30 мин инкубации. Обе пробирки оставляют на 20 мин при комнатной температуре, затем в них добавляют по 2 мл толуола. Пробирки резко встряхивают и центрифугируют 1 мин. Из каждой пробирки берут по 1 мл толуолового экстракта и помещают в соответствующую кювету колориметра. В каждую кювету добавляют 3 мл щелочного раствора, перемешивают; оптическую плотность (Е) определяют при А,=490 нм. Стандартную кривую строят по данным измерения Е нескольких растворов 1 мМ пирувата при Х=10–500 нм. За единицу активности ГПАТ принимают такое количество фермента, которое образует 1 мкМ пирувата. Активность фермента в гемолизатах эритроцитов выражают в соответствующих единицах на 1 г НЬ (по цианметге» моглобиновому методу).
Обширный популяционно-генетический материал, накопленный при изучении полиморфизма эритроцитарной ГПАТ, свидетельствует о довольно благоприятной для судебно-медицинской экспертизы частоте встречаемости основных аллелей ГПАТ1 и ГПАТ2.
Почти одинаковая частота встречаемости этих аллелей среди европеоидных популяций обусловливает самый высокий для двухаллельной генетически детерминированной системы процент вероятного исключения отцовства только по одной системе ГПАТ. Такой средний показатель для европеоидной, монголоидной и негроидной популяций, по Данным S. Chen и Е. Giblett (1971), составляет соответственно 18,75; 18,26 и 42,85 %.
В. Olaisen (1975) отмечает довольно поздние сроки онтогенетического формирования групповых изоферментов ГПАТ у ребенка, которое наступает в конце 2-го месяца жизни. Автор рекомендует использовать полиморфизм системы ГПАТ в экспертизах спорного отцовства только в тех случаях, когда возраст ребенка достигнет 2 месяцев и больше. Кроме того, В. Olaisen подчеркивает, что исследование нужно проводить только со свежими гемолизатами эритроцитов, поскольку даже 3–4 дневное хранение изменяет электрофоретическую картину изоферментов; это может привести к ошибочной трактовке результатов.
Перспективность использования генетически обусловленного полиморфизма системы ГПАТ в экспертизах спорного отцовства обусловлена не только благоприятной частотой встречаемости двух основных аллелей ГПАТ1 и ГПАТ2 среди населения Земного шара, но и наличием многих атипичных аллелей в генном локусе этой системы Существование таких аллелей доказано обширными семейными обследованиями, обследованиями пар мать-ребенок и гомозиготных близнецов. Кроме того, атипичные аллели системы ГПАТ в отличие от множества атипичных аллелей в генных локусах других генетических систем крови человека не столько уж редки, вследствие чего вероятность обнаружения необычных фенотипов этой системы довольно высока. По мнению большинства судебных медиков, выявление атипичных фенотипов у ребенка и ответчика наряду с расширенным исследованием других генетических маркеров крови служит веским основанием для установления отцовства.
Уже в первых популяционно-генетических обследованиях, проведенных S. Chen и соавт. (1972), было выявлено несколько атипичных фенотипов, наследственная передача которых, а следовательно, и их генетическая обусловленность доказана семейными обследованиями. Большинство атипичных фенотипов ГПАТ являлись генотипически гетерозиготными по какому-либо атипичному аллелю и одному из основных аллелей. Гетерозиготные фенотипы ГПАТ-3-1 и ГПАТ-3-2 обнаружены у пяти лиц европейской расы (из 93 обследованных). Генетическим продуктом аллеля ГПАТ3 были изоферменты, обладающие максимальной скоростью миграции к аноду. У 3 из 220 лиц, принадлежащих к афро-американским негроидным популяциям, наблюдался атипичный фенотип ГПАТ-4-1. Он характеризовался двумя медленно мигрирующими к аноду изоферментами ГПАТ, характерными для фенотипа ГПАТ-2-d, и одним необычным промежуточным изоферментом. Необычный фенотип ГПАТ-5-4 был выявлен у семи членов одной эскимосской канадской семьи в трех поколениях. Электрофоретически изоферментный спектр этого необычного гетерозиготного фенотипа был похож на изоферментный спектр фенотипа ГП АТ-4-1, однако все три его изофермента располагались более компактно.
Еще два новых атипичных гетерозиготных фенотипа – ГПАТ-б-1 и ГПАТ-6-2 – обнаружили у четырех не связанных родством жителей Новой Гвинеи и Филиппинских островов. Генетическим продуктом атипичного аллеля ГПАТ6 являлись изоферменты, обладающие самой низкой электрофоретической миграцией к аноду. Авторы не смогли доказать наследственную передачу аллеля ГПАТ6. Однако в дальнейшем реальность существования аллеля ГПАТ6 в генном локусе системы ГПАТ и его наследственная передача были доказаны семейными обследованиями, проведенными другими исследовательскими группами.
В. Olaisen (1973) обнаружил два новых атипичных фенотипа ГПАТ – ГПАТ-7-1 и ГПАТ-7-2. Оба фенотипа наблюдались у членов одной норвежской семьи в нескольких поколениях, что доказывало реальное существованне и наследственную передачу аллеля ГПАТ1.
На рис. 19 представлены изоферментные спектры трех обычных фенотипов системы ГПАТ и восьми атипичных гетерозиготных фенотипов.
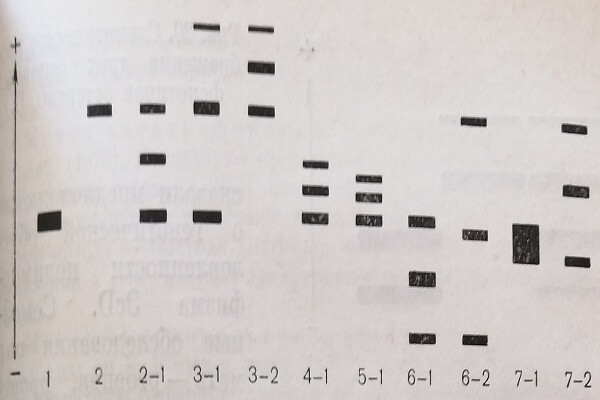
Рис. 19. Схематическое изображение трех основных (1, 2, 2-1) и восьми атипичных фенотипов глутамат-пируват-аминотрансферазы.
Из табл. 20 видно, что семейные обследования включали в себе 37 так называемых «критических» родительских пар, в которых оба родителя имели одинаковые или разные генотипически гомозиготные группы ГПАТ. Если формально-генетическая модель наследования соответствует истине, то в этих семьях должны родиться дети с единственно возможными гомо- или гетерозиготными фенотипами ГПАТ, и 134 ребенка имели единственно возможный для них фенотип ГПАТ.
W. Spielmann и соавт. (1973) наблюдали в одной немецкой семье противоположную гомозиготность по системе ГПАТ у матери и сына (возможность перепутывания ребенка в данном случае полностью исключалась). Две пары заподозрили наследственную передачу от матери к сыну «немого» неструктурального аллеля ГПАТ°, поскольку интенсивность изоферментов ГПАТ-2 у матери и ГПАТ-1 у сына была ниже, чем интенсивность изоферментов в контрольных образцах. Оказалось, что в эритроцитах крови матери и сына был значительный дефицит активности ГПАТ. Это доказывало наследственную передачу аллеля ГПАТ0 в гетерозиготной форме с аллелями ГПАТ1 или ГПАТ2, обусловливающего снижение ферментативной активности. Отец ребенка имел фенотип ГПАТ-1 с нормальной активностью, что свидетельствовало о генотипической гомозиготности ГПАТ1/ГПАТ1. Из этого следовало, что от отца сын получил аллель ГПАТ\, а от матери, генотипической гетерозиготной ГПАТ2/ГПАТ0, аллель ГПАТ0, т. е. сын также был генотипически гетерозиготным ГПАТ1/ГПАТ0. Исследование типов ГПАТ У ближайших родственников матери ребенка также подтвердило наследственную передачу «немого» аллеля ГПАТ0 в данной семье по материнской линии.
Этот пример очень поучителен для судебно-медицинских экспертов. Он заставляет относиться с большой осторожностью ко всем случаям исключения отцовства или материнства по противоположной гомозиготности той или иной генетически детерминированной системы. Во избежание ошибочного исключения в таких случаях необходимы расширенное исследование групп крови по «исключающей» системе ближайших родственников отца или матери ребенка, а также, если речь идет о ферментных группах крови, количественный анализ активности ферментов крови у всех проходящих по делу лиц.
A. Du Chesne и соавт. (1974) у одного жителя Лейпцига наблюдали полное отсутствие активности ГПАТ в эритроцитах крови, а также отсутствие изоферментов ГПАТ. Авторы полагают, что обнаруженный ими необычный фенотип ГПАТ-0 является генотипически гомозиготным по «немому» аллелю (ГПАТ0/ГПАТ0), поскольку у обоих родителей данного лица было выявлено резкое снижение ферментативной активности.
Для того чтобы количественно определять активность эритроцитарной ГПАТ, судебно-медицинский эксперт должен помнить о том, что генетические продукты двух основных структуральных аллелей ГПАТ1 и ГПАТ2 обусловливают различную каталитическую активность фермента в эритроцитах (аллель ГПАТ1 обусловливает более высокую активность). Вследствие этого при трех различных фенотипах этой системы (ГПАТ-1, ГПАТ-2-1- ГПАТ-2) наблюдается разная ферментативная активность. По данным S. Chen и соавт. (1972), она составляет: при ГПАТ-4 4Д7±<1,58, при ГПАТ-2-1 2,75±1,15 и при ГПАТ-2 1,67±0,68 ед/г.

![Распределение фенотипов ГПАТ [no Chen S. и соавт., 1972] Распределение фенотипов ГПАТ [no Chen S. и соавт., 1972]](/_pu/13/s94831757.jpg)



