Система Резус
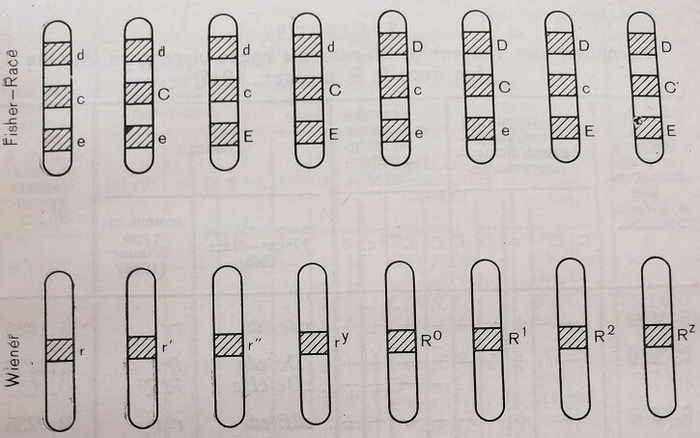
Принятая в настоящее время в Европе номенклатура генов, антигенов, генотипов и фенотипов системы резус Pisher Race с буквенным и пространственным изображением более наглядна и доступна для понимания, чб1| номенклатура Wiener, в которой главную роль играют ра3, личного рода символы, обозначающие гены и антигены этой системы. Так, по номенклатуре Fisher – Race генотип CDe/cDE легко воспроизводим в речевом и зрительном аспекте. Во-первых, он показывает, что эритроциты данного человека имеют пять антигенов или пять резус- факторов С, с, D, Е, е. Во-вторых, видно, что на одной хромосоме в генном локусе резус имеются три гена С, D и е, а на гомологичной хромосоме в подобном генном локусе – гены с, D ж Е. В-третьих, этот генотип легко читается. По номенклатуре Wiener этот же генотип обозначается как WR2. Практически его не всегда можно точно установить, поскольку, если по номенклатуре Wiener эритроциты характеризуются наличием факторов rh'+, hr\r Rh0+, hr"+, rh+j а по номенклатуре Fisher – Race C+, e+,. Z)+, E+, e+, то эти эритроциты имеют фенотип RhiRh2 (по Wiener) или CcDEe (по Fisher – Race). Поскольку «аллельный» ген к фактору D не обнаруживается и групповые факторы С, с и Е, е могут иметь различные аллельные комбинации в обоих генных локусах, то для этого фенотипа системы резус возможны шесть генотипических комбинаций (приведены в соответствии с частотой их встречаемости).
Номенклатура семи важнейших антигенов (резус-факторов) и двенадцати генов (генных комбинаций) системы резус (по Wiener и Fisher – Race) выглядит следующим образом.
Из комбинации двух любых генов (по Wiener) или любых двух генных комбинаций (по Fisher – Race) могут быть образованы 36 различных генотипов системы резус (если не принимать во внимание фактор Cw) и 78 генотипов с учетом фактора Cw.
При использовании Rh – Hr-номенклатуры Wiener для обозначения гено- и фенотипов системы резус (Rh) необходимо учитывать следующее: а) для генов, генотипов и фенотипов с наличием фактора Rh0(D) дается обозначение R, при отсутствии фактора Rh0 (D) – обозначение г; б) гены и генотипы печатаются курсивом (так же и по CDE-номенклатуре), а дополнительные обозначения – вверху как показатель степени (например, Rlr); в) фенотипы печатаются прямым шрифтом, а дополнительные обозначения (кроме штрихов) – внизу (например, Rir).
Сыворотки анти-Rh. Современный взгляд на природу неполных антител
Многочисленные антигены, или факторы, Rh-системы были открыты благодаря обнаружению соответствующих Rh-антител.
В настоящее время в экспертной практике применяются лишь анти-Rh сыворотки изоиммунного характера.
Причины образования Rh-антител весьма разнообразны: 1) спонтанно образованные антитела анти-Rh; 2) переливание Rh-несовместимой крови; 3) Rh-несовместимость при беременности; 4) искусственная иммунизация добровольных доноров. Антигенное воздействие разнообразных факторов Rh-системы чрезвычайно различно. Так, если получение изоиммунных антител анти-Rho (анти-D) относительно простое, то получение изоиммунных сывороток анти-е являетея весьма затруднительным.
Rh-антитела очень редко бывают полными (бивалентными, солевыми), т. е. проявляющими свое агглютинирующее свойство в физиологическом растворе, и гораздо чаще – неполными. Неполные (блокирующие) антитела анти-Rh имеют низкую молекулярную массу, не агглютинируют соответствующие эритроциты в солевой среде, а лишь блокируют их. Агглютинация блокированных эритроцитов наступает лишь после добавления к ним особых белковых субстанций – супплиментов (бычий альбумин, бычья антисыворотка, раствор желатины, сыворотка крови человека одноименной по системе группы АВО или АВ и др.). Другая возможность агглютинации эритроцитов неполными антителами анти-Rh заключается в предварительной обработке эритроцитов ферментами или их растворами (например, фильтратами
холерного вибриона, трипсином, нанаином и бромел» ном – особыми ферментами ананаса, проназой – протеазой из Streptornyces griseus, протеазой из Aspergill' ochraceus). По данным Е. Klenk, G. Uhlenbruck (1957) многие ферменты, способные расщеплять эритроцитарную оболочку и тем самым снижать величину поверхностного заряда, освобождают соответствующие антигенные рецепторы эритроцитов, с которыми могут реагировать неполные антитела даже в солевом растворе.
Еще одной разновидностью неполных антител анти-Rh являются так называемые криптагглютиноиды – неполные, блокирующие антитела, которые не способны агглютинировать эритроциты с соответствующей специфичностью ни в изотоническом растворе NaCl, ни в растворе альбумина (макромолекулярной среде). Их действие можно выявить с помощью высокочувствительной серологической реакции: непрямой антиглобулиновой пробы, или теста, разработанной R. R. A. Coombs, А. Е. Mourant, R. R. Race (1946) и известной под названием непрямой пробы Кумбса.
В результате обработки эритроцитов неполными антителами анти-Rh, являющимися криптагглютиноидами, эти эритроциты «обволакиваются» или сенсибилизируются к антиглобулиновой сыворотке человека. Эта сыворотка и агглютинирует сенсибилизированные эритроциты, поскольку она содержит антитела к глобулинам. По мнению некоторых исследователей, в данном случае происходит не чистая агглютинация эритроцитов, а скорее их преципитация.
Для получения гетероиммунной антиглобулиновой сыворотки предложено несколько способов: иммунизация кроликов и коз сывороткой крови человека, иммунизация коз очищенным человеческим иммуноглобулином, иммунизация кроликов суспензией гомогенизированных волос человека. Непрямая проба Кумбса является универсальной реакцией для обнаружения при помощи неполных антител не только антигенов Rh-системы, но и многих антигенов других изосерологических систем крови. Существуют многочисленные модификации этого теста.
Однако при применении этой высокочувствительной серологической реакции как в классическом варианте, так и в различных модификациях исследователь всегда должен помнить о возможности ошибочной интерпретации полученных результатов, связанной с Холодовыми антителами, с так называемым феноменом зоны, влиянием различных химических веществ, например солей металлов, и различных лекарственных препаратов [Косяков П. Н., 1965], и исключить такую возможность.
Генетические концепции наследования Rh-системы. Как уже отмечалось, согласно теории Wiener, различные отдельные факторы, или Rh-антигены, открываемые в эритроцитах, являются продуктом одного какого-то определенного гена. To-есть каждый конкретный ген обусловливает свою, присущую только ему резусную мозаику факторов в эритроцитах. Краеугольным же камнем теории Fisher – Race является положение, согласно которому каждому фактору, или Rh-антигену, открываемому в эритроцитах, соответствует свой конкретный ген. Поскольку проведенные исследования свидетельствуют о том, что все отдельные факторы Rh-системы наследуются неразделимо, все же, по-видимому, следует признать правильность предположений A. S. Wiener о том, что вся резусная мозаичность действительно обусловлена действием отдельных генов.
Огромное число всевозможных мозаичных резусных комбинаций представлено в табл. 6. Такое разнообразие A. S. Wiener объясняет наличием на соответствующих хромосомах в едином генном Rh-локусе множественных аллелей, в то время как R. A. Fisher и R. R. Race допускают наличие по крайней мере трех таких локусов (обозначенных ими локусами С, D и Е) на одной хромосоме (рис. 3).
Рис. 3. Схематическое изображение единого генного локуса системы Rh (по A. Wiener) или трех тесно сцепленных локусов этой системы (по R. Fisher, R. Race). Латинскими буквами обозначены соответствующие аллели (по R. Fisher; К. Race или единый ген (по A. Wiener)
Если предположить, что отдельные Rh-факторы действительно имеют на хромосоме отдельные генные локусы, то рано или поздно должен произойти так называемый перекрест хромосом, или кроссинговер, который должен наблюдаться реально. Это положение является одним из основных в теории R. A. Fisher и R. R. Race, которые полагают, что на хромосоме имеются три исключительно тесно сцепленных генных локуса Rh-системы, а в каждом из них есть пара аллельных генов, ответственных за появление того или иного Rh-фактора. Теория английских генетиков весьма оригинальна. Они считают, что, если изучить фенотипы Rh-системы в конкретной популяции, то можно найти распространенные, редкие и чрезвычайно редкие фенотипы. Из этого делается вывод о том, что редкие фенотипы Rh-системы обусловлены редкими генными комбинациями на хромосомах, возникающими в результате кроссинговера между двумя гомологичными хромосомами, а исключительно редкие фенотипы – за счет хромосом, которые сами уже явились продуктом перекреста (т. е. хромосомы 1-го, 2-го и 3-го порядков).
В теории Fisher – Race большое внимание уделяется порядку, или последовательности, расположения генных локусов С, D и Е. Он определяется наиболее часто встречающимися фенотипическими резусными комбинациями, из которых наиболее распространенными являются комбинации DCe, DcE и dee. Далее, если допустить возможность кроссинговера между DCe и dee, а также между DcE и dee, то при этом фенотипически всегда будет наблюдаться Dee. Такой же фенотипический продукт Dee возникнет и при перекресте хромосом наиболее распространенных резусных комбинаций DCe и DcE (рис. 4).
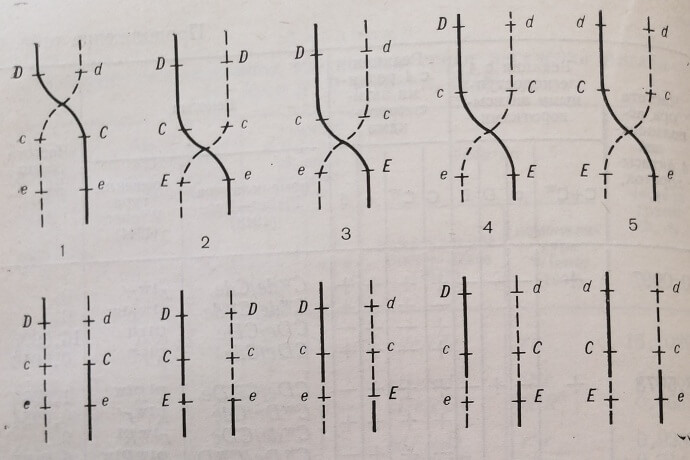
Рис. 4. Случаи перекреста хромосом, несущих генные локусы системы Rh, согласно теории R. Fisher, R. Race.
A. S. Wiener неоднократно выступал против существования кроссинговера. Главным аргументом A. S. Wiener являлось то, что до сих пор никто с достоверностью не смог обнаружить перекрест хромосом, на котором построена вся теория R. A. Fisher и R. R. Race. Его английские оппоненты на это, правда, отвечали, что из-за очень тесного сцепления генных локусов Rh-системы на хромосомах случаи генного кроссинговера чрезвычайно редки, поэтому семейный материал, который мог бы демонстрировать эти случаи, чрезвычайно скудный.
Открытие многочисленных новых факторов Rh-системы и их разновидностей подтверждает правильность теории Wiener. Необходимо, правда, отметить, что, несмотря на то что теория «одного» гена Wiener является в настоящее время господствующей, номенклатура Fisher – Race благодаря своей простоте завоевала всеобщее признание во всем мире, что не отрицал и сам A. Wiener.
Особые генетические формы Rh-системы
Прежде чем более подробно остановиться на всех аспектах использования Rh-системы в судебно-медицинских экспертизах спорного происхождения детей, необходимо коротко упо- мянуть о так называемых особых генетических формах этой сложной системы, тем более что некоторые из них, по-видимому, могут иметь непосредственное отношение к такого рода экспертизам.
Варианты антигена D (Rho)
F. Stratton (1946) описал слабый фактор Rh0 (D), названный им фактором Du. В дальнейших исследованиях была определена его генетическая природа и показана наследуемость. Антиген Du не выявляется агглютинирующими сыворотками анти-Rho, но может быть обнаружен неполными антителами анти- Rho в непрямой пробе Кумбса.
Кроме фактора Rho со слабой агглютинабельной способностью, были описаны и его разновидности с исключительно высокой агглютинабельностью, обозначенные фактором –D–. Семейные обследования нового фактора –D– также показали его генетическую обусловленность и наследственную передачу.
Эритроциты крови людей, имеющих тип –D–, агглютинировались неполными антителами анти-Rho даже в солевой среде изотонического раствора NaCl. В дальнейшем были обнаружены гомозиготы –D–D– в эритроцитах которых факторы С и с, а также Е и е отсутствовали. По теории Wiener, этот антиген, обозначенный Rho, обязан своим появлением особому аллелю.
Антиген (агглютиноген) Rho имеет видоизмененную химическую структуру, которая резко усиливает его реакцию с антителами анти-Rho и одновременно угнетает воздействие всех других антирезусных сывороток [Wiener А. Wexler I., 1960]. Это тип резуса был также обозначен как супер-Rho. Как указывают О. Prokop и W. Gohler (1976), тип супер-Rho представляет большую опасность для судебных медиков при проведении экспертиз в делах о спорном происхождении детей. Частота встречаемости этого антигена еще недостаточно изучена, поэтому сейчас трудно сказать, насколько он опасен для экспертизы. Су- дебные медики, если не будут учитывать силу выраженности антигена –D–, могут ошибочно диагностировать, например, гетерозиготу –D–/CDe как гомозиготу CDe/CDe, поскольку в данном случае будет отсутствовать агглютинация эритроцитов с сыворотками анти-с и анти-Е, что свидетельствует как бы о гомозиготности Сие. Другой случай гетерозиготности, например –D–/cDE, также может быть ошибочно диагностирован как гомозиготный генотип cDE/cDE со всеми вытекающими отсюда последствиями. Эта же проблема должна беспокоить судебных медиков и в случаях делеций (повреждение и «стирание» части генного локуса Rh-системы).
Варианты С с и Ee.R. R. Race и соавторы описали особые резусные типы эритроцитов, названные ими c и Си. Специфичных антител к этим факторам не найдено, поэтому комплекс cvDE, который был открыт ранее, можно ошибочно диагностировать как комплекс CDE в редкой генной мозаике CDE/cde. Сыворотки, которые не открывали фактор cv, были специфичными комплексными антителами анти-Се.
Фактор Cu [по A. S. Wiener – rh(1)] представляет собой очень слабую форму фактора С (rh') с частотой встречаемости около 1% .
Еще один довольно редкий Rh-фактор, названный Сх, обнаружили F. Stratton и P. Н. Renton (1954). Он может выявляться специфическими антителами анти-Сх, причем частота встречаемости этого фактора около 0,1%.
В последние годы обнаружены и расовые различия антигенов Rh-системы. Например, эритроциты типа Ccd.ee у белых и негров реагируют различно, причем некоторые сыворотки анти-С не открывают этот резусный тип у негров.
Известны также довольно редкие варианты Rh-фактора E(rh") Ew, Eu, ЕЧ М. Shapiro (1960) нашел у народов Банту особый антиген hr3, который привлек внимание тем, что факт его генетической передачи опровергает «CDE-теорию наследования» Fisher–Race. Антитела анти-hs8 реагируют приблизительно так же, как антитела анти-hr, но все же не открывают некоторые образцы эритроцитов, реагирующих с обычной сывороткой aHTH-hr" (е). Признак hrs, по мнению Shapiro, может привести к ошибочному исключению отцовства. Среди европеоидов фактор hrs, по-видимому, не играет большого значения, поскольку его встречаемость крайне редка.
Повреждение, «стирание», или деление генного локуса Rh. К. Henningsen (1958) обнаружил одну семью с необычным резусным комплексом, при котором в эритроцитах не выявлялись антигены CDE и cde. Такой резусный комплекс был обозначен фенотипом или Rho. Если же в эритроцитах имелся только антиген d, то такой фенотип обозначали –d–, или d. Для судебных медиков чрезвычайную опасность представляет тот факт, что лица, имеющие фенотип Rho, могут передать по наследству те или иные гены Rh-системы. Без учета этой особой формы часто нельзя объяснить возможность рождения ребенка от конкретной матери. Такие случаи несовместимых пар мать – ребенок, когда замена ребенка полностью исключалась, описали О. Prokop и W. Schneider (1960).
Для судебно-медицинской экспертизы спорного происхождения детей делеции генного локуса Rh, особенно в гетерозиготной форме, приобретают все большее значение. При этом во всех сомнительных случаях необходимо исследовать группы Rh-крови родителей и ближайших родственников, проходящих по делу лиц, а также путем выявления эффекта дозы устанавливать истинный генотип Rh-системы.
J. Jungwirth (1967) описал случай так называемой противоположной гомозиготности антигенов Rh-системы у матери и ребенка, основанной на частичном (гетерозиготном) повреждении Rh-генного локуса.
To есть первая девочка по всем законам наследования антигенов Rh-системы не могла родиться в этой семье, поскольку у нее и ее матери наблюдается так называемая противоположная гомозиготность резусных антигенов. К. Henninigsen (1958) обратил при этом внимание на следующий факт, который позволил ему генетически правильно интерпретировать указанную выше семью по генотипам Rh и показать возможность рождения этой девочки именно в данной семье. Дело в том, что сыворотки анти-с и анти-е реагировали с эритроцитами крови отца и четвертого ребенка (мальчика) значительно сильнее, чем с эритроцитами крови матери и второй и третьей дочерей, а эритроциты крови первой дочери так же слабо агглютинировались сывороткой анти-с, как эритроциты крови ее матери и двух сестер, но давали с сыворотками анти-D и анти-Е агглютинацию, тождественную агглютинации эритроцитов крови отца и мальчика (брата) при воздействии этих же антисывороток. Такой характер реакции эритроцитов крови членов этой семьи с соответствующими резусными антисыворотками давал основание предположить, что у матери и ее трех дочерей произошло частичное или гетерозиготное поражение (делеция) Rh-локуса. Согласно этой гипотезе, члены данной семьи имели следующие резусные генотипы (I – по номенклатуре Fisher – Race, II – по номенклатуре Wiener).
Таким образом, благодаря выявлению феномена частичного выпадения генного локуса Rh-системы в описанной семье удалось объяснить возможность рождения первого ребенка от данной матери и устранить, казалось бы, очевидную несовместимую резусную гомозиготность у матери и дочери. Еще одним доказательством в пользу частичного выпадения Rh-локуса в данной семье явился выявленный у отца матери этих четырех детей крайне редкий гомозиготный резусный фенотип Rh0, который и передал по наследству своей дочери частичное стирание, или выпадение, Rh-локуса.
Необходимо отметить, что до последнего времени описано всего 14 случаев нахождения фенотипа Rho, причем у большинства лиц, имеющих этот крайне редкий фенотип, кроме отсутствия в эритроцитах антигенов Rh-системы и LW, были обнаружены и другие генетические дефекты: отсутствие реакции с сывороткой анти-s и анти-U, легкая степень гемолитической анемии.
Так называемый «позиционный» эффект. Одним из наиболее изученным является «позиционный» эффект, который отражает силу выраженности резусных рецепторов.
Различия в силе выраженности антигенных рецепторов можно свести к следующему. 1) Антигенный рецептор выражен значительно сильнее при его гомозиготности (так называемый эффект «двойной дозы»), 2) При наличии в эритроцитах какого-нибудь определенного антигена системы крови антигенная выраженность рецептора этой системы крови может либо усиливаться, либо тормозиться («Epistase»). Иногда сила выраженности генных рецепторов может временно измениться под влиянием каких-либо внешних воздействующих факторов. Так называемые регуляторные супрессорные гены могут либо полностью, либо частично угнетать антигенный рецепторы эритроцитов.
«Позиционный» эффект в Rh-системе отчетливо демон, стрирует зависимость антигенной выраженности разлив ных факторов этой системы от их взаимного расположен ния на одной и той же или на гомологичных хромосомах (соответственно цис- и транс-позиции). Простым примером, иллюстрирующим принцип этого эффекта, может служить система АВО, в которой антигенный рецептор A1 выражен в генотипе А\В значительно слабее, чем в генотипах А\А\ и А\0. Это обусловлено тем, что антигены A1 и В имеют довольно близкую химическую структуру, гораздо более близкую, чем структура антигенов A1 и 0. Вследствие этого при генетической реализации соответствующего генопродукта часть его (или часть основной субстанции) делится между A1 и В.
По мнению S. D. Lawler и соавт. (1950), это положение приемлемо и к Rh-системе, поскольку авторы нашли антитела анти-Е, которые явно сильнее реагировали с антигеном Е при генотипе cDE/cde, чем при генотипе CDe/cDE. Теория «общей основной субстанции» подтвердилась в дальнейшем наблюдением довольно редкого генотипа –D–/–D–, в котором отсутствовали конкурирующие антигены С, с, Е и е. При этом D-гомозиготном типе сила выраженности антигена D значительно превышала его антигенную выраженность во всех других D-ro- мозиготных типах, таких, например, как cDe/cDe, CDe/CDe, cDEjcDE, CDe/cDE.
При использовании специальных резусных антисывороток можно обнаружить подобный конкурирующий эффект и для антигенов С и Е, химическая структура которых довольно близка. Так, по данным R. R. Race и соавт. (1954), при генотипе CdE/cde антигенная выраженность С низкая, а Е –высокая; Cde/cdE антигенная выраженность С высокая, а Е – низкая; CDE/cDe антигенная выраженность С низкая, а Е – высокая; CDe/cDE антигенная выраженность С высокая, а Е низкая. Эти данныесвидетельствуют о том, что когда С и Е располагаются на» одной хромосоме (цис-позиция), то угнетается антигенная активность С и повышается антигенная активность Е, и, наоборот, при расположении антигенов С и Е на противоположных гомологичных хромосомах (транс-позиция) тормозится антигенная активность Е и повышается антигенная активность С.
«Позиционный» эффект Rh-системы представляет определенный интерес для судебных медиков, поскольку иногда он позволяет устанавливать резусный генотип конкретного лица, выяснение которого необходимо для использования этой полиморфной генетической системы в экспертизах спорного происхождения детей. В этом плане болыпую роль будут играть так называемые «сцепленные» антитела против некоторых антигенов Rh-системы.
Показано, что многие антитела анти-G в действительности являются антителами, обладающими двойной специфичностью, и представляют собой сыворотки анти-Се- (анти-rhi), а некоторые сыворотки анти-Е являются антителами анти-GE. Позднее были найдены и другие «сцепленные» антитела – анти-се (f) и анти-сЕ (анти-hri)„ С помощью этих сывороток можно выявлять комплексные антигены Rh-системы (табл. 7).
Например, используя пять обычных моновалентных ав зусных сывороток (анти-С, анти-с, анти-D, анти-Е, анти-е) лучая со всеми ими агглютинацию испытуемых эритроцитов устанавливаем резусный фенотип CcDEe, которому могут соотв^1 ствовать шесть возможных генотипов: CDe/cDE, CDe/cdE, CDE/cde, CDE/cDe и cDe/CdE. Используя же только одну «саленную» антисыворотку (анти-СЕ или анти-се), можно сразу % уменьшить число возможных генотипов в каждом конкретном образце CcDEe до трех, поскольку агглютинация эритроцитов любой из этих двух сывороток исключает генотипические комбинации CDe/cDE, CDe/cdE и Cde/cDE, а отсутствие агглютинации эритроцитов при использовании любой из этих антисывороток исключает генотипы CDE/cde, CDE/cDe и cDe/CdE.
Новая номенклатура Rh-системы
В 1965 г. стало известно, что A. S. Wiener изменил свое негативное отношение к введению новой номенклатуры Rh-системы и признал, что его старая номенклатура символов с открытием многочисленных новых факторов этой системы стала громоздкой, трудночитаемой и даже труднопонимаемой для специалистов. По предложению A. Lauer (1964) в Rh-системе выделяют шесть генов: Се, сЕ, се, СЕ, С^е и С^Е. При этом Lauer сознательно не включал сюда гены, ответственные за мозаику антигена D, поскольку он признавал его обособленность. Естественно, что эта номенклатура с учетом многочисленных особых типов Rh-системы также не будет до конца совершенной, хотя для европеоидного населения со сравнительно меньшей частотой встречаемости особых форм системы она вполне допустима [последняя модель номенклатуры приведена в работе I. Hirschfeld (1973)].
Использование Rh-системы в судебно-медицинской экспертизе спорного происхождения детей
Поскольку Rh-система является чрезвычайно полиморфной генетической системой с большим количеством групповых антигенов, ее можно эффективно использовать в судебно-медицинских экспертизах, связанных со спорным происхождением ребенка. В. Rex-Kiss и Е. Horvath (1967) сообщают, что в 1683 судебных процессах по спорному отцовству имелись исключения в 171 случае, среди которых в 156 случаях исключения были получены на основании исследования Rh-системы. По данным Р. С. Сахарова (1968), из 51 экспертизы спорного отцовства по Rh-системе исключения имелись в 9 случаях, причем в большинстве из них (7 из 9) исключение производилось только по данной системе. По результатам наблюдений R. Ghakraborty (1974), вероятность исключения отцовства в трех расовых группах по Rh-системе с учетом семи важнейших генов R°, R\ R2, Rz или генных комплексов cDeм CDe, cDE, CDE, cde, Cde, cdE довольно высока и составляет в среднем для европеоидных, негроидных и монголоидных популяций соответственно 27,46; 18,59 и 20,5%.
При применении в судебно-медицинской экспертизе Rh-системы неоднократно возникали различные затруднения, которые впоследствии могли быть объяснены некоторыми вариантами тех или других антигенов. В частности, довольно важное значение имеет антиген Cw, который, по данным Л. К. Аржелас и Е. С. Лутчевой (1964), среди московского населения встречается в 5,9% случаев.
P. Speiser (1955) приводит случай, когда мать имела генотип СС, а ее ребенок – сс, т. е. образец крови матери давал положительную реакцию с сывороткой анти-С, а с сывороткой анти-с – отрицательную. Образец крови ребенка, наоборот, давал положительную реакцию с сывороткой анти-с и не реагировал с сывороткой анти-G. Таким образом, можно было считать, что данный ребенок не может происходить от этой женщины, так как он обязательно должен был бы наследовать от нее антиген С. Такое исключение имело бы место, если считать, что в генном локусе С на соответствующей «резусной» хромосоме имеются только два аллеломорфных аллеля, а именно С и с, которые ответственны за образование либо гомозиготных форм СС или сс, либо гетерозиготной формы Сс. Однако если учесть, что может иметься и третий аллеломорфный аллель Cw, то в этом случае исключение данной женщины как матери указанного ребенка не безусловно. Действительно, при исследовании, проведенном с применением сыворотки aHTH-Cw, выяснилось, что у матери и ребенка в крови присутствует антиген Cw, т. е. формула Rh-системы у них следующая: мать CCwDee, ребенок cCwDee. Из этих данных видно, что ребенок мог наследовать от матери антиген Cw, который не открывается обычными сыворотками анти-С и анти-с.
Неучитывание антигена Cw таит для судебно-медицинского эксперта большую опасность, поскольку в таком случае возможно ошибочное исключение отцовства (табл. 8). В табл. 8 не указаны случаи, когда могут быть исключения при наличии гомозиготной формы Cw/Cw, встречающейся чрезвычайно редко.Приведенные данные свидетельствуют о том, что при экспертизе спорного происхождения детей судебно-медицинский эксперт не имеет достаточных оснований для исключения отцовства (материнства) по Rh-антигенам без исследования фактора Cw. Данный фактор может быть использован и самостоятельно для исключения отцовства. Так, В. Rex-Kiss и Е. Horvath (1966) указывают, что в 50 случаях исследования фактора Cw имелось 5 исключений отцовства по этому антигену.
В литературе описаны случаи, когда, казалось бы, имело место невозможное наследование антигенов Rh-системы, которое впоследствии было объяснено существованием особой формы антигена D. Появление этого антигена обусловлено частичным выпадением Rh-локуса на соответствующей хромосоме. О. Prokop и W. Schneider (1960) при исследовании крови матери и ребенка пятью антире- зусными сыворотками на антигены С, с, D, Е и е получили следующие результаты: у матери реакция – G-f-c–D+ Е–е+, а у ее ребенка совершенно противоположная реакция – С–c + D + E + e–.Такие результаты должны были бы, очевидно, свидетельствовать о том, что мать имеет генотип CDe/CDe или Cde/CDe, а ребенок – cDEIcDE или cDEjcdE. В данном случае можно предположить, что мать генотипически гомозиготна по СС и ее, а ее ребенок – по сс и ЕЕ. Таким образом, по правилам наследования антигенов Rh-системы можно считать, что ребенок не происходит от данной женщины, хотя возможность ошибочной замены ребенка в родильном доме в данном случае полностью исключалась.
Однако авторы обратили внимание на особую в данном случае реакцию антирезусных сывороток с эритроцитами матери и ребенка: у них была необычно сильная агглютинация эритроцитов сывороткой анти-D. Кроме того, эритроциты матери слабее обычного агглютинировались сыворотками анти-С и анти-е, а эритроциты ребенка также слабее обычного агглютинировались сыворотками анти-с и анти-Е. Таким образом, характер реакции эритроцитов крови матери с антисыворотками не соответствовал обычной гомозиготности СС и ее, а ее ребенка – обычной гомозиготности сс и ЕЕ. Авторы высказали предположение (которое затем было подтверждено при расширенном обследовании родителей и родственников матери этого ребенка), что в данном случае имеет место довольно редкий резусный тип –D–.
Согласно этому предположению, резусный генотип матери был CDe/–D–, а ее ребенка – cDEl–D–. Таким образом, стало понятным, что в данном случае мать передала по наследству своему ребенку антигенный комплекс –D–.
Имеются данные, указывающие на возможность наследования от одного или даже от обоих родителей хромосомы, вообще не имеющей генов Rh-системы. Они значительно усложняют использование этой системы в судебно-медицинских экспертизах спорного происхождения детей.
При особом генотипе Rh-системы Rho, или /, в эритроцитах нет антигенов CDE и cde, но такой субъект может передавать по наследству другие гены Rh-системы. Этот факт также представляет определенную опасность для экспертизы по Rh-системе.
Во всех сомнительных или не совсем обычных случаях, когда то или иное проходящее по делу лицо либо вообще не имеет антигенов Rh-системы или же его эритроциты дают нетипичную реакцию с соответствующими антирезусными сыворотками, необходимо проводить расширенное исследование родителей и ближайших родственников. Оно способствует выяснению вопроса о вероятности происхождения ребенка от того или иного лица или от той или иной родительской пары.
Определенную опасность для экспертов представляет и особый антиген es (hrs). Большинство обычных резусных сывороток анти-е его не открывают, и он реагирует со специальными антителами. Если, например, генотип какого-либо ЛИц cDE/cDe или cDE/cde, то его эритроциты с пятью обычными антирезусными сыворотками анти-С, анти-с, анти-D -анти-Е и анти-е дадут реакцию С–c+D+E+e–, по которой эксперт ошибочно устанавливает генотип этого человека как cDE/cDE или cDE/cdE со всеми вытекающими отсюда последствиями. Использование специальной сыворотки анти-е5 (анти-hrs) в таких случаях способствует установлению истинного резусного генотипа конкретного лица. К счастью, встречаемость антигена es (hrs) среди европеоидной популяции чрезвычайно редка, что сводит до минимума возможность ошибочного экспертного заключения, однако при исследовании негроидных популяций с этим обстоятельством приходится считаться.
Примеры возможного предотвращения ошибочного исключения отцовства, когда наряду с сывороткой анти-е используется и сыворотка анти-е® (анти-hr8), показаны в табл. 9.
Необходимо отметить, что, казалось бы, сугубо теоретические концепции наследования антигенов Rh-системы имеют непосредственное отношение к практическому применению этой сложной полиморфной системы в экспертизах спорного происхождения детей.
На основании огромного числа наблюдений наследственной передачи групповых антигенов Rh-системы в настоящее время почти во всем мире признается правильность генетической концепции A. S. Wiener, согласно которой эта система наследуется при передаче одного гена, обусловливающего развитие определенного антигенного комплекса, характеризующегося несколькими серологическими факторами. Поэтому часто можно решить вопрос о происхождении ребенка, учитывая тот комплекс резусных антигенов, который он мог получить от отца или матери. Более того, исследуя кровь родителей отца и матери ребенка, можно установить, какой антигенный комплекс они передают по наследству, и, исходя из этого, решать, мог ли ребенок имеющийся у него комплекс генов Rh получить от того или другого родителя.
Примеры такого рода исследований приводят О. Prokop и W. Gohler (1976). По их данным, подобное расширенное исследование крови родителей предполагаемого отца и матери ребенка, а также их братьев и сестер и братьев и сестер спорного ребенка примерно в 50% случаев дало возможность получить дополнительные сведения относительно происхождения ребенка. По нашему мнению, это является обязательным условием при проведении судебно-медицинских экспертиз крови в делах о спорном происхождении ребенка и применительно не только к Rh-системе, но и к большинству изосерологических, сывороточных и ферментных систем крови, используемых в такого рода исследованиях.
Указанные выше особенности наследования групповых антигенов Rh-системы, открытие большого числа новых антигенов, относящихся к этой системе, во-первых, осложняют ее применение в судебно-медицинской экспертизе спорного происхождения детей и, во-вторых, требуют от эксперта при оценке полученных данных четкого представления и знания многочисленных особенностей этой исключительно сложной изосерологической системы.В настоящее время, по-видимому, назрела необходимо принципиального решения вопроса о квалификации судебно-медицинских экспертов, которым может быть обозначено установление спорного происхождения детей по групповым наследственным серологическим факторам. Онц должны иметь не только специальную подготовку по лабораторной технике выявления серологических факторов, но и обширные знания в области наследования групповых антигенов различных изосерологических, сывороточных и ферментных систем крови человека. Поясним свою мысль конкретным примером исследования антигенов Rh-системы цри проведении судебно-медицинской экспертизы спорного отцовства.
Кровь ребенка, его матери и трех мужчин, фигурирующих в качестве предполагаемого отца ребенка, при исследовании пятью антирезусными сыворотками анти-С, анти-с, анти-D, анти-Е и анти-е дает серологическую реакцию:
ребенок C+c+D–Е + е+
мать C-l-c-bD-bE–е-Ь
ответчик I C+c+D+E+e-f ответчик II С–c+D+E+e+ ответчик III С–c+D+E+e–
Рассуждения эксперта, не учитывающего комплексность Rh-антигенов и частоту их встречаемости, а рассматривающего только отдельные факторы этой системы, будут приблизительно следующими. У ребенка в резусной формуле имеется резусный рецептор Е, отсутствующий у «его матери. Следовательно, он мог получить его только от отца. Поскольку все трое мужчин, фигурирующих в качестве предполагаемого отца ребенка, содержат в своей крови фактор Е, то в данном случае исключение всех трех ответчиков в качестве отца по данной системе невозможно. В таких рассуждениях, вроде бы совершенно логичных, эксперт не учел редкой резусной формулы ребенка, а оценивал лишь отдельные факторы Rh-системы, которые сами по себе не имеют первостепенного значения для выяснения возможности рождения ребенка от конкретной родительской пары. Серологическая реакция эритроцитов крови ребенка с антирезусными сыворотками свидетельствует о том, что он имеет один из двух возможных резусных генотипов Cde/cdE (r'r ) или CdE/cde (ryr) с частотой встречаемости соответственно 0,023 и 0%.
Резусная «формула матери ребенка показывает, что мать имеет один из двух возможных генотипов CDe/cde (R'r) или cDe/Cde (R°r) с частотой встречаемости соответственно 1,675 и 0,05%.' Как далее рассуждает эксперт? Он отмечает, что его предположения вполне допустимы, поскольку, если у матери генотип CDe/cde (R'r), то у ее ребенка генотип CdE/cde (ryr), причем она передала ребенку генный комплекс cde или ген г, а генный комплекс CdE (ген гу) ребенок получил от отца. Если же у матери генотип cDejCde (R°rf), то у ее ребенка генотип Cde/cdE (r'r"),и, в таком случае он получил генный комплекс Cde или тен г' от матери, а генный комплекс cdE или ген г" – от отца.
Следовательно, на данном этапе исследования эксперту уже известно, что отцом ребенка является мужчина, имеющий в своем резусном генотипе генные комплексы -CdE или cdE (гены гу или г"). Очевидно, что для дальнейшего уточнения резусного генотипа отца эксперту необходимо решить, какой именно из двух возможных ре- зусных генотипов имеет мать и ее ребенок. Как решает этот вопрос высококвалифицированный эксперт? Во-пер- ных, он знает, что один из двух возможных резусных генотипов ребенка (CdE/cde или гуг) почти гипотетичен, поскольку он реален только теоретически, но до настоящего времени ни у кого еще не обнаружен. Второй возможный резусный генотип ребенка тоже редок (Cde/cdE или r'r"), но он встречается во много раз чаще, чем чисто теоретический генотип CdE/cde или гуг.
Уже из одного этого вытекает наибольшая вероятность того, что у ребенка имеется генотип Cde/cdE (r'r"), а у его матери – генотип cDe/Cde (R°r'). При этом генный комплекс Cde (ген г') ребенок унаследовал от матери, а генный комплекс cdE (ген г") – от своего отца. Поскольку это все же только вероятное предположение (хотя весьма аргументированное), то оно, естественно, не может лечь в основу судебно-медицинского экспертного заключения, которое на современном уровне развития серологии и генетики должно быть более конкретным и доказательным.
Какова же дальнейшая тактика квалифицированного эксперта в этом случае? Он знает о существовании так называемого «позиционного» эффекта в Rh-системе (см. выше), при котором наблюдается отчетливое варьирование силы выраженности антигенов С и Е в зависимости от того, в какой позиции, цис- или транс-, располагаются на хромосомах гены С и Е. При наличии генов С и Е на одной и той же хромосоме в цис-позиции резко повышается сила выраженности антигена Е сравнению с антигеном С, и, наоборот, при расположении генов С и Е на противоположных гомологичных хромосомах в эритроцитах увеличивается сила выраженности антигена С и снижается выраженность антигена Е.
Некоторые антирезусные сыворотки анти-С хорошо улавливают эти различия и с их помощью эксперт может устанавливать резусный генотип конкретного лица. Так, в рассматриваемом выше примере резусный генотип ребенка может быть либо Cde/cdE (r'r"), либо CdE/cde (ryr). Используя сыворотки анти-С и анти-Е, улавливающие «позиционный» эффект, эксперт отмечает, что эритроциты крови ребенка гораздо сильнее агглютинируются сывороткой анти-С, чем сывороткой анти-Е. Из этого он делает вывод, что ребенок имеет генотип CdefcdE (rV'),. его мать – генотип cDc/Cde (R°r') и при этом генный комплекс Cde или ген г' ребенок унаследовал от матери,, а генный комплекс cdE или ген г" от своего отца.
Если у эксперта в распоряжении нет сывороток анти-С и анти-Е, улавливающих «позиционный» эффект, он найдет другую возможность установления резусного генотипа ребенка, его матери, а следовательно, и того генного комплекса или гена, который ребенок получил от отца. В этом ему помогут так называемые «сцепленные» антитела (см. выше) анти-се, анти-СЕ, анти-сЕ или анти-Се, открывающие в эритроцитах соответствующие антигены только тогда, когда гены, ответственные за их появление, располагаются на одной и той же хромосоме, несущей резусную информацию. Используя любую из четырех указанных антисывороток в реакции с эритроцитами крови ребенка, эксперт легко устанавливает ту же самую генотипическую резусную характеристику ребенка и его матери [соответственно Cde/cdE (r'r") и cDe/Cde] и вновь убеждается в том, что от отца ребенок наследует только генный комплекс cdE или ген г".
Действительно, положительная реакция эритроцитов крови ребенка с сывороткой анти-Се или анти-сЕ или же их отрицательная реакция с сыворотками анти-СЕ или анти-се сразу же устанавливает точный резусный генотип ребенка Cde/cdE (r'r") и исключает второй возможный генотип CdE/cde (ryr).
Имеется еще один путь установления точного генотипа матери ребенка – исследование Rh-факторов у ее близких родственников, главным образом родителей, братьев и сестер. Так, в описанном примере эритроциты крови ее отца давали с антирезусными сыворотками реакцию С–c-j-D-f-E–e-f-, что свидетельствовало о том, что резусный генотип деда ребенка мог быть либо cDe/cde (R°r), либо cDe/cDe (R°R°). Эритроциты крови бабушки ребенка давали с антирезусными сыворотками реакцию С+с+ -j-D–Е–е+. Это в свою очередь свидетельствует о том, что мать может иметь только генотип Cde/cde (/г").
Исследование крови дяди ребенка (брата его матери) показало, что он имеет генотип cde/cde (гг). Это свидетельствовало о том, что его отец (дед ребенка) мог иметь только генотип cDe/cde, а не cDe/cDe (R°R°). Таким образом, расширенное исследование родословной этой семьи позволяет эксперту (без применения специальных антисывороток) точно установить резусные генотипы всех ее членов и прийти к тому же доказательному выводу: мать ребенка имеет генотип cDe/Cde (R°r'), причем cDe (R°) – отцовский, a Cde (г') – материнский, поскольку генотипы ее отца и матери были соответственно cDe/cde (R°r) и Cde/cde, а ее ребенок имел генотип Cde/cdE (x'v"), в котором Cde (г') от матери, a cdE (г") от отца.
Теперь эксперту совершенно ясно, что при исследовании резусной мозаики трех мужчин, каждый из которых фигурирует в качестве предполагаемого отца ребенка, необходимо выяснить, имеет или нет каждый из них на одной из двух гомологичных хромосом, ответственных за резусную информацию, генный комплекс cdE (ген г"). Другими словами, имеет или не имеет каждый из них в своем резусном генотипе генный комплекс cdE или ген г. От выяснения этого вопроса во многом зависит экспертное заключение о том, мог ли конкретный мужчина явиться отцом данного ребенка или же его отцовство в отношении этого ребенка исключается.
Резусному фенотипу ответчика CcDEe, характеризующемуся наличием в его эритроцитах по крайней мере пяти Rh-факторов, могут соответствовать шесть возможных генотипов, представленных по порядку в соответствии с частотой их встречаемости среди населения Земного шара: CDe/cDE (RlR*) – 11,50%, CDe/cdE (R'r") – 0,97%, cDE/Cde (W) – 0,28%, CDE/cde (Rzr) -0,19%, CDE/cDe (RZR°) – 0,01%, cDe/CdE (R°r*) – 0%. Из этого перечня видно, что ответчик может быть отцом ребенка только в том случае, если у него имеется генотип CDefcdE. В этом случае эксперт должен использовать все возможные способы для выяснения точного резусного генотипа ответчика. При этом опять же увеличивается частота встречаемости теоретически возможных генотипов, применяются специальные серологически реагенты для уточнения резусного генотипа, а также проводится расширенное обследование ближайших родственников ответчика.
В конкретном примере эксперт, используя сывороткц анти-С и анти-Е, по преобладанию в эритроцитах ответчика антигенной выраженности С над Е устанавливает транс-локализацию соответствующих генов на гомологичных хромосомах и исключает три последние из шести возможных генотипические комбинации Rh-системы. Это также подтверждается реакцией эритроцитов с любой «сцепленной» резусной атисывороткой (отсутствие агглютинации эритроцитов с сыворотками анти-СЕ и анти-се или же агглютинация эритроцитов сыворотками анти-Се и анти-сЕ). Вопрос о том, какой конкретный резусный генотип (из оставшихся трех возможных генотипических комбинаций) имеет ответчик, эксперт решает путем расширенного обследования его близких родственников. При этом он устанавливает, что его мать имеет генотип Cde/cde (r'r) (по реакции C+c+D–Е–е+). Следовательно, ее сын, фигурирующий в качестве ответчика, может иметь только резусный генотип cDE/Cde (R2r), что исключает его в качестве отца ребенка.
Приблизительно так же решается вопрос и об ответчике II. Эксперт по реакции эритроцитов с антирезусными сыворотками (С–c+D+E+e+) видит, что этот мужчина может иметь один из трех возможных резусных генотипов cDEIcde (R2r) с частотой встречаемости 10,97%» cDe/cDE (R°R2) с частотой встречаемости 0,72% или cDe/cdE (Я°г") с частотой встречаемости 0,06%. Более того, эксперт понимает, что первые две генотипические характеристики исключают ответчика II как отца ребенка, а третья не исключает отцовства. Эксперт видит также, что в данной ситуации он не может рассчитывать на «сцепленные» антитела и антирезусные сыворотки, выявляющие «позиционный» эффект. Поэтому ему приходится ориентироваться на частоту встречаемости возможных для ответчика II резусных генотипов и главным образом на расширенное исследование его ближайших родственников Частота распространения возможных для ответчика гено-ТИПОВ, конечно же, настраивает эксперта на то, что по-видимому, этот мужчина не является отцом данного ребенка, поскольку единственно возможный резусный генотип cDe/cdE (Rг), при котором отцовство не исключается, чрезвычайно редок. Исследование резусной формулы матери ответчика (С–c+D–Е–е+) подтверждает правильность предположений, поскольку ее резусный генотип cdejcde (гг) определяет и резусный генотип ее сына cDE/cde (R2r), что исключает ответчика II в качестве отца ребенка.
Ответчик III с эритроцитарной реакцией С–c+D––Е+е+ мог иметь только один из двух возможных генотипов cDE/cDE (R2R2) или cDE/cdE (R2r"), причем в первом случае он исключался как отец ребенка, а во втором, учитывая крайнюю редкость резусных генотипов ребенка и родителей ответчика III, отцовство последнего в отношении данного ребенка практически доказано. Исследование ближайших родственников ответчика показало, что его мать и сестра имеют резусный генотип cdElcde (r"r) это было установлено по их эритроцитарной реакции С–c+D–Е+е+ с антирезусными сыворотками}; Так было доказано, что ответчик III имеет генотип cDE/cdE (R°г") последовательно, он мог передать ребенку генный комплекс cdE или ген г .
Приведенный пример наглядно демонстрирует, что только глубокое знание возможных генотипических комбинаций Rh-системы при расширенном исследовании резусных фенотипов не только f проходящих по делу лиц, но и у их ближайших родственников поможет вполне аргументированно решить вопрос о возможности или невозможности происхождения ребенка от определенной родительской пары.