Системы иммуноглобулинов
В области исследования групп крови человека едва ли найдутся две такие тесно связанные друг с другом специальности, как серо- и иммуногенетика. Оба научных направления, взаимно дополняя друг друга, в настоящее время переросли в единую научную систему, которая непрерывно совершенствуется; ее успехи широко используются в эволюционной генетике, клинической иммунологии и судебно-медицинской серологии. Поэтому без основных положений серологической и иммунологической генетики иммуноглобулинов не может обойтись ни один специалист перечисленных научных направлений.
Структура и классификация иммуноглобулинов (Ig)
В основном Ig-молекула состоит из одной пары идентичных тяжелых (Н-цепей) и одной пары идентичных легких (L-цепей) цепей, которые с помощью дисульфидных и нековалентной связей соединяются друг с другом (рис. 6).
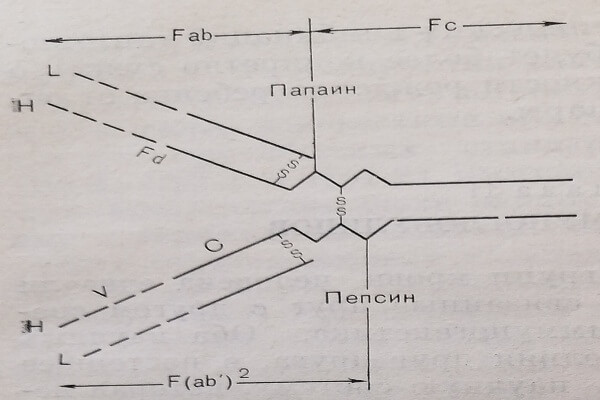
Рис. 6. Структурная модель молекулы IgG.
L-цепи в среднем включают 214 аминокислотных остатков и имеют молекулярную массу около 23000 дальтон. Половина этих цепей имеют постоянную первичную структуру (С-часть), а другая половина – вариабельную (V-часть). Такое непостоянство возникает в результате многих тысяч аминокислотных перестановок, обусловливающих антигенную направленность цепи и всей Ig-молекулы к строго специфичным антителам. По подобному же принципу построены и Н-цепи. В отличие от L-цепей они почти в 2 раза длиннее и тяжелее и около длины Н-цепи представляет собой С-часть. Вследствие этого V-части Н- и L-цепей имеют почти одинаковую величину. Под действием ферментов Ig-молекула расщепляется на Fc- и Fab-фрагменты приблизительно на середине Н-цепи или же на два Fab-фрагмента с половиной Н-цепи и всей L-цепью, причем Fab-фрагмент, разделяющий Н-цепь, называется Fd-частью.
Классификация иммуноглобулинов основана на трех формах гетерогенности этих белков: изотипы, аллотипы и идиотипы. Изотипы это различные варианты, которые в сыворотке крови каждого индивида представлены пятью классами и очень многими подклассами, причем все изотипические варианты у всех людей идентичны. Аллотипы являются генетическими иммуноглобулиновыми маркерами. При этом различные аллели обусловливают вариабельность первичной структуры цепей иммуноглобулинов. Таким образом, в данном случае речь идет уже о генетически обусловленном полиморфизме, поэтому каждый человек имеет лишь определенные структурные аллотипические варианты, которые он унаследовал от своих родителей. Различия между изо- и аллотипами проявляются и в другом. Так, если изотипы отличаются друг от друга по структурным компонентам общей С-части полипептидных цепей, позволяющим разделить их на 5 классов и множество подклассов, то аллотипы отличаются друг от друга лишь тончайшими различиями в первичной структуре С-частей полипептидных цепей, часто проявляющимися перестановкой в цепи одной или нескольких аминокислот. Из этого следует, что аллотипы чаще всего являются классо- и подклассоспецифичными.
В настоящее время у человека найдены четыре независимые друг от друга и всех других генетических маркеров крови генетические полиморфные иммуноглобулиновые системы.
- Gm-cистема. Генетический маркер у-цепей, поэтому полиморфизм системы проявляется только в гаммаиммуноглобулиновых (JgG) молекулах.
- InV-система. Генетический маркер L-цепей Н-типа, поэтому факторы системы InV обнаруживаются во всех Ig-молекулах, участвующих в «строительстве» Н-цепей независимо от их класса и подкласса.
- Фактор ISf. Генетический маркер yi-цепи, поэтому он выявляется только в IgGi-молекулах.
- Am-система. Генетический маркер а2-цепей, поэтому факторы этой системы могут быть обнаружены только в А2-молекулах.
Идиотипы характеризуются чрезвычайно многочисленными структурными вариантами в V-частях Ig-цепей. Они представляют собой биологически чрезвычайно важную гетерогенность иммуноглобулинов, поскольку определяют антигенную специфичность молекулы. Хотя число различных вариантов идиотипов у человека колеблется в пределах 105–107, для серологии групп крови идиотипы (также как и изотипы) до сих пор не имеют никакого значения.
Методика определения факторов иммуноглобулиновых систем
Обнаружение факторов Ig-систем основано на реакции торможения, или задержки агглютинации.
М. V. Waller и J. Н. Vaughan (1956), R. Grubb (1956) впервые показали, что ORho-эритроциты, сенсибилизированные неполными антителами анти-Rho, могут агглютинироваться определенным ревматоидным фактором, содержащимся преимущественно в сыворотке крови больных ревматоидным артритом. R. Grubb (1956) установил также, что определенные сыворотки способны тормозить эту агглютинацию. R. Grubb и A. Laurell (1956) доказали, что это «тормозное» свойство генетически детерминированно, а так называемый «тормозной» фактор относится к гамма-глобулиновой фракции сыворотки, поэтому он был назван фактором Gm(a).
Для обнаружения факторов систем Gm и InV необходимы человеческие эритроциты человека группы ORho; неполные антитела анти-ORho; антитела анти-Gm или анти-InV; испытуемая нормальная сыворотка. Стандартная техника выявления иммуноглобулиновых факторов систем Gm и InV сводится к следующему. Свежевзятые (не более суток) человеческие эритроциты 3 раза отмывают изотоническим раствором NaCl.
К 0,05 мл отмытого осадка эритроцитов для их сенсибилизации добавляют 0,06 мл анти-Rho сыворотки определенной Gm-специфичности (при строгом соблюдении ее разведения). Инкубацию проводят в течение 90 мин при +37° С. После сенсибилизации эритроциты снова 3 раза отмывают изотоническим раствором NaCl, осадок растворяют в 1 мл изотонического раствора NaCl для получения 5% взвеси эритроцитов. Приготовляют около 1 мл сыворотки анти-Gm необходимого разведения (этого количества сыворотки достаточно для 100 исследований). Испытуемую сыворотку разводят изотоническим раствором воды 1:10–1:20. На пластинку из плексигласа с деревянной микропипеткой наносят по одной капле сыворотки анти-Gm и испытуемой разведенной сыворотки и смешиваю их осторожным покачиванием пластинки. Через 5 мин смеси добавляют каплю сенсибилизированных эритроцитов. Пластинки помещают во влажную камеру при 44° С на 1–2 ч (время реакции и температурный режим зависят от исследуемых систем). Результаты реакции учитывают макроскопически, осторожно покачивая пластинки.
Описанный метод очень чувствительный. По данным Gohler (1966), с помощью сыворотки анти-Gm можно обнаружить 0,0004 мг иммуноглобулина, а сыворотки анти-Gm (а) – даже 0,000025 мг. При проведении указанных процедур происходит реакция, основанная на следующем принципе. Антитела анти-Gm и анти-InV направлены на определенные специфичные аллотипические детерминанты С-частей Н- и L-цепей молекулы иммуноглобулина. Эти антитела осаждают в сыворотке Ig-молекулы, которые содержат эти детерминанты. Однако обычными способами (реакция преципитации в агаре по Оухтерлони, иммуноэлектрофорез) эту преципитацию нельзя или только в крайне редких случаях можно наблюдать.
Поэтому в реакции используют неполные антитела анти-Rho, относящиеся к классу IgG и имеющие в области С-частей Н- и L-цепей определенные Gm и InV-детерминанты. Поскольку иммунные антитела, к которым относятся неполные антитела анти-Rho, чаще всего (как и миеломопротеины) имеют моноклональную природу, т. е. развиваются из одного определенного клеточного клона и очень редко вырабатываются несколькими клеточными талонами, то эти антитела также несут на себе только те факторы или детерминанты, которые соответствуют их классовой или подклассовой специфичности.
Другими словами, существует большое число неполных антител анти-Rho, имеющих различную Gm- и InV-специфичность. Так, для получения сывороток анти-Rho со специфичностью Gm(a), т. е. годных для сенсибилизации эритроцитов ORho, являющихся индикаторами реакции выявления фактора Gm(a), требуются следующие условия; иммунизация против Rho', образование неполных антител со специфичностью IgG; образование антител из тех клеточных клонов, которые синтезируют IgGi, генетическая выраженность yi-цепей этой молекулы, обусловленная действием аллеля Gma. Нахождение неполного антитела анти-Rho с необходимой Gm-специфичностью зависит, во-первых, от того, какую часть (в процентах) изотипического Ig-класса составляет Ig-подкласс, в молекулах которого находятся те или иные факторы Gm, и, во-вторых, от частоты встречаемости соответствующего фактора Gm в молекулах этого подкласса.
Если нагрузить (сенсибилизировать) эритроциты группы ORho неполными антителами анти-Rho со специфичностью Gm(a), то У-часть IgG-молекулы этого неполного антирезусного антитела соединится с антигенным рецептором Rho на поверхности ORho эритроцита, a Gm(a) специфичная детерминанта этого неполного антитела останется свободной. Если теперь добавить к сенсибилизированным эритроцитам сыворотку анти-Gm, антитела которой относятся к изотипическому классу макроиммуноглобулинов (IgM) и представляют собой пентамер (эти антитела содержат V-частей, способных связывать антигены со специфичностью Gm(а), в 5 раз больше, чем молекула IgG неполного резусного антитела), то, естественно, произойдет агглютинация эритроцитов.
Прежде всего, как было показано выше, приводятся во взаимодействие антитела анти-Gm и испытуемая нормальная сыворотка (те 5 мин соединения сыворотки анти-Gm и тест-сыворотки на пластинке до момента добавления сенсибилизированных эритроцитов). Если в испытуемой сыворотке отсутствуют IgG-молекулы со специфичностью Gm(a), то наступает упомянутая агглютинация сенсибилизированных эритроцитов. Если же испытуемая сыворотка содержит IgG-молекулы со специфичностью Gm(a), то они свяжутся с антителами анти-Gm (а), которые уже не смогут реагировать с сенсибилизированными эритроцитами и агглютинация не произойдет (задержка или торможение агглютинации).
Таким образом, в противоположность обнаружению других агглютинабельных факторов крови, когда агглютинация испытуемых эритроцитов соответствующим антителом означает присутствие в них соответствующего антигена, при реакции торможения агглютинации наблюдается иная картина: агглютинация означает отсутствие, а ее отсутствие наличие того или иного фактора иммуноглобулиновых систем (Gm, InV, Am, ISf).
Значительной проблемой при выявлении иммуноглобулиновых групп является получение специфичных сыворо ток анти-Gm. В настоящее время Gm-антитела можно получить следующими путями:
- Из сыворотки крови здоровых людей. Такие антитела анти-Gm чаще всего моноспецифичны, но обычно обладают низким титром и весьма непостоянна, т. е. могут исчезать на время и снова появляться в крови человека. Эти сыворотки анти-Gm обозначают сыворотками «SNagg» (сыворотки нормальные at, глютинирующие).
- Из сывороток крови больных первичным хроническим полиартритом. Антитела анти-Gm, получаемые из этих сывороток, нередко бывают полиспецифичными (поливалентными) против нескольких факторов системы Gm. Их титр чаще всего относительно высокий, но непостоянен. Иногда такие сыворотки анти-Gm могут давать неспецифическую реакцию (особенно при применении недостаточно разведенных нормальных, испытуемых сывороток). Эти сыворотки обозначают сыворотками «Ragg» (ревматоидные агглютинаторы).
- Гетероиммунные антитела можно получить: а) путем иммунизации кроликов человеческой сывороткой крови группы Gm (a-j-) с последующей абсорбцией эритроцитами группы Gm(a–); б) путем иммунизации обезьян очищенным человеческим гаммаглобулином; в) путем иммунизации кроликов очищенным миеломопротеином; г) путем иммунизации коз очищенным миеломопротеином.




