Лабораторные животные
В лабораторной практике наиболее часто применяются мелкие животные: собаки, кошки, кролики, морские свинки, крысы и мыши. Реже используются крупные животные: лошади, коровы, бараны, а из высокоорганизованных животных – обезьяны всех видов.
Все лабораторные животные должны быть совершенно здоровыми и нормально развитыми, что достигается только при условии их правильного разведения, содержания и кормления. Разводят как редких, так и обыкновенных животных в специальных питомниках.
От правильной организации питания животных как в питомнике, так и в вивариях зависит их общее состояние и развитие. Питание животных должно быть полноценным по химическому составу и достаточным по количеству. Для различных видов животных существуют определенные кормовые нормы.
Кормовые рационы, нормировка и режим кормления имеют большое значение для развития, роста и массы тела животного. Особенно следует следить за животными в период беременности и. кормления детенышей. Нужно учитывать и то, что многие лабораторные животные (кролики, кошки, крысы, мыши) не переносят длительного голодания и могут поедать своих детенышей или отгрызать другим части тела, поэтому кормить их следует регулярно и достаточно. Корм животных должен содержать все вещества, необходимые для нормального протекания процессов жизнедеятельности. К таким веществам относятся белки, жиры, углеводы, минеральные соли, витамины и вода. Недостаток белка в корме животных может привести к задержке роста и нарушению формирования скелета.
Некоторые лабораторные животные, как, например, кролики, морские свинки, питаются преимущественно растительной пищей. Многим лабораторным животным для предупреждения гиповитаминозных состояний рекомендуют в весенне-зимний период давать рыбий жир (источник витаминов А и D). Морским свинкам необходимо добавлять в корм продукты, содержащие витамин С.
Использование лабораторных животных в эксперименте
Лабораторных животных используют для экспериментальных исследований. Успех опытов на животных зависит в первую очередь от того, насколько правильно выбрано лабораторное животное.
Для многочисленных физиологических опытов используют лабораторных животных определенных видов, при выборе руководствуются анатомическими и физиологическими особенностями животного.
Метка животных
Все животные, находящиеся в питомниках и вивариях, должны иметь номера. Животных можно метить различными методами. Обезьян метят татуировкой на внутренней стороне верхней трети бедра. Татуировку производят с помощью стерильной иглы и после уколов втирают черную тушь.
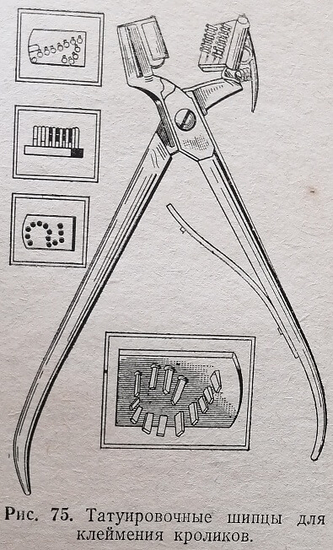
К ошейнику собаки прикрепляют металлический жетон. Кроликам и морским свинкам вставляют в ухо металлическую бляшку с номером. Острием и концами бляшки прокалывают наружную поверхность уха и загибают внутрь «а внутренней его поверхности. Применяют и клеймение с помощью татуировальных щипцов (рис. 75). Этот метод метки не приводит к отморожению ушей у кроликов, находящихся зимой в неотапливаемых помещениях. Татуировку производят хорошо продезинфицированными татуировальными щипцами на обезжиренной спиртом и эфиром внутренней поверхности уха. В место татуировки втирают черную тушь или спиртовую взвесь копоти. Мелких животных, крыс и мышей часто метят, окрашивая шерсть анилиновыми красителями.Пометку животных проводят по определенной схеме, удобной для экспериментатора. Птиц метят с помощью колец, на которых проставляют порядковые номера, или путем проколов в перепонках крыла и лапок.
Измерение температуры
Температуру тела животных измеряют чаще всего по условиям опыта. Измеряют температуру перед началом опыта и далее в продолжение всего эксперимента, всегда в определенное время, одним и тем же термометром, в течение одного и того же периода. Измерять температуру можно медицинским максимальным термометром. Термометры перед Употреблением должны храниться в дезинфицирующих растворах — денатурированном спирте или 10% растворе лизола. Перед употреблением термометр вытирают, встряхивают и, смазав кончик его вазелином, вводят животному в прямую кишку на глубину не более 3,5 см, так как при более глубоком введении температура будет иной. Температуру нужно измерять обязательно через некоторое время после дачи корма.
Для измерения температуры тела у морской свинки (рис. 76) нужно положить ее на ладонь левой руки брюшком вверх, а правой гладить по животу от шеи до лобковой кости. Термометр вводят после того, как животное успокоится. Вводить термометр надо осторожно во избежание прободения прямой кишки. Чтобы измерить температуру у кролика, его следует предварительно фиксировать, завернув в полотенце. Кролика кладут на колени и обхватывают его туловище так, чтобы голова уперлась в локоть, той же рукой приподнимают хвост, а другой рукой вводят термометр.
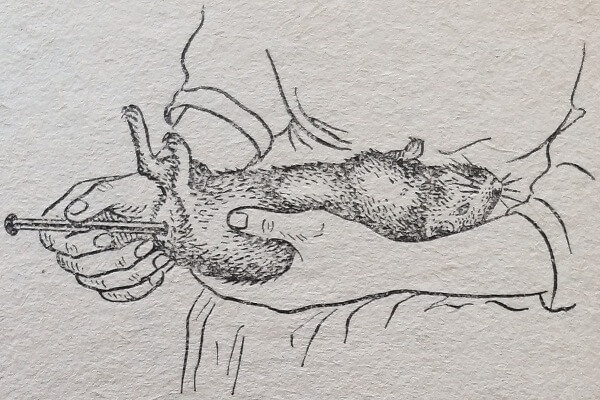
Рис. 76. Измерение: температуры у морской свинки.
Фиксирование животных
Перед проведением различных манипуляций необходимо фиксировать животных в нужном положении. Для этого можно-пользоваться различными специальными станками или держателями, а чаще всего применяют более простые приемы:. фиксирование на руках, пеленание в полотенце и фиксирование в специальных ящичках. Ящики для фиксирования бывают разных размеров, что зависит от вида используемого животного. Мышей можно фиксировать различными способами, среди которых наиболее употребительным является захват кожи на затылке у бегущей по столу мыши I и II пальцами левой руки. Мышь фиксируют на ладони левой руки и, захватив хвост и левую заднюю лапку между ладонью и II, III и IV пальцами, немного ее растягивают. Свободной правой рукой можно производить различные манипуляции (рис. 77).
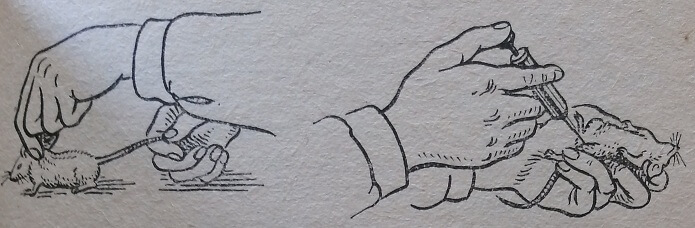
Рис. 77. Фиксирование мыши
Крысу можно фиксировать с помощью двух корнцангов, захватывая кожу на затылке одним, а кожу хвоста другим и прижимая ее при этом плотно к столу. Удобнее всего пользоваться специальными станками или ящичками для фиксирования, приготовленными из плексигласа или фанеры, с отверстиями на дне, чтобы в ящике не скапливались кал и моча. Животных фиксируют в станках, растягивая передние и задние конечности.
Методы взятия крови у лабораторных животных
Существует много способов взятия крови: у обезьян кровь берут из локтевой вены, у овец, собак, кошек – из шейной (яремной) вены или из вены бедра.
У кроликов и морских свинок кровь берут из сердца, у мышей и крыс – из хвоста путем отрезания кончика. Кровь, полученную из хвоста, собирают в пробирку или отсасывают пастеровской пипеткой.
Взятию крови должна предшествовать специальная обработка поверхности кожи. Соблюдение правил асептики обязательно. Шприц должен быть стерильным и сухим во избежание растворения эритроцитов взятой крови (гемолиз).
У морской свинки кровь берут из сердца в межреберных промежутках между IV-V-VI ребрами. На груди свинки выбривают шерсть и, смазав кожу настойкой йода, нащупывают кончиком пальца толчок сердца.
В это место у левого края грудины вкалывают иглу и направляют ее внутрь к средней линии на глубину 1,5 см. Игла должна преодолеть сопротивление плевры, перикарда и сердечной мышцы. Если игла попала в левый желудочек, то кровь начнет поступать в шприц толчками. У свинок массой 500 г и более можно взять не более 10 мл крови, а у взрослых кроликов – 25-30 мл. Тотчас после взятия крови необходимо ввести под кожу подогретый изотонический раствор хлорида натрия в двойном количестве.
Для получения больших количеств крови животных обескровливают путем перерезки сонной артерии. Для этого делают продольный разрез кожи на шее, немного отступая от средней линии, обнажают сонную артерию, и отпрепарировав ее от нерва, накладывают две лигатуры, т. е. перевязывают сосуды в двух местах на небольшом расстоянии друг от друга. Перерезают артерии между лигатурами и, захватив пинцетом лигатуру со стороны ее центрального конца, вводят в пробирку, затем осторожно подрезают стенку позади лигатуры и кровь начинает поступать струей в пробирку. Чтобы ток крови не ослабевал, массируют сердце.
Сбор мочи и кала у лабораторных животных
Экскременты у лабораторных животных чаще всего собирают при балансовых исследованиях.
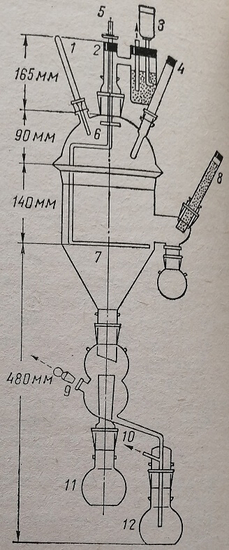
Прибор для проведения балансовых исследований состоит из двух основных частей: обменной клетки с подставкой и разделительной воронки, предназначенной для раздельного собирания мочи и кала (рис. 78, 79).
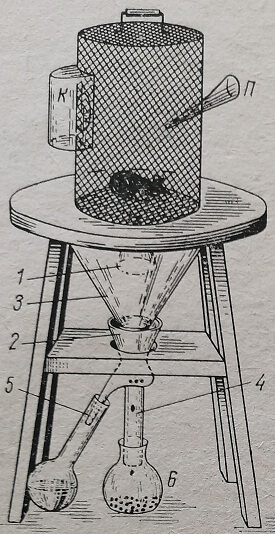
Рис. 78. Обменная клетка с подставкой. К — кормушка; Я — чернильница; 1 – малая воронка; 2 – разделительная воронка; 3 – большая воронка; 4 – отводная трубка разделительной воронки; 6 – приемник для мочи; 6 – приемник для кала.
Рис. 79. Схема усовершенствованной метаболической камеры. 1 – термометр; 2 – наставка для водяного запора; 3 – сосуд для автоматического поддержания уровня воды в водяном запоре; 4 – поилка; 5 – вывод верхней части вертикального настила; 6 – пластинка из пластиката, рассеивающая поступающий воздух вдоль стенки камеры; 7 – металлический настил; 8 – кормушка; 9 – отверстие для отсасывания воздуха; 10 – трубка для деаэрации сосуда с мочой при ополаскивании камеры; 11 – сосуд для кала; 12 – сосуд для мочи.
Обменная клетка представляет собой сетчатую железную клетку цилиндрической формы с круглым вставным дном. К обменной клетке снаружи крепится кормушка и поилка. Отверстие в стенке клетки со стороны кормушки сделано так, что туда просовывается лишь голова животного. Такое устройство предупреждает разбрасывание корма и его загрязнение. Обменную клетку помещают над большой стеклянной воронкой, которая вместе с клеткой крепится на деревянной или железной подставке. Эта воронка обычно бывает диаметром больше дна клетки и обеспечивает сбор мочи и кала без потерь.
Получение цельной крови, сыворотки и плазмы
При взятии крови у лабораторных животных на месте, где предполагается произвести прокол, сначала выстригают шерсть, обезжиривают и дезинфицируют кожу спиртом, эфиром или настойкой йода. Вену вблизи места прокола слегка прижимают, чтобы задержать отток крови и вызвать ее набухание. Место введения иглы фиксируют пальцами левой руки. Кровопускательную иглу вводят правой рукой под острым углом почти параллельно вене и осторожно продвигают в полость сосуда. Если кровь не вытекает, иглу следует повернуть вокруг продольной оси и вновь продвинуть вперед или назад. Место взятия крови сильно сжимать не рекомендуется во избежание попадания в вытекающую кровь тканевой жидкости, что может исказить результаты исследования. Также не рекомендуется брать повторно кровь из одного и того же места.
В клинической практике исследуют цельную кровь, а также плазму и сыворотку. В первом и во втором случаях необходимо предотвратить свертывание крови.
К веществам, задерживающим этот процесс, относятся сульфат магния и натрия, цитрат натрия, оксалат натрия, фторид натрия, а также вещества животного происхождения – пептон, гирудин, синантрин, гепарин и др. Для предотвращения свертывания крови в абсолютно сухой сосуд для ее сбора наливают четверть объема 25% раствора сульфата магния или половину объема полу насыщенного раствора сульфата натрия. Удобнее всего применять водные растворы: 20% раствор цитрата натрия или калия, 10% раствор фторида натрия. В центрифужные пробирки, градуированные на 10 мл, наливают по 0,3-0,5 мл какого-либо консерванта и доливают кровь до метки. После этого пробирки закрывают пробками и содержимое их тщательно перемешивают. Следует помнить, что кровь, в которую были добавлены консерванты, необходимо исследовать по возможности в более короткие сроки после ее получения, так как при долгом стоянии может происходить разложение некоторых ее веществ: изменяется реакция, разлагаются азотистые соединения, меняется активность некоторых ферментов (кислая фосфатаза, лактатдегидрогеназа, трансфераза, альдолаза и др.), происходит гликолиз, изменяется, проницаемость оболочки эритроцитов и т.д.
В связи с этим отделять плазму от эритроцитов необходимо в течение первого часа после получения крови и в этот же час производить анализ.
Получение плазмы
Жидкую часть крови (плазму) получают обычно из нитратной или оксалатной крови после центрифугирования.
При обычных условиях плазма быстро свертывается, что обусловлено наличием в ней белка фибриногена. Предотвратить свертывание крови для получения плазмы возможно с помощью добавления к ней антикоагулянтов. В приложении представлены наиболее часто применяемые для этих целей антикоагулянты, их приготовление и способы применения, а также воздействие Последних на определение тех или иных веществ, содержащихся в крови.
Получение дефибринированной крови
Свежевыпущенную кровь помещают в стерильную колбу со стеклянными бусинами и начинают взбалтывать ее в момент заполнения сосуда. Примерно через 20 мин нити фибрина оседают на бусинах и свободную от него кровь переливают в новый сосуд.
Получение сыворотки
Для получения сыворотки кровь собирают в пробирки, не допуская ее вспенивания. Для этого струю вытекающей из сосуда крови следует направлять по стенке пробирки. Собранную кровь можно оставить на один час при комнатной температуре или поставить в термостат при 37°С на 20–30 мин. Образовавшийся сгусток крови отделяют от стенок пробирки тонкой стеклянной палочкой или пастеровской пипеткой либо тонкой проволокой, обводя ими осторожно по стенке пробирки вокруг сгустка, затем центрифугируют, полученную сыворотку отсасывают пипеткой.
Получение взвеси эритроцитов
Взвесь форменных элементов получают в основном из нитратной крови после ее стояния или после центрифугирования. Центрифугируют кровь при 2000-3000 оборотов в продолжение 15 мин. После центрифугирования кровь расслаивается на плазму (вверху) и форменные элементы (внизу). Плазму отсасывают, а к осевшим на дно сосуда эритроцитам добавляют стерильный изотонический раствор хлорида натрия до первоначального объема и центрифугируют. Промывают 3-4 раза до тех пор пока надосадочная жидкость не станет совершенно прозрачной.
Получение костного мозга
Прижизненное получение костного мозга методом пункции возможно у всех видов животных и птиц. Костный мозг у лошадей получают путем прокола специальной иглой из грудины или подвздошной кости, у кроликов – из грудины или из берцовой кости, у собак – из грудины или бедренной кости, у птиц – из коленного сустава или из верхней трети плюсневой кости.
Хранение сыворотки
Сроки хранения сыворотки определяются условиями метода, используемого для определения того или иного биохимического показателя. Обычно сыворотку хранят при температуре 0-4°С в холодильниках. Для предотвращения развития микрофлоры при длительном хранении сыворотки ее следует законсервировать. Для этих целей используют фторид натрия, определение активности ферментов, электролитов, железа, белка и продуктов его обмена следует производить только в свежеполученной сыворотке.
Осаждение белков
Для осаждения белков сыворотки крови широко используют разнообразные вещества, соли тяжелых металлов (ртуть, свинец, уран), гипоксиды цинка и железа, различные минеральные кислоты (метафосфорная и азотная), спирты и кетоны (этиловый и метиловый спирт и ацетон) и неорганические кислоты (уксусная, трихлоруксусная, пикриновая).
Чаще всего осаждение белков проводят с 10% или 20% растворами трихлоруксусной кислоты. При этом рекомендуют сыворотку предварительно развести дистиллированной водой (2 части сыворотки+1 часть воды). При таком разведении концентрация трихлоруксусной кислоты должна быть 4-8%. После осаждения белка сыворотку ставят в холодильник на 20-30 мин, затем центрифугируют и отсасывают пастеровской пипеткой надосадочную жидкость, которую используют для определения биохимических компонентов. В клинической биохимической практике широко используют для осаждения белков в разведенной крови гидрат окиси цинка с последующим кипячением, охлаждением и фильтрованием через вату, предварительно обработанную кипячением.
Способы заражения лабораторных животных
Существует много способов заражения животных, чаще всего применяют подкожное заражение.
Для этого кожу приподнимают пинцетом или двум пальцами и в образовавшуюся складку вкалывают иглу шприца. Чтобы введенный материал не выливался обратно, надо отклонить иглу от первоначального направления немного в сторону и медленно вводить жидкость. Место прокола можно заклеить коллодием или прижечь раскаленной стеклянной палочкой. Мышам и крысам подкожную инъекцию делают на спине у корня хвоста, кроликам и свинкам – на спине и животе.

Рис. 80. Метод подкожного заражения
Для внутрикожного заражения иглу вводят в эпидермис, причем он должен подниматься в виде пузырьков после введения жидкости (рис. 81). Метод скарификации применяют реже. При этом способе заражения выбирают такие участки кожи, которые животное не может достать лапами и зубами (спина). На хорошо обработанном участке кожи делают царапины пером Дженнера или хирургической иглой, после чего наносят каплю материала и втирают ее стеклянной лопаточкой. Иногда втирают материал в нескарифицированную кожу (культура чумы и туляремии).
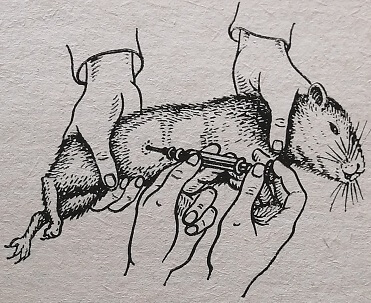
Рис. 80. Метод внутрикожного заражения
Внутрибрюшинное заражение производят путем впрыскивания материала в брюшную полость. Надо специально фиксировать животное, держа его головой вниз, чтобы не поранить кишечник. Самым распространенным является внутривенное заражение, причем пользуются различными венами. Кроликов удобнее всего заражать через краевую вену уха (рис. 82). Крысам и мышам инъекции делают в вены, расположенные по обеим сторонам хвоста, пользуясь туберкулиновыми иглами с короткими концами. Перед инъекцией следует расширить вены, для чего нужно погрузить хвост в горячую воду.

Рис. 82. Метод внутривенного заражения
Морским свинкам материал вводят в яремную вену, а птицам – в вену на внутренней поверхности крыла. Вена здесь очень хорошо выступает, если удалить перья. Птиц также заражают внутримышечно. Можно производить заражение через глаз путем закапывания материала на слизистую оболочку глаза, введением материала в переднюю камеру глаза. Заражение в центральную нервную систему производят путем введения материала под твердую мозговую оболочку.
Существуют и естественные пути заражения, среди которых наиболее распространенным является заражение через дыхательные пути и пищеварительный тракт. Заражение через дыхательные пути производят с помощью ингаляции или введением специального зонда в дыхательные пути, в трахеи и бронхи, или путем закапывания инфекционного материала в нос.
Заражение через пищеварительный тракт производят путем примешивания заразного материала к корму животных или введением материала через канюлю, т. е. стеклянную трубку с оттянутым концом, или при помощи шприца в рот, заставляя животное проглотить введенный материал. Чтобы животное открыло рот, надо надавливать на скулы пальцами и открывать рот пинцетом. Тонким, зондом или катетером можно вводить материал непосредственно в желудок. Мышам можно вводить материал в желудок иглой с утолщением на конце.
Методы применения наркотических веществ
Наркотические вещества применяют для общего наркоза и местного обезболивания перед хирургическими операциями.
У собак применяют хлороформный, морфильный, гексеналовый, нарколановый наркоз, у кошек и других животных – эфирный и хлоралгидратный наркоз. Местную анестезию производят обычно 1 % раствором кокаина, 5% раствором новокаина по 0,5 г. Для того чтобы увеличить длительность анестезии, к раствору новокаина или кокаина прибавляют от 2 до 5 капель раствора адреналина (1:1000). При анестезии слизистых оболочек носа глаз, полости рта или прямой кишки можно пользоваться 5% раствором кокаина. При назначении наркотизирующих средств следует помнить о возможных осложнениях. Применять эти вещества следует осторожно.
У мелких лабораторных животных после наркоза часто наблюдается отек легких, и они погибают.
Содержание животных
Все лабораторные животные содержатся в клетках, Клетки для каждого вида животных имеют строго определенный вид. Для собак строят в виде отдельных домиков длиной, шириной и высотой не более 1 м. Будка обязательно должна стоять на небольших ножках. Клетка должна обязательно разбираться, чтобы ее легко можно было мыть и дезинфицировать.
В дне клетки должно быть два днища, которые ежедневно тщательно промывают и дезинфицируют. На нижнее днище укладывают опилки, которые ежедневно заменяют свежими.
Кроликов тоже содержат в клетках, чаще всего по одному, но могут быть и большие клетки, рассчитанные на одного взрослого кролика и 2-3 крольчат. Кролики могут зимовать в неотапливаемых помещениях, но при этом необходимо защищать их клетки от сквозняков с помощью специальных соломенных подушек. Клетки могут быть из проволоки. Такие клетки легко дезинфицировать растворами лизола. Периодически клетки прожигают паяльной лампой или над газовой горелкой, подстилки из сена меняют ежедневно.
Морские свинки содержатся в обычных сетчатых металлических клетках с реечным дном. Клетку ставят на специальное днище, которое легко можно заменить. Реечное дно очень удобно: моча и кал падают на нижнее днище и удаляются при ежедневной уборке.
Очистку клеток следует производить ежедневно, а один раз в неделю или декаду специально дезинфицировать все клетки. В помещении, где находятся морские свинки, не должно быть сквозняков. В каждой клетке содержат не более 2-3 взрослых особей.
Мышей можно содержать в различных клетках и во множестве. Клетки для мышей делают деревянные с перегородками, где есть отделения для разведения мышей, их содержания и кормления. Однако деревянные клетки мало гигиеничны, мыши легко прогрызают их, поэтому лучше пользоваться цельнометаллическими клетками (обтянутыми металлической сеткой) или стеклянными киками емкостью 10-12 л, высотой 50 см, с широким горлом.
Цельнометаллические клетки и стеклянные банки очень удобны, так как их легко чистить и мыть дезинфицирующими средствами. Обязательным условием для содержания мышей является равномерная температура и достаточная сухость помещения.
Клетки и банки с мелкими лабораторными животными размещают в виварии на стеллажах. Чистку клеток и банок и смену поддонников производят через день.
Для дезинфекции нередко применяют 5% горячий водный раствор карболовой кислоты, 5% водный раствор креолина, лизола, формалина, 0,2-3% раствор хлорамина, зольный щелок (2 кг золы на 10 л воды, из этой жидкости готовят рабочие растворы). Дезинфекцию и дезинсекцию можно производить при помощи гидропульта. Соблюдение санитарно-гигиенических правил и профилактические меры необходимы еще и потому, что почти все лабораторные животные очень восприимчивы к различным инфекционным и инвазионным заболеваниям.
Болезни лабораторных животных
Названия наиболее распространенных заболеваний лабораторных животных, клинические признаки и меры профилактики приведены в приложении.
Заболевших животных немедленно изолируют в специальное помещение для больных животных, где за ними наблюдает ветеринарный врач, там же они проходят курс лечения, а помещение, где они находились ранее, подвергают дезинфекции. Трупы павших животных обязательно сжигают. Деревянные клетки, мусор и остатки пищи также сжигают. Металлические клетки, кормушки, поилки дезинфицируют.
Иногда по условиям опыта экспериментальное животное необходимо умертвить. Кроликов забивают ударом по голове или введением воздуха в краевую вену уха. Собак, кошек и крыс умерщвляют отрубанием головы в специальных станках. Мелких животных можно помещать в склянку с притертой крышкой, куда кладут вату, смоченную эфиром или хлороформом. Метод забоя животных в основном зависит от проводимого эксперимента. Вскрытие трупов животных производят на специальных столах-стенках или в ванночках. Перед вскрытием следует записать в протокол, какого вида животное вскрывают, какого пола, указать его номер, время заболевания и смерти, клинический диагноз, дату, время вскрытия и результат внешнего осмотра, затем уже ведут собственно протокол вскрытия.
Труп животного укладывают брюшком вверх, снимают волосяной покров на груди, животе и рассекают кожу от подбородка до половых органов по средней линии. Отделив кожные лоскуты, разрезают брюшную полость и осматривают внутренние органы. Берут кусочек органов для исследования и, вскрыв грудную полость, осматривают грудные органы. Часть органов помещают в 5‘% или 10% раствор формалина или в специальные растворы для фиксации.
Бактериологические исследования следует производить вскоре после смерти животного и не ждать распространения микроорганизмов из кишечника по всему телу. Материал для бактериологического исследования берут асептически. Инструменты дезинфицируют. Материал собирают в стерильные чашки Петри, а затем производят посев на специальные среды.
Если в учреждении нет специальной бактериологической или гистологической лаборатории, то отобранный для исследования патологоанатомический материал посылают в ближайшую ветеринарную или медицинскую лабораторию. Посылать материал следует с нарочным и как можно скорее. Пересылать материал почтой не следует. Трупы пересылают в специальной мешковине, смоченной раствором лизола или креолина. Пересылать трупы почтой можно только в запаянных железных ящиках.