Тромбозы вен и тромбоэмболии
В настоящее время частота тромбозов вен, осложненных смертельными тромбоэмболиями, составляет от 2,7 (1964 г.) до 3,8 (1972 г.) на 100 000 родов.
Этиология и патогенез
Проблема внутрисосудистого тромбообразования в целом продолжает оставаться нерешенной с точки зрения причин его возникновения и патогенеза, а также создания надежных методов профилактики и лечения. До сих пор господствует положение о роли трех групп причин в патогенезе внутрисосудистого тромбообразования: 1) изменение сосудистой стенки; 2) нарушение скорости кровотока; 3) изменение физических и химических свойств крови.
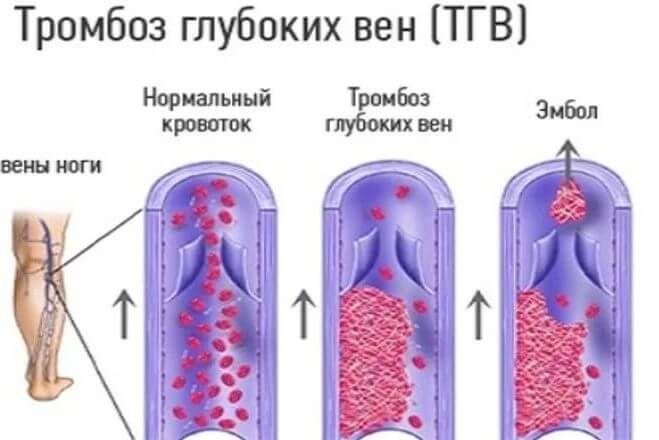
Многочисленные исследования, проведенные в этом направлении, позволили выявить целый ряд важных в научном и практическом отношении фактов. Было показано, что в результате механической, химической или бактериальной травмы наступает повреждение сосудистой стенки, на месте которого начинает образовываться тромб. Эти повреждения в одних случаях носят характер грубых деструктивных изменений всех или большинства морфологических структур сосудов (атеросклероз, флебит, аневризма); в других – обусловлены биохимическими сдвигами в структуре отдельных стенок сосудов, в третьих – касаются морфологических и функциональных сдвигов тучных клеток сосудистой стенки, ответственных за выработку гепарина; в четвертых – связаны с нарушением заряда интимы сосуда. В норме интима сосуда заряжена отрицательно, адвентиция – положительно (Sawyer и соавт., 1954, 1961; Mustard и соавт., 1962). Отрицательный заряд носят и форменные элементы (Mischel, 1961). Наличие отрицательно заряженной интимы и форменных элементов приводит к тому, что в нормальных физиологических условиях эритроциты и тромбоциты отталкиваются как друг от друга, так и от сосудистой стенки и не соприкасаются с ней. Повреждение сосудистой стенки меняет заряд интимы, способствует агрегации и приклеиванию тромбоцитов к поврежденному участку и развитию пристеночного тромбообразования.
Стенка сосуда содержит тромбопластический фактор, антитромбиновую субстанцию, антикоагулянты и активаторы фибринолиза. Инъекции адреналина, норадреналина, ацетилхолина, гистамина, тромбина, нитроглицерина, гипоксия, болевые раздражения, стимуляция симпатических ганглиев, раздражение блуждающего нерва приводят к резкому усилению выхода этих субстанций в кровоток (Б. И. Кузник, 1966; Б. И. Кузник и соавт., 1972). Следовательно, сосудистая стенка принимает активное участие в регуляции свертываемости и фибринолитической активности крови и, при прочих равных условиях, может играть существенную роль в увеличении коагулянтов и создании условий для тромбообразования.
Формирование тромба может происходить и при ненарушенной сосудистой стенке. В этом случае под влиянием повышенного тонуса симпатической нервной системы или отдельного ее сегмента происходит изменение трофических процессов в определенном участке сосудистой стенки, где и создаются условия для образования тромба (А. А. Маркосян, 1966).
Замедление кровотока может быть обусловлено расширением сосуда (варикозно расширенные вены, аневризмы), спайкой сосудов или их пережатием (прижатие сосудов беременной маткой), и, наконец, недостаточностью кровообращения. Известно, что кровоток у стенки более замедлен, а в центральной части сосуда плазма движется быстрее, увлекая за собой форменные элементы. У стенки сосуда располагается преимущественно плазма, а в центре – форменные элементы. При замедлении кровотока форменные элементы более равномерно смешиваются с жидкой частью крови и приближаются к стенке сосуда. Если сосудистая стенка повреждена (при этом меняется и заряд интимы), то к этому участку приклеиваются тромбоциты, вследствие чего создается очаг для образования тромба. Такие условия могут возникать при беременности, которая сопровождается увеличением массы циркулирующей крови, замедлением венозного кровотока и снижением венозного тонуса. Эти факторы способствуют развитию варикозного расширения вен (по данным Netter и соавт., 1964, оно составляет 13,6%) и еще большему замедлению кровотока.
Вопросам изучения химизма крови и патогенеза тромбообразования посвящено много исследований. Было показано, что в основе внутрисосудистого тромбообразования лежит повышенная свертываемость крови; большое значение придается активации фактора XII, которая происходит при соприкосновении последней с тканевым тромбоплафеном, выделяющимся из поврежденного сосуда (Reimer с соавт., 1960). Затем активируются факторы IX и XI и происходит агрегация тромбоцитов. Начавшийся ферментативный процесс в итоге заканчивается образованием фибрина.
Koller (1961) считает, что наклонность к тромбообразованихо возникает при активации факторов XII и IX, уменьшении активности ингибиторов свертывания, снижении фибринолитической активности крови и повышении активности ингибиторов свертывания. Активация факторов XII и IX может иметь место при операциях, родах, обширных травмах, воспалительных процессах. Ускорение свертывания крови происходит при употреблении жирной пищи, поступлении в кровь продуктов нарушенного обмена веществ, при ожогах, дегидратации, агглютинации, кровопотере, введении адреналина, норадреналина, метилксантинов, кофеина, теобромина, теофиллина, аминофиелина, сердечных гликозидов, прокаина, морфина и его производных, транквилизаторов, некоторых антибиотиков, витамина С, при сдвиге рН крови.
Возникновению тромбов способствует длительная терапия кортизоном.
Многие исследователи считают, что в основе внутрисосудистого тромбообразования лежит ускоренное свертывание крови за счет повышенного образования тромбопластина. Заслуживает внимания мнение Б. А. Кудряшова и соавт. о том, что внутрисосудистый тромбоз обусловлен нарушением динамического равновесия между системой свертывания и нейро-гуморальной физиологической антисвертывающей системой, когда в ответ на появление в крови высоких доз коагулянтов не вырабатывается достаточное количество антикоагулянтов. Последнее приводит к повышению свертывания крови и может явиться причиной тромбоза.
Таким образом, внутрисосудистый тромбоз может быть обусловлен действием одной из вышеуказанных групп причин, а чаще, по-видимому, имеет место комплексное воздействие многих причин, среди которых одна может быть доминирующей. Большинство исследователей склонны считать, что при повреждении сосудистой стенки (операция, роды, травма, воспаление) выделившийся тканевой тромбопластин активирует фактор XII, затем IX и XI. Вскоре наступает агрегация тромбоцитов как в силу действия вышеуказанных активных факторов, так и в результате изменения заряда с последующим их приклеиванием к поврежденному сосуду. Начавшийся внутри сосуда ферментативный многоступенчатый процесс свертывания не находит противодействия со стороны антисвертывающих механизмов (гепарин, фибринолизин, антитромбины) и заканчивается образованием фибрина. Последний наслаивается на скопившиеся у стенки тромбоциты. Из образовавшегося тромба продолжают поступать в кровь вещества, активирующие новые порции фактора XII. Появление тромба внутри сосуда вызывает спазм последнего и замедление тока крови, вследствие чего появляются дополнительные факторы, способствующие тромбообразованию.
При акушерской патологии в патогенезе внутрисосудистого тромбообразования существенное значение имеют сердечно-сосудистые заболевания беременных, ожирение, токсикозы, инфекция в родах и в послеродовом периоде. Значительное место занимает травма родовых путей в связи с оперативным родоразрешением. Наличие раневой поверхности на внутренней поверхности матки, а также в других отделах родовых путей (разрывы шейки, влагалища, промежности) в сочетании с инфекцией создает оптимальные условия для тромбообразования. Возможность тромбообразования повышается при наличии флебитов сосудов матки, таза и нижних конечностей. Тромб может отрываться и вызывать эмболию легочной артерии.
На основании многочисленных наблюдений течения послеродового периода и проведенных исследований установлено, что в патогенезе внутрисосудистого тромбообразования у беременных, рожениц и родильниц можно выделить предрасполагающие, способствующие и непосредственные факторы. К предрасполагающим относятся колебания атмосферного давления, ожирение, наследственное предрасположение. Способствующими факторами являются акушерские операции, повреждение сосудов, кровотечение, замедление кровотока, повышение свертываемости крови. Непосредственная причина – инфекция. Наиболее частым источником эмболов бывают тромбы вен нижних конечностей, малого таза, матки, придатков, а также других органов.
Клиническая картина тромбофлебита вен нижних конечностей, как правило, развивается на 1–18-й день после родов и во многом зависит от характера и глубины поражения сосудов. При наличии тромбофлебита поверхностных вен отмечаются гиперемия кожи, уплотнение ее и болезненность по ходу напряженной и воспаленной вены. Общее состояние удовлетворительное, однако у многих больных наблюдается ступенеобразное нарастание пульса (симптом Малера), у некоторых – боли в икроножных мышцах (симптом Олова). Температура тела чаще субфебрильная, в крови – незначительные изменения или умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево, СОЭ несколько повышена.
При поражении глубоких вен бедра (бедренный или бедренно-подвздошный тромбофлебит) температура тела повышается до 39,5–40°, сопровождается частыми ознобами. Общее состояние, как правило, средней тяжести или тяжелое. Больные обычно жалуются на боли в икроножных мышцах, а также тупые, иногда острые или ноющие боли в подвздошной и паховой областях, реже в области поясницы или тазобедренных суставов (при подвздошно-бедренном тромбофлебите). Уже на 1–3-й день от начала заболевания развивается отек пораженной конечности от едва заметного в области нижней трети голени и стопы до обширных, захватывающих всю нижнюю конечность, наружные половые органы, ягодицы и даже нижнюю половину туловища. Распространенные отеки отмечаются обычно при поражении подвздошных вен и особенно нижней полой вены. У некоторых больных уже в самом начале заболевания в области скарпова треугольника появляется уплотнение и болезненность при пальпации. В этих случаях в паховой области на стороне поражения наблюдается сглаживание и опущение верхнего угла паховой складки по сравнению со здоровой стороной. Кожные покровы конечности бледные или чаще цианотичные, иногда отмечается усиление венозного рисунка (симптом Фэре). У многих больных на фоне общей бледности кожных покровов в различной степени выражена желтушность. Лейкоцитоз достигает 16 000–20 000 со сдвигом лейкоцитарной формулы влево, преимущественно за счет нейтрофилов, повышена СОЭ. Коагулограмма и тромбоэластограмма в большинстве случаев указывают на повышенную свертываемость крови.
Метрофлебиты и флебиты тазовых вен, как правило, развиваются на 8–19-е сутки после родоразрешения, чаще у женщин, у которых роды осложнились эндометритом или кровотечением. Нередко они сочетаются с флебитом вен нижних конечностей.
Клинически метрофлебиты характеризуются субинволюцией матки, длительным, временами обильным кровотечением. При бимануальном исследовании пальпируется увеличенная пастозная матка, определяется болезненность вдоль прикрепления широких маточных связок, где иногда пальпируются извитые тяжи.
Более редко встречается тромбофлебит яичниковых вен с одной (чаще правой) или с обеих сторон. Осложнение развивается на 2–4-й день после родов и проявляется повышением температуры, болями в подвздошной области на стороне поражения вены, иррадиирующими в поясницу или в подреберье, учащением пульса. Как правило, отмечается субинволюция матки. При исследовании определяется инфильтрат в боковом своде влагалища или в подвздошной области. При тромбофлебите правой яичниковой вены клиническая картина напоминает острый аппендицит. В этих случаях диагноз чаще устанавливают во время операции.
Еще реже послеродовой период осложняется тромбозом сагиттального синуса с развитием мозговых симптомов. Для установления диагноза применяют электроэнцефалографию и мозговую ангиографию.
Наиболее грозным осложнением тромбофлебитов в послеродовом периоде является тромбоэмболия легочной артерии. При закупорке центрального ствола легочной артерии смерть наступает в ближайшие минуты в связи с полным или почти полным (до 75%) прекращением притока крови к легким. Рефлекторные реакции из зоны основного ствола легочной артерии и ее бифуркации ограничиваются лишь влиянием на ритм сердца (брадикардия) и небольшой прессорной реакцией на сосуды большого круга кровообращения (Aviado, 1951; Aviado, Schmidt, 1959).
При закупорке и раздражении рецепторных полей мелких ветвей легочной артерии возникает целый ряд рефлекторных нарушений функции дыхания и сердечно-сосудистой системы, которые сводятся к следующему: брадикардия, кратковременный подъем, а затем падение периферического кровяного давления, спазм артериол, повышение проницаемости легочных капилляров, иногда отек легких, частое поверхностное дыхание и спазм бронхов. Особенности клинического течения эмболии легочной артерии следует оценивать, исходя из вышеперечисленных рефлекторных реакций. Закупорка и сопутствующий спазм легочной артерии приводят к резкому повышению давления в легочной артерии. Одновременно падает сосудистый тонус в большом круге (снижается артериальное давление и нарушается дыхание). Рефлекторная гипотония в большом круге кровообращения уменьшает приток крови к правому предсердию и желудочку и способствует «разгрузке» правого желудочка. При резкой гипотонии (сосудистом коллапсе) циркуляторные расстройства усугубляются. Снижение давления в аорте ведет к недостаточности кровоснабжения работающего миокарда и ухудшает функцию сердца.
Закупорка более крупных артериальных стволов легочной артерии не сопровождается описанными выше рефлекторными реакциями. В этих случаях клиническая картина может быть настолько мало выражена, что об эмболии узнают лишь на основании развившегося инфаркта легкого. Следует все же отметить, что при эмболии одной из крупных ветвей легочной артерии иногда развивается острая сердечно-сосудистая недостаточность и даже наступает смерть (Б. М. Шершевский, 1968).
Диагностика тромбоэмболии легочной артерии в последовом или послеродовом (послеоперационном) периодах у большинства больных не представляет трудности. Клиническая картина эмболии легочной артерии и ее исход во многом зависят от величины эмбола, места его расположения, степени окклюзии легочного русла и выраженности рефлекторных реакций. Различают несколько клинических форм тромбоэмболии легочной артерии.
Молниеносная, или синкопольная, форма, при которой происходит массивная закупорка центрального ствола легочной артерии, и смерть наступает от остановки сердца в течение нескольких секунд. Начало эмболии острое, без предвестников. Внезапно наступает приступ резких сильных болей за грудиной, развивается удушье, коллапс, появляется цианоз шеи, верхней части груди и конечностей, иногда судороги и непроизвольное мочеиспускание. Артериальное давление быстро снижается, венозное увеличивается, наступает тахикардия. Вены шеи могут быть вздуты, правая граница сердца резко смещена вправо, выслушивается ритм галопа. На электрокардиограмме, снятой до остановки сердца, выявляется характерное дискордантное смещение интервала ST, глубокий зубец Si, выраженный зубец Qui, что напоминает картину инфаркта задней стенки сердца.
При закупорке средних и мелких ветвей легочной артерии клиническая картина эмболии менее бурная. У некоторых больных на фоне артериальной гипотонии и тахикардии на первый план выступает чувство страха смерти. Они мечутся в беспокойстве и просят о помощи. Дыхание частое и поверхностное, кожные покровы бледные. Больные погибают в течение 10 мин с момента появления первых жалоб.
Эмболия легочной артерии, характеризующаяся остро развивающимся сердечно-сосудистым коллапсом. Артериальное давление резко снижено, пульс частый, нитевидный. Дыхание поверхностное, частое, иногда появляется кровохарканье. Симптомы право-желудочковой недостаточности отсутствуют. Изменения электрокардиограммы нетипичны и напоминают таковые при инфаркте миокарда. Такие больные живут от нескольких часов до нескольких дней. При рентгенологическом исследовании выявляется инфаркт легкого.
Эмболия легочной артерии с выраженной дыхательной недостаточностью. Хорошо выявляются признаки правожелудочковой недостаточности. Больные жалуются на резкую боль за грудиной и сильное удушье. Дыхание учащено, отмечаются гипервентиляция, ортопноэ, цианоз, тахикардия, расширение зрачков и набухание шейных вен. В легких иногда развивается картина острого отека. Больные живут от 30 мин до нескольких часов, и нередко сознание у них сохранено до самой смерти.
Следовательно, почти при всех формах эмболии имеет место тахикардия и одышка. Если артериальное давление резко снижено, набухание шейных вен может отсутствовать. Этот симптом свидетельствует о выраженной и наиболее характерной картине эмболии легочной артерии. В установлении диагноза эмболии в значительной мере помогает наличие очагов тромбоза. Ценным подспорьем является электрокардиография, особенно в тех случаях, когда имеется запись до начала эмболии.
При установлении диагноза необходимо учитывать другие формы эмболии, инфаркт миокарда, отек легких, бронхопневмонию, острый коллапс при перитоните, эндотоксиновый шок.
Профилактика эмболии легочной артерии заключается в предупреждении развития тромбов. При проведении родов и акушерских операций необходимо избегать резкого и длительного сгибания нижних конечностей, внутривенных вливаний в вены нижних конечностей. Следует шире рекомендовать раннее вставание родильниц.
Особое внимание должно быть уделено родильницам после операции кесарева сечения, у которых роды осложнились инфекцией и большой травмой родовых путей, при беременности, осложненной варикозным расширением вен нижних конечностей, тромбофлебитом и появлением очагов септической инфекции.
Большое внимание в настоящее время уделяется диагностике предтромботического состояния. Несмотря на большое число работ, посвященных этому вопросу, до сих пор нет единой точки зрения по вопросу этиологии и патогенеза внутрисосудистого тромбоза, а также надежных методов диагностики предтромботического состояния.
Принято считать, что о пониженной или повышенной способности крови к свертыванию можно говорить на основании данных времени свертывания крови на силиконовой поверхности, определения количества и адгезивности тромбоцитов, установления толерантности плазмы к гепарину, протромбинового и тромбо-пластинового времени, количества фибриногена, гепарина, фибринолитической активности крови в сопоставлении с данными тромбоэластограммы. Если после проведенных исследований заподозрена повышенная способность крови к свертыванию, необходимо назначать антикоагулянты.
Если до возникновения эмболии легочной артерии диагностированы очаги внутрисосудистого тромбоза, надежным средством для профилактики эмболии является хирургическая перевязка сосуда выше места тромбоза. Описаны наблюдения успешной перевязки нижней полой вены при ее тромбозе, яичниковых вен и тромбэктомии.
В случае развития тромбоза магистральных сосудов показана тромб-эктомия на ранних стадиях (Ю. Э. Мяииста с соавт., 1970) с последующим назначением тромболитической терапии (Т. О. Остапов, Б. Б. Бекишев, 1973). Последняя может быть применена как самостоятельный метод для лечения тромбозов и профилактики тромбоэмболии (Л. Г. Богомолова и соавт., 1966; М. С. Мачабели с соавт., 1967; Б. А. Пуриня, 1968; Ю. А. Давыдов, 1968; А. И. Трегубенко, 1969, 1972; А. А. Шалимов с соавт., 1969; Г. В. Андренко, 1973; В. А. Шестакова с соавт., 1973; В. В. Овсов, М. А. Узлов, 1973, и др.). В настоящее время широко используют внутривенное введение препаратов дексифанов (полиглюкин, реополиглюкин и др.).
При возникновении тромбоэмболии легочной артерии успех лечения во многом зависит от массивности эмболии и от того, как скоро и в каком объеме проведены необходимые мероприятия.
В настоящее время для лечения тромбоэмболии легочной артерии применяют 3 группы методов (А. И. Трегубенко, 1972):
- консервативный метод с применением фибринолитиков, антикоагулянтов, спазмолитиков, сердечных глюкозидов;
- фибринолитическая и антикоагулянтная терапия в сочетании с перевязкой венозных магистралей или введением в нижнюю полую вену специальных полиэтиленовых фильтров;
- прямая эмболэк-томия (операция Тренделенбурга и ее модификации).
Эмболэктомия показана ограниченному числу больных и, как правило, невыполнима, так как для этого требуется целый ряд условий (Б. Р. Мейе-рович, 1966; Н. М. Рзаев, 1966; А. А. Шалимов и соавт., 1969; А. И. Трегубенко, 1972), которые в акушерских отделениях не всегда могут быть созданы.
Наиболее приемлемым является консервативный метод лечения или сочетание его с перевязкой венозного сосуда выше локализации тромба. В этих случаях как можно раньше следует наладить дыхание кислородом, а более тяжелым больным обеспечить управляемую вентиляцию. В зависимости от тяжести состояния применяют следующую схему лечения.
I. При тяжелых молниеносных формах необходимо попытаться восстановить сердечную деятельность (внутрисердечное введение адреналина, непрямой или прямой массаж сердца) и одновременно произвести эмболэктомию (операция Тренделенбурга). Если условий для эмболэктомии нет, другие лечебные мероприятия неэффективны.
II. При острых и замедленных формах, когда больные живут без оказания помощи 15 мин и более.
1. С целью обезболивания вводят морфина гидрохлорид (1 мл 1% раствора), текодин (1 мл 1% раствора), омнопон (1 мл 2% раствора), промедол (1 мл 2%раствора) внутривенно в сочетании с атропином (0,5–1 мл 0,1% раствора); дроперидол (1– 3 мл) внутривенно. Затем при необходимости применяют лечебный наркоз с управляемой вентиляцией легких чистым кислородом под давлением (6–8 л/мин), так как легочная ткань в этих случаях обладает определенной ригидностью.
2. После введения одного из наркотиков и атропина внутривенно вводят пентамин из расчета 20 мг в 1 мин – всего до 100 мг. Для этого 2 мл 5% раствора пентамина разводят в 100 мл 5% раствора глюкозы или изотонического раствора и вводят из расчета 20 мл раствора в 1 мин.
При максимальном артериальном давлении ниже 100 мм рт. ст. скорость введения пентамина уменьшают в 2 раза и вводят внутривенно только 50 мг (1 мл 5% раствора) или 50 мл разведенного раствора, а остальные 50 мл – внутримышечно. Если состояние больной не улучшается, пентамин вводят повторно и внутримышечно в дозе до 500 мг.
3. Сразу же после введения пентамина внутривенно назначают 0,25 мг строфантина (0,5 мл 0,05% строфантина в 20 мл 40% глюкозы), а затем 15 000–20 000 ед. гепарина (в последующем – через каждые 6 ч по 10 000 ед). Через ту же иглу очень медленно капельно вливают 0,25% новокаин до 100–150 мл или внутривенно 10 мл 2,4% эуфиллина, а также папаверин (2–4 мл 2% раствора), ношпу (2 мл 2% раствора), если артериальное давление не ниже 80 мм рт. ст. Через иглу, введенную в вену другой руки, необходимо вводить фибринолизин. Перед употреблением фибринолизин разводят из расчета 100 ед. в 1 мл, затем на каждые 20 000 ед. добавляют 10 000 ед. гепарина. Полученную смесь вводят со скоростью 500–8000 ед. в 1 ч, то есть 200 мл раствора, содержащего 20 000 ед. фибринолизина и 10 000 ед гепарина (скорость введения раствора– 10–12 капель в 1 мин). При хорошей переносимости препарата скорость введения раствора увеличивают до 15–20 капель в 1 мин. Суточная максимальная доза фибринолизина должна составлять 40 000 ед. После улучшения состояния больной назначают в тот же день антикоагулянты непрямого действия (пелентан, фенилин, синкумар, омефин) с учетом времени «пика действия». Доза пелентана – 0,5–0,1 г. Максимум действия начинается спустя 12–72 ч после приема. Синкумар назначают по 0,004 г (максимум действия – через 24–48 ч после приема). Фенилин дают по 0,02 и 0,03 г. Действие препарата начинается через 8–10 ч и достигает максимума через 24–30 ч после приема. Омефин назначают по 0,05 г. Действует быстро и менее продолжительно, чем дикумарин, но более продолжительно, чем пелентан и фенилин.
Общая разовая и суточная доза антикоагулянта зависит от состояния свертывающей системы и назначают его под контролем тромбоэластограммы и коагулограммы с учетом времени свертывания и кровотечения, динамики изменения протромбина. Обычно индекс протромбина удерживается на уровне 40–50%. При проведении антикоагулянтной терапии внутрисосудистых тромбозов и тромбоэмболии необходимо учитывать, что действие гепарина почти полностью прекращается спустя 4–6 ч с момента введения, а антикоагулянтов непрямого действия начинается не ранее чем через 8 – 10 ч. Почти все они в разной степени обладают кумулятивным действием. Следует помнить, что антикоагулянты выделяются с молоком матери и при длительном их применении могут возникать осложнения у детей. При передозировке антикоагулянтов назначают викасол по 0,015 г 3 раза в сутки внутрь или 2 мл 1 % раствора внутримышечно.
При артериальном давлении ниже 70 мм рт. ст. вместо новокаина вводят изотонический раствор натрия хлорида или 5% раствор глюкозы с норадреналином (1 мл 0,1% норадреналина на 300–400 мл раствора с таким расчетом, чтобы давление поднялось до 90 мм рт. ст.). Если норадреналин по каким-либо причинам не показан, то вместо него назначают 25–50 ЕД АКТГ, 25– 75 мг гидрокортизона или 15–30 мг преднизолона. Тяжелобольным норадреналин и глюкокортикоиды назначают совместно.
Введение папаверина и атропина малоэффективно, однако последний необходимо вводить перед интубацией.
В процессе лечения проводят электрокардиографические исследования, а при необходимости в постели производят рентгенологическое исследование легких.
Необходимо установить источник эмболов и при выявлении последнего произвести перевязку сосуда выше локализации тромба для профилактики повторных эмболии.
III. При стертых формах эмболии легочной артерии используют индивидуально лечебные мероприятия, рекомендуемые при формах средней тяжести.




