Биохимическая характеристика матки
Мышечные белки матки
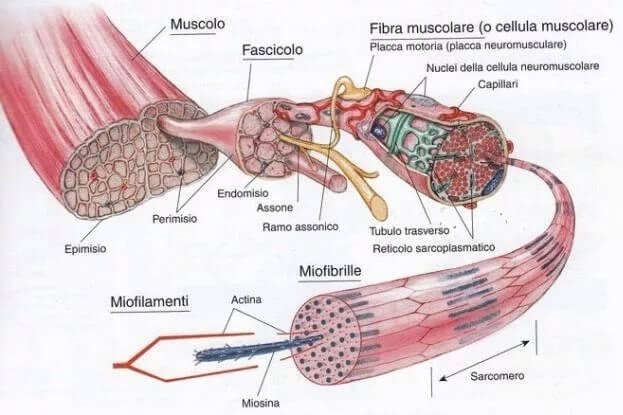
Мышечные белки матки условно делят на миофибриллярные, обеспечивающие основные функции матки, саркоплазматические, участвующие в процессах метаболизма мышечной клетки и строминовые – из соединительнотканных образований.
Белки миофибрилл
К основным белкам миофибрилл относятся миозин, актин, актомиозин, тропомиозин и ряд других белковых соединений, функциональная роль которых еще окончательно не выяснена. Основным комплексом сократительных белков является актомиозин – соединение актина и миозина. Миозин является глобулином, легко растворимым в дистиллированной воде; он находится в тканях в виде гидрофильного коллоида, составляя до 40% всех мышечных белков. Миозин обладает свойством фермента, катализирующего гидролиз аденозинтрифосфорной кислоты (АТФ) с образованием АТФ и неорганического фосфата; в свою очередь АТФ изменяет механические свойства миозиновых нитей.
Актин
Актин является вторым белком сократительного комплекса, составляя около 20% фибриллярных белков. Соединение актина и миозина – не просто механическая смесь двух мышечных белков, а самостоятельное образование со своеобразными механохимическими свойствами с сохранением АТФ-свойств миозина.
Актин и миозин в живой мышце находится в соотношении 1 : 2,5.
Мышца матки, так же как и скелетные мышцы, содержит актомиозин; по современным представлениям, разница между ними лишь количественная. Актомиозина в мышце матки значительно меньше, чем в скелетной мускулатуре; содержание его меняется в зависимости от физиологического состояния женщины (менструальная функция, беременность, менопауза). По данным Csapo, в миометрии небеременного животного актомиозин составляет около части сократительного белка скелетной мышцы того же животного. Матка женщины вне беременности содержит также небольшое количество актомиозина – от 5 до 8 мг на 1 г тела матки. АТФ-активность актомиозина мышцы матки человека и животных во много раз ниже таковой скелетной мышцы.
С наступлением беременности и в процессе ее развития количество актомиозина увеличивается в 2 и более раз. Во время беременности снижается АТФ-активность актомиозина, что создает условия для снижения моторной функции матки, донашивания беременности и накопления веществ, необходимых для нормального течения родовой деятельности.
В живой мышце матки имеется большая группа легко растворимых миофибриллярных белков, имеющих одинаковые функциональные свойства и названные И. И. Ивановым тонической фракцией (фракция Т). Основной компонент этого комплекса – тропомиозин, от которого зависит тоническая функция матки.
Белки фракции Т в мышце небеременной матки находятся в большом количестве (70–75% белков миофибрилл). Белки тонической фракции, по-видимому, обеспечивают тонус (сопротивление растяжению) и запирательную функцию матки во время беременности; они не обладают АТФ-способностью при высокой холин-эстеразной активности (И. И. Иванов и соавт.).
Белки саркоплазмы
Саркоплазма содержит белковые комплексы, обладающие ферментативными свойствами и обеспечивающие метаболизм мышечной ткани. К белкам саркоплазмы относятся миоген, миальбумин, миоглобин.
Ферментные белки участвуют в жировом и углеводном обмене. Кроме ферментных белков, выделено более 30 соединений, которые играют роль в обменных процессах мышечной ткани. Миальбумина в гладких мышцах содержится почти в 2 раза больше, чем в скелетных. Имеются данные, что за счет миальбумина происходят пластические процессы в мышечных волокнах. Миоглобин относится к группе хромопротеидов и является дыхательным ферментом, при участии которого транспортируется кислород в случае усиленной мышечной работы.
Строминовые белки
В гладкой мускулатуре матки на долю этой фракции приходится большая часть мышечных белков. Основной представитель данной группы – коллаген. Белки стромы не принимают участия в сокращениях матки, но придают, по-видимому, ей достаточную прочность при растяжении.
До беременности среднее содержание белков актомиозинового комплекса не превышает 3–4%, саркоплазматической фракции – 25–30% и белков стромы – 50–55%. Во время беременности количество сократительного белка увеличивается – актомиозина мышцы тела матки до 6–7%, ферментных белков саркоплазмы – до 45–50% и уменьшается уровень белков стромы – до 25– 30%. Изменение содержания отдельных фракций белков происходит по мере увеличения срока беременности, достигая максимальных показателей к ее окончанию. Выявлена также закономерность и в отношении мышц нижнего сегмента и шейки матки. Содержание общего белка мышц на единицу веса ткани с наступлением беременности заметно не меняется.
Другие компоненты
Весьма важными компонентами, обеспечивающими энергетику мышечного сокращения матки, являются фосфорные соединения. С наступлением беременности их содержание в матке прогрессивно повышается. К концу беременности (40 нед) отмечается увеличение общего фосфора на 71,5%, кислоторастворимого – на 103,8% и белкового – на 16% по сравнению с состоянием вне беременности. Небольшая концентрация фосфорных соединений отмечается в теле матки (область дна), наименьшая – в нижнем сегменте.
При беременности в мышце матки накапливаются такие важные в энергетическом отношении соединения, как креатинфосфат и гликоген. Если в мышце матки небеременной женщины содержание гликогена колеблется в пределах 100–120 мг, то к концу беременности и в родах оно увеличивается в несколько раз. В случае переношенной беременности, а также при слабости родовой деятельности гликогена содержится вдвое меньше, чем при нормальных родах.
Сила маточного сокращения зависит не только от количества донаторов мышечной энергии, но также и от ферментативных систем, участвующих в превращениях данных веществ. Одним из важных и основных ферментов, принимающих участие в акте сокращения мышцы матки, является АТФ-аза актомиозина, которая обладает активностью по отношению к АТФ – главному источнику энергии мышечного сокращения. Актомиозин обладает контрактильными свойствами лишь в том случае, когда его АТФ-азная активность выражена в достаточной степени; в противном случае он теряет контрактильные свойства.
Первичная слабость или быстрая утомляемость мышцы матки в родах может находиться в прямой зависимости от активности фермента АТФ-азы актомиозина. АТФ-азная активность сократительного белка почти в 10 раз ниже соответствующей активности скелетных мышц. На ее активность оказывает большое влияние рН окружающей среды, ионный состав солей и фактор Марша – Бендала (фактор расслабления), природа которого остается пока не выясненной.
АТФ-азная активность актомиозина понижается до 23–33 нед беременности. В 40 нед беременности и особенно в родах активность фермента резко повышается. Ионы кальция увеличивают активность АТФ-азы актомиозина. В мышце матки имеется водорастворимая АТФ-аза, которая связана с митохондриями мышечных клеток и обеспечивает энергетический обмен в них. Этот фермент, по мнению некоторых исследователей, выполняет транспортные свойства и активируется ионами магния; ионы кальция подавляют активность фермента.
Н. С. Бакшеев, Е. Т. Михайленко, изучив АТФ-азную активность актомиозина в различные сроки беременности после активации его ионами кальция, показали определенную закономерность чувствительности фермента к данному препарату. До 25–26 нед беременности чувствительность фермента к активатору понижается, с 32-й до 37-й недели – повышается, к 38-й неделе снова понижается и сохраняется до 39-й недели. В конце беременности и в родах чувствительность АТФ-азы актомиозина к кальцию хлорида повышается на 43,7% по сравнению с исходным состоянием.
Наибольшая чувствительность фермента выявлена в тканях тела матки, наименьшая – в шейке матки, средняя – в перешейке (область нижнего сегмента). Эти данные до некоторой степени объясняют механизм благоприятного действия кальция, вводимого для возбуждения и стимуляции родовой деятельности.




