Электрофоретический анализ биологических препаратов
С этимологической точки зрения термин «электрофорез» следует применять для процесса смещения под действием электрического поля. Вводя в какой-либо раствор электроды электрического элемента любое вещество, обладающее положительным электрическим зарядом смещается к отрицательному полюсу, в то время как вещества с отрицательным электрическим зарядом перемещаются к положительному полюсу. Следовательно, под действием электрического поля подвергаются смещению в том или ином направлении, в зависимости от соответствующего заряда, только электролитически диссоциируемые вещества.
Перемещение под действием электрического поля не является одинаковым для всех веществ. Оно происходит быстрее или медленнее, в зависимости от электрического заряда (е) и силы (I) поля. В случае, когда си1 имеют большие значения, скорость миграции увеличивается. Наоборот, когда размеры частицы (радиуса г) увеличиваются или когда в растворе, в котором имеет место миграция увеличивается межмолекулярное трение (и), скорость перемещения понижается.
Из вышеприведенной формулы следует, что в данной среде для одной и той же силы электрического поля, скорость миграции вещества зависит от размера частиц вещества и их электрического заряда. Когда компоненты раствора отличаются достаточно дифференцированными вышеупомянутыми значениями, их можно разделить благодаря различным скоростям передвижения под действием электрического поля.
Основы электрофоретического анализа
На практике, коллоидальные вещества, электролитически диссоциирующиеся макромолекулы характеризуются достаточно различными размерами и электрическими зарядами, что дает возможность их разделения электрофоретическим путем. Это явление было отмечено еще в 1892 г. Линдером и Пиктоном. В 1899 г. Гарди описывает электрофоретическую подвижность сывороточных белков. Разработка электрофореза в качестве метода разделения белков была осуществлена однако только в 1937 г., благодаря работам Сведберга и, главным образом, его ученика Тиселиуса.
В случае белковых молекул, благодаря их амфотерным свойствам, направление смещения под влиянием электрического поля зависит от pH среды, в которой происходит миграция. Так как в щелочной среде диссоциируют карбоксиловые группы белковой молекулы, перемещение имеет место к положительному электроду. Наоборот, в кислой среде, миграция происходит к-отрицательному электроду, так как диссоциируют свободные аминовые группировки. Для известного значения pH, характерного для каждого типа белковой молекулы (изоэлектрическая точка) молекулы не перемещаются ни в том, ни в ином направлении, так как ни одна из свободных карбоксиловых или аминовых группировок не диссоциирует. С отдалением pH среды от изоэлектрической точки, увеличивается электрический заряд молекулы и, следовательно, возрастает скорость миграции В таблице XXV приводятся для лошадиной сыворотки характеристики подвергаемых электрофорезу белковых фракций.

Для известного значения pH, в постоянных условиях межмолекулярного трения, компоненты той или иной среды диссоциируют в большей или меньшей степени, в зависимости от значения изоэлектрической точки каждого из них. Следовательно, возникновение электрического поля в этой среде вызывает дифференцированную миграцию компонентов, в зависимости от их электрического заряда. Если в нижнюю часть трубки изогнутой в виде буквы U вводится коллоидный раствор, а боковые разветвления последней заполняются буферным раствором, погружение электродов элемента в оба разветвления трубки вызовет миграцию коллоидных частиц под действием возникающего электрического поля. В течение короткого промежутка времени между коллоидным раствором и надосадочным буфером появляется граница, видимая невооруженным глазом (вследствие опалесценции коллоидного раствора).
Для более точной оценки в подобных условиях скорости миграции коллоидных частиц, Сведберг и Жетте (1923) использовали трубку в виде буквы U, оснащенную специальным приспособлением для введения анализируемого раствора после наполнения трубки буферным раствором; таким образом, обе жидкости наслаивались одна на другую, не смешиваясь между собой. Применяемые электроды были неполяризируемого типа, конструкции Михаэлиса (цинковые стержни в насыщенном растворе сернокислого цинка). Боковые разветвления трубки в виде буквы были достаточно длинными, так что между границами и электродами имелось достаточное расстояние, не допускающее диффузию веществ находящихся в сосудах-электродах до границ. Наблюдение за миграцией этих границ, когда они были невидимыми, производилось посредством ультрафиолетового облучения и регистрации флуоресценции перемещающегося слоя коллоидных частиц. Вся аппаратура помещается в термостат, чем обеспечит снижение нарушения границ.
Тиселиус усовершенствовал оптическую систему наблюдения границ, использовав для этой цели регистрирующий микрофотометр, периодически фотографирующий разветвление трубки, в котором происходит миграция (ультрафиолетовый свет 3000 А). Трубка изготовляется из кремнезема для того, чтобы избежать абсорбцию в ультрафиолетовом спектре. На каждом снимке измеряется площадь, представляющая абсорбцию ультрафиолетовых лучей (а) и уровень границы (п). Отсчитывая значения а на абсциссе и значения на ординате, можно построить кривую отражающую миграцию в данных условиях (рис. 14). Если в подвергаемом электрофорезу растворе присутствуют несколько компонентов с различными скоростями миграции, тогда им будет соответствовать определенное число границ, а характерная кривая примет форму показанную на рис. 15.

Рис. 14. Характерная кривая кривая препарата с одним компонентом, подвергнутого электрофорезу
Рис. 15. Характерная кривая препарата с одним компонентом, трехкомпонентного препарата, подвергнутым электрофорезу.
Последующие исследования Тиселиуса привели к весьма существенным усовершенствованиям, обеспечивающим высокую точность электрофоретического анализа.
Трубка в виде U (рис. 16) имеет прямоугольное сечение (световые лучи проходят в трубке через прямоугольник наибольшего размера) и помещена в термостате при 4°С, что обеспечивает устранение нарушений возникающих на границах за счет конвекционных токов. Для охлаждения Родионов 8 рекомендует использование медного змеевика, через который пропускают 50%-ный раствор этанола, увлекаемый с помощью насоса автоматического действия.
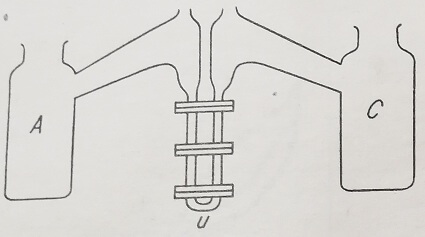
Рис. 16. Трубка в виде U и применяемые для электрофореза электроды
Разрезая трубку в виде U на трех различных уровнях, ее можно разбирать на четыре различные части, присоединяемые одна к другой с помощью абсолютно плоских стеклянных пластин. Посредством бокового скольжения этих стеклянных плоскостей, можно изолировать фракцию подвергаемой электрофорезу жидкости, которая в известный момент миграции находится в соответствующем отрезке. Вместе с тем, система скользящих отрезков может быть использована для накладывания вводимых в трубку жидкостей, не вызывая, однако, смешение анализируемой жидкости с надосадочной буферной системой.
Кроме того, до проведения электрофореза анализируемая жидкость диализируется в течение 48 часов, против применяемого буфера, для того, чтобы обеспечить выравнивание ионных сил в обоих растворах.
Обратимые электроды А и С содержат смесь серебра и хлористого серебра в присутствии насыщенного раствора хлористого калия. На эти электроды накладывают таким образом подобранную электродвижущую силу, которая может вызвать наиболее быстрое и возможное перемещение, интенсивность должна не превышать пределы, вызывающие более высокое выделение тепла, чем то, которое может выдержать прибор (обычно применяется ток на 250 в и 20 а). Этот режим должен препятствовать появлению конвекционных токов, а также диффузии на уровне электродов.
Оптическая регистрирующая система дает возможность произвести точную оценку смещения границ, благодаря применению метода полос (Schlieren methode) Теплера и рефрактометрического метода Ламма.
Метод Теплера основан на явлении изменения направления светового луча, когда он проходит через среду с неравномерным коэффициентом преломления. В подобных средах световой луч претерпевает изгиб по направлению к зоне с более высокими коэффициентами преломления. Применение этого принципа в электрофоретическом методе является возможным благодаря тому, что на уровне известной границы коэффициенты преломления содержимого трубки в виде TJ различаются. Вследствие это горизонтальный световой пучок, пересекающий трубку на уровне отклоняется вниз коллоидным слоем, с более высоким коэффициентом преломления. Если из светового пучка, проходящего через трубку в виде U можно удалить все лучи перетерпевшие подобные отклонения, то уровни границ будут иметь форму темных полос на белом фоне. Приспособление использованное для этой цели Тиселиусом показано схематически на рис. 17, где источник лучей S освещает щель Е через конденсирующую линзу А. Затем световые лучи концентрируются линзой Дольмаера D, в F, где получается изображение щели Е. Если после линзы D вводится трубка в виде U, то поскольку лучи пересекающие ее на уровне границ отклонены, они уже не дойдут до F, а будут находиться несколько ниже. Размещая экран L под F, этот последний задерживает все отклоненные лучи (представляющие границы) таким образом, что фотографическая пластинка Р уже не получит их изображение, а уровень границ будет иметь вид черных полос.
Рис. 17. Схема приспособления с полосами
Для непосредственного измерения концентрации каждого компонента в коллоидном растворе, подвергаемом действию электрического поля, применяется шкальный рефрактометрический метод (Skalemethode). Этот метод, разработанный Ламмом, основан подобно методу полос, на свойстве областей отделяющих зоны с различными коэффициентами преломления, отклонять проникающие лучи света. Приспособление необходимое для применения шкального метода состоит из стеклянной пластинки, на которой на одинаковом расстоянии наносится ряд поперечных линий. Стекло монтируется около бокового разветвления трубки в виде U, где имеет место миграция. Излучаемый источником свет проходит как через пластинку, так и через реакционную трубку. Соответственно вышеприведенному принципу, если в подвергающейся электрофорезу жидкости наблюдается наличие границы, то на уровне последней поперечные полосы претерпевают смещения соответствующие типу показанных на рис. 18.

Рис. 18. Наблюдение границ с помощью метода поперечных полос. Слева (А) шкала, рассматриваемая через гомогенную жидкость; справа (В) шкала, рассматриваемая через жидкость с границей.
Шкальный метод применяется для быстродействующих приборов, отличающихся несложной манипуляцией (типа Керн-Аарау).
Для расчета концентрации каждого отдельного компонента изображение границ, полученное посредством рефрактометрического шкального метода проектируется на миллиметрической бумаге, причем на уровне каждой белой полосы проводят по одной вертикальной линии. Их высота увеличивается на постоянную величину, и таким образом вторая вертикальная линия дважды больше первой, третья – трижды больше, четвертая – в четыре раза больше и т.д. Соединяя эти вертикальные линии, получается кривая с несколькими максимумами (рис. 19). Каждый максимум представляет собой отдельную коллоидную фракцию, изолированную электрофоретическим путем. С помощью планиметра можно измерить площадь соответствующую каждой кривой и относя ее к общей площади ограниченной кривой и осями координат (абсцисса и ордината), получается в процентах количество каждой фракции.

Рис. 19. Электрофореграмма (Керн-Аарау).
Лонгсворт разработал вариант этого метода, дающий возможность непосредственно получить общие графики всех фракций электрофоретического разделения коллоидного раствора. Как уже было описано выше расположение экрана в оптическом приспособлении обеспечивает задержание отклоненных границами лучей; если этот экран постепенно перемещается, то лучи). Применив этот способ Лонгсворт зарегистрировал описанное явление на ряде серийных фотоснимков, одновременно с прогрессивным подъемом горизонтального экрана. Первые снимки указывают только на присутствие границ с большим градиентом, в то время как последние указывают также и на наиболее размытые границы. Вместе с тем, применяя очень узкую вертикальную щель, которая допускает облучение только незначительного участка фотографической пластинки, посредством равномерного перемещения пластинки одновременно с подъемом экрана, на одной и той же пластинке можно получить общие графики, в виде представленных на рисунке 20.

Рис. 20. Электрофоретические диаграммы построенные посредством метода Лонгсфордта. А - противостолбнячная имунная сыворотка; С - противопневмококковая имунная сыворотка
Подготовка материала для электрофоретического анализа
Растворы подвергаемые электрофоретическому анализу могут быть нативными (сыворотка, плазма и др). Часто, они состоят из препаратов предварительно подвергнутых ряду операций с целью концентрирования анализируемых продуктов. Подвергаемый электрофорезу раствор не должен быть слишком концентрированным. В основном предпочтительно, чтобы каждый компонент имел концентрацию менее 0,5%.
Независимо от происхождения препарата, до проведения электрофореза, необходимо осуществить ионное равновесие между препаратом и буферным раствором, осуществляющим связь с электродами. Эта операция проводится диализируя препарат (10–15 мл), против буферного раствора (2 литра).
Диализ производится на холоду (+ 4°С) во избежание заряжения продукта. Необходимое для диализа время зависит от периода требуемого для установления ионного равновесия между обоими растворами, таким образом, чтобы разница в электропроводимости (на мосту Кольрауша) между ними не превышала 1–2%. Обычно процесс осуществляется в течение 36–48 часов; если буферный раствор подвергается непрерывному перемешиванию, время можно сократить до 12 часов.
После диализа анализируемый раствор вводится в трубку в виде U, а сверху – соответственно манипуляциям указанным для каждого типа прибора – добавляется необходимое количество буферного раствора, послужившего для диализа.
Используемый для диализа буферный раствор должен отличаться определенной характеристикой значения pH, а также ионной силы, различающейся в зависимости от раствора.
Ионная сила равна половине суммы молярных эквивалентов ионов, находящихся в данном растворе. Предположим, используют ионный раствор монокалиевого фосфата 0,2 м.; его ионная сила равна молярным эквивалентам ионов.
Обычно используются буферные растворы, ионная сила которые равна 0,1; это значение обусловлено, однако, концентрацией анализируй моно раствора, используя буферы с небольшой ионной силой (0,05) больших концентраций коллоидов и буферы с большой ионной силой (0,2) для малых концентраций коллоидов.
Концентрация ионов водорода в буфере колеблется в широких пределах, в зависимости от выделяемого из препарата компонента. Так, например, для электрофореза плазмы используются буферные растворы с подходящим значением pH (7,35). В этих условиях глобулиновая фракция ах не видима на хроматограмме. При pH 7,7 она появляется в виде небольшой петли на кривой. При pH 8,6 глобулиновая фракция четко отделяется от альбуминовой.
Разумеется, что состав буферных растворов изменяется в зависимости от pH. Наиболее часто применяемые буферные растворы приготовляются на основе диэтилбарбитуровой кислоты. Например:
- 20,62 г. диэтилбарбитурата натрия и 3,68 г диэтилбарбитуровой кислоты на 1 000 мл дистиллированной воды (буферный раствор Лонг-суорта);
- 29,428 г диэтилбарбитурата натрия и 19,428 г ацетата натрия на 1 000 мл бидистиллированной воды. Из этого раствора берут 10 мл и добавляют 4 мл 8,5% раствора NaCl. Для получения желаемого значения pH добавляют НС1 0,1 н. (буферный раствор Михаэлиса);
- 446 мл 0,015 м. раствора диэтилбарбитуровой кислоты + 25 мл 0,5 м. раствора диэтилбарбитурата натрия + 175 мл 0,5 м. раствора хлористого натрия + дистиллированной воды до 1 000 мл (буфер pH 8,6 – и. с. = 0,1);
- 448 мл 0,015 м. раствора диэтилбарбитуровой кислоты + 100 мл 0,5 м. раствора диэтилбарбитурата натрия -J- 100 мл раствора хлористого натрия 0,5 м. + дистиллированной воды до 1 000 мл (буфер pH 9,2 – и. с. = 0,1).
В зависимости от области pH, в которой производится, операция можно использовать и другие буферные растворы, состав которых приводится в главе I настоящей работы.
Использование электрофоретических приборов зависит от соответствующей конструкции. Поэтому нет смысла описывать его в настоящей главе. Для этой цели целесообразно изучить «способ применения», сопровождающий каждый прибор.
Однако, в общих чертах, независимо от типа используемого прибора, работа состоит в следующих операциях:
- приготовление анализируемого препарата и соответствующего буферного раствора;
- диализ препарата в буферном растворе;
- перенос диализата в трубку для электрофореза;
- добавление буферного раствора;
- установка электродов;
- помещение всей системы в камеру термостата для достижения термического равновесия;
- установление исходных границ;
- определение подходящего электрического поля;
- периодическая запись уровня границ;
- расчет и обсуждение полученных результатов.
Скоростной электрофорез на колонке жидкости в настоящее время производится с помощью так называемых «микроприборов» (типа «ElectrophoresegerSt 35» Иена, ГДР). Подобного рода приборы дают возможность произвести микроэлектрофорез типа Тиселиуса, представляющий следующие преимущества:
- уменьшение количества продукта необходимого для образца (0,1-0,3 мл);
- сокращение времени диализа (1 час при + 4°С);
- повышение производительности прибора посредством сокращения продолжительности одного исследования (40 мин).
На этих приборах кривая, которой пользуются для наблюдения и измерения, полученная методом полос, может быть записана одновременно (на той же фотографической пленке) с интерферометрическим фоном типа Райлей. Таким образом градиентная кривая (Шлирен) служит только для ограничения фракции, в то время как относительную концентрацию каждой фракции можно оценить на основании сдвига интерференционных полос. Таким образом можно подсчитать и обсудить результаты в течение лишь нескольких минут.
Электрофорез на бумаге
Метод электрофореза на колонке жидкости по способу Тиселиуса характеризуется довольно ограниченными возможностями применения в связи с рядом возникающих затруднений, а именно:
- высокая стоимость аппаратуры;
- низкая производительность (каждый прибор типа Тиселиус дает возможность исследовать не более трех препаратов в день);
- тонкие и продолжительные манипуляции;
- необходимость использования значительных количеств препаратов;
- значительное замедление работы вследствие предварительных операций, связанных с диализом (Машбеф).
Несмотря на то, что электрофорез на бумаге не отличается столь высокой точностью как анализ проводимый на колонке жидкостей, он имеет то преимущество, что снижает до минимума вышеприведенные затруднения. Так, например, стоимость аппаратуры невелика. Производительность значительно больше, причем одновременно на одной и той же полосе бумаги можно производить несколько (3–5) анализов (благодаря чему получаются весьма ценные сопоставимые данные, поскольку условия работы идентичны для всех одновременно анализируемых образцов). Вместе с тем предварительный диализ отпадает. Количества используемых для анализа препаратов весьма малы (например 0,2 мл кровяной сыворотки), благодаря чему электрофорез на бумаге может считаться микроопределением. И, наконец, необходимые манипуляции не отличаются какой-либо сложностью, так что нет необходимости в особой технической подготовке.
Имея в виду, что при электрофорезе на бумаге, смещение производится не только электрическим зарядом, носимым соответствующими частицами, но и увлечением исследуемых компонентов осмотическим путем через поры бумаги, вместе с водой, этим, методом нельзя установить изоэлектрическую точку вещества.
Принцип электрофоретического метода на бумаге состоит в нанесении одной капли анализируемого раствора на полосу фильтровальной бумаги пропитывании этой последней соответствующим буферным раствором и приложением разницы электрического потенциала между обоими концами бумаги. Под действием возникающего электрического поля, компоненты анализируемого раствора мигрируют с соответствующими скоростями, к одному из концов фильтровальной бумаги. Идентификация дифференцированных фракций производится затем смачивая бумагу в кювете, содержащей соответствующий краситель. Как и в случае хроматографии на бумаге, Интенсивность образующихся пятен определяется либо непосредственно, либо путем элюции красителя с последующим фотометрированием.
Фильтровальная бумага, используемая для электрофореза должна быть тщательно выбрана. Обычно рекомендуется произведение предварительных ориентировочных испытаний для идентификации бумаги с соответствующей пористостью и в то же время достаточно гомогенной. Во время операций бумагу не следует брать руками или трогать ее различными предметами, для того, чтобы избежать запятнения (жирные вещества, коллоидные примеси, электролиты и др.). Ватманская бумага № 2 соответствует лучше всего для проведения электрофореза на бумаге.
Можно использовать бумажные полосы различной ширины. Полосы 6 см ширины допускают одновременное орошение 5 образцов. Для этой цели черным, мягким, хорошо отточенным карандашом проводятся шесть продольных линий, разграничивающих пять дорожек 1 см ширины, W краям существует дорожка в 0,5 см. Посередине фильтровальной бумаги, длина которой зависит от конструкции прибора, равняясь в среднем 30 см – наносится поперечная линия, отмечающая исходный пункт образцов.
Разграниченные на фильтровальной бумаге пять дорожек могут быть использованы для электрофореза пяти различных образцов. По необходимости, некоторые образцы можно заменить контрольными образцами.
Анализируемые образцы наносятся на уровне, указанном средней поперечной линией с помощью микропипетки. Количество наносимого образца должно содержать от 0,02 до 0,1 мг изучаемого компонента L с другой стороны капля с исследуемым образцом должна быть достаточно малой, для того, чтобы не выходить из пределов соответствующей дорожки. Поэтому, если раствор-образец содержит слишком малую концентрацию исследуемого продукта, рекомендуется концентрирование (диализ под давлением).
Капли образца должны наноситься только в момент начала опыта так как – особенно, когда исследуемый раствор содержит белки.
Буферные растворы, используемые при электрофорезе на бумаге в основном те же, что и применяемые при классическом электрофорезе с той разницей, что ионная сила растворов должна быть значительно меньшей (0,025–0,075). Буферные растворы с большой ионной силой (более 0,1) ведут к выделению значительного количества тепла, главным образом, когда рабочее напряжение относительно понижено. Это относительно большое количество выделяемого тепла, ведет к испарению жидкости пропитывающей бумажную полосу, и, следовательно, к местному концентрированию электролитов с последующими нарушениями смещения.
Для разделения сывороточных глобулинов рекомендуется использование буферных растворов, приготовленных на основе бората или веронала, со значением pH более 8. Такого рода растворы можно приготовить следующим образом:
- в одном литре бидистиллированной воды растворяют 4,4 г бората натрия и 2,325 г борной кислоты. pH раствора = 8,6 и ионная сила 0,025;
- в одном литре бидистиллированной воды растворяют 0,42 г диэтилбарбитуровой кислоты и 5,15 г диэтилбарбитурата. Получаемый раствор имеет значение pH 8,6 и ионную силу 0,025;
- в одном литре бидистиллированной воды растворяют 1,84 г диэтилбарбитуровой кислоты и 10,3 г диэтилбарбитурата. Полученный раствор характеризуется значением pH 8,6 и ионной силой 0,05;
- в одном литре бидистиллированной воды растворяют 2,74 г диэтилбарбитуровой кислоты и 15,45 г диэтилбарбитурата. Получаемый раствор отличается значением pH 8,6 и ионной силой 0,075.
Для электрофореза пириновых и пиримидиновых оснований рекомендуется использование кислых буферов (уксусная кислота 0,2 м.) Для аминокислот также используются буферы с кислотным значением pH (буфер фталат, pH 5 – 5,5). Для глюцидов, боратный буфер (Кларк), при pH 10 употребляется наиболее часто.
Приборы для проведения электрофореза на бумаге состоят из кювет для электрофореза, стабилизатора тока и электродов (Баландин и Розенберг).
Обычно кюветы для электрофореза изготовляются из стекла или пластмасс, отличаясь разнообразными формами (рис. 21) соответствующими использованному методу. Чаще всего эти кюветы закрываются, образуя таким образом закрытое пространство с насыщенной парами атмосферой, что препятствует испарению жидкости.
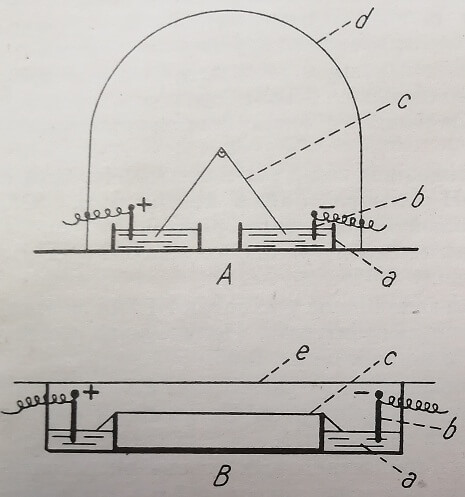
Рис. 21. Приспособление для электрофореза на бумаге. А — подвешенная бумага; В — растянутая бумага (а — кристаллизатор с буферным раствором; b — электрод; с — полоса фильтровальной бумаги; d — стеклянный колпак; е — стеклянная или пластмассовая камера).
Стабилизатор тока обычно представлен выпрямителем (с переменного тока на постоянный), к которому приспособляется собственно стабилизатор. Напряжение тока, который должен обеспечить прибор, должно быть изменяемым (между 0 и 500 в). Необходимо располагать возможностью измерения напряжения до делений в 5 в, а силы тока – до 0,5 мА.
В отношении электродов предпочтение отдается металлическим электродам и главным образом платиновым. Кроме того можно пользоваться также электродами из ретортного угля. Применение электродов с электролитными растворами, типа применяемых при классическом электрофорезе, нецелесообразно.
Проявление подвергаемых электрофорезу образцов выполняется с помощью красителей специфичных типу анализируемых веществ.
При этом для аминокислот можно использовать 0,2–0,5% хлороформовый раствор нингидрина, которыйна холоде в контакте с аминокислотами дает яркую сине-фиолетовую окраску. Глюциды можно идентифицировать реактивами, применяемыми для восстанавливающих группировок (см. часть III). Реактив с азотнокислым серебром (см. там же) используется для выявления пятен, образуемых пуриновыми и пиримидиновыми основаниями.
Следует однако отметить, что метод электрофореза на бумаге обычно применим только в случае белковых растворов, так как для компонентов с малой молекулой (аминокислоты, пуриновые, пиримидиновые основания и др.) хроматографическая техника отличается преимуществом быстроты и в некоторой мере она является более точной.
Для белковых растворов одним из проявителей используемых с удовлетворительными результатами,
является смесь состоящая из бромфенола синего (0,1 г), ледяной уксусной кислоты (50 мл) и хлорной ртути (50 г) в воде (до 1 литра). Содержащаяся в этом реактиве ртуть вызывает необратимую нерастворимость белков, фиксируя их на том месте, в котором они мигрировали. Бромфенол синий (тетрабромфенолсульфонфталеин) дает с белками в кислой среде синюю окраску, вступая в реакцию с диссоциированными аминовыми группировками. Вместо хлорной ртути, фиксация белков может быть осуществлена и при помощи сернокислого цинка. Реактив содержит в одном литре воды: 50 г сернокислого цинка, 0,1 г бромфенола синего и 50 мл ледяной уксусной кислоты. Вместо бромфенола синего могут быть использованы и другие индикаторы, например азокармин В (розиндулинтрисульфонат калия или натрия) или амидошварц.
В этом последнем случае используется насыщенный раствор спирте, содержащий 10% ледяной уксусной кислоты.
Пецольд и Пейзер исследуя чувствительность этих трех красителей (бромфенол синий, азокармин В и амидошварц 10 В) по отношению к сывороточным белкам, подвергаемым электрофорезу на бумаге, установили наличие разницы от 1,1% (для бромфенола синего) до 1,8% (для азокармина В) между количеством белка, выявляемого этими проявителями и теоретически подсчитанным количеством белка.
На основании аналогичных исследований предполагается, что наиболее подходящим для проявления является бромфенол синий, особенно потому, что в случае элюции для фотометрической дозировки оценка появляющейся синей окраски довольно легка. Однако, преимущество амидошварца 10 В состоит в получении равномерно окрашенных пятен, которые легко оценить фотометрическим путем за счет прозрачности.
Последовательность операций при электрофоретическом анализе на бумаге. После того как анализируемый белковый раствор был приготовлен соответствующим образом (минимальная концентрация каждой фракции 0,02 мг/мл) на фильтровальной бумаге, соответственным образом разрезанной и разлинованной, наносится количество 0,025 мл образца на центральную поперечную линию.
Буферный раствор с установленными значениями pH и ионнной силы вливается в соответствующие кристаллизаторы (рис. 21 а), причем в обоих сосудах с помощью сифона (стеклянного или резинового) устанавливается одинаковый уровень. До полного высыхания взятого образца полоса фильтровальной бумаги кладется на свое место (рис. 21 с) и оставляется для пропитки буферным раствором. Камера для электрофореза тотчас же закрывается, а зажимы электродов фиксируются на выпрямителе-стабилизаторе тока. Подключается к электрической сети, обеспечивающей исходный ток 0, 5 ма для каждого 1 см ширины фильтровальной бумаги; спустя 3–4 часа силу тока можно увеличить.
В течение всего опыта прибор должен находиться в комнате с постоянной температурой (20–25°С).
Продолжительность электрофореза необходимо установить предварительно, в зависимости от условий работы, причем следует учесть: ионные силы буфера, силу электрического тока, тип фильтровальной бумаги, ее длину, рабочую температуру и удельный вес компонентов в образце. Так, например, для выделения белковых фракций из сыворотки, если используется ватманская бумага № 2, размером 6 х 30 см, буфер веронал pH 8–6 с ионной силой 0,05 и подается ток 110 в и 2,9 ма., электрофорез завершается в течение 18 часов.
К концу установленного периода электрический ток выключается, полоса фильтровальной бумаги вынимается (используя для этой цепи чистый пинцет), причем бумага во влажном состоянии переносится в кювету с реактивом обеспечивающим фиксацию и проявление. Бумага оставляется в этом реактиве достаточное количество времени (12 часов), затем трижды промывается по 5 или 10 минут в кюветах с ледяной уксусной кислотой 2% и, наконец, ее вводят на 15 минут в водный раствор ацетата натоия 1 ° и уксусной кислоты 2%.Если для проявления используется амидошварц 10 В, промывая должны быть значительно более продолжительными.
В этих условиях нефиксированный краситель на белковых пятнах элюируется, а проявленная протеинограмма может быть высушена посредством вентиляции или в сушильном шкафу при 80°С.
Если подвергаемый электрофорезу образец содержит только один компонент, то этот последний проявляется в виде круглого окрашенного в синий цвет пятна (бромфенол синий), ярко красного (азокармин) или черного пятна (амидошварц).
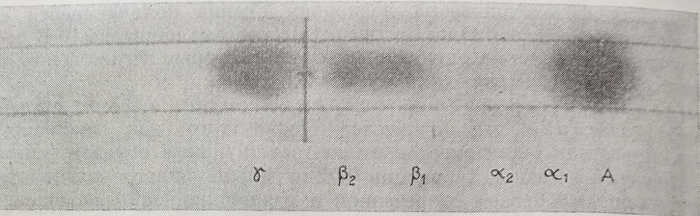
В случае нормальной человеческой кровяной сыворотки (рис. 22) наблюдаются шесть различающихся между собой пятен. Пятно А, яркое, расположенное на наибольшем расстоянии от точки, на которой был нанесен образец (поперечная линия), быстро мигрируя по направлению положительного электрода, соответствует белкам. Рядом с этим пятном, покрывая его в значительной мере, располагается трудно наблюдающееся шггао, соответствующее aj-глобулинам. Пятно а2-глобулинов, не ярко окрашенное, наблюдается однако без затруднений, вследствие того, что оно хорошо очерчено и Р2-глобулины расположены вблизи исходной линия, причем их миграция незначительна и, наконец, на другой стороне исходной линии, по направлению к отрицательному электроду (рис. 22) наблюдается большое пятно у-глобулинов. Смещение глобулинов в обратном направлении не является следствием наличия положительного электрического заряда в подобных условиях (буфер-веронал, pH 8,6), но скорость их миграции в электрофоретическом поле весьма незначительна, так что они практически не увлекаются.
Рис. 22. Электрофорез на бумаге нормальной сыворотки.
Электроосмос жидкости пропитывающей фильтровальную бумагу вызывает, однако, смещение этой фракции по направлению к отрицательному полюсу, причем в конечном итоге пятно у-глобулинов наблюдается в том же положении, которое можно заметить на рис. 22.
Микроопределение подвергаемых электрофорезу белковых фракций
Для прямой фотометрии необходимо провести предварительную обработку фильтровальной бумаги, обеспечивающей гомогенный коэффициент преломления (диафанизация).
Этого можно достигнуть пропитывая проявленную электрофоре грамму смесью состоящей из двух частей ос-бромнафталена и одной части парафинового масла. Для этой цели две микроскопические стеклянные пластинки смазываются вышеупомянутой смесью, а затем между ними, избегая образования воздушных пузырьков, вводится полоса фильтровальной бумаги.
После достижения прозрачности фильтровальной бумаги, эта последняя (L)передвигается перед источником света S (рис. 23), излучение которого падает на фотоэлемент. Яркость светового потока, получаемого в Р изменяется в зависимости от интенсивности грамме. Изменение яркости светового потока регистрируется гальванометром G. Передвигая пластинки с электрофореграммой таким образом, чтобы световой поток по очереди проходил через каждую точку, расположенную на ее срединой линии, и одновременно записывая колебания стрелки гальванометра, можно получить протеинограмму соответствующую указанной на рис. 24.

Рис. 23. Принцип прямой фотометрии. S – источник света; Р – фотоэлемент; G – гальванометр; L – диафанизированная электрофореграмма, расположенная между двумя пластинками.

Рис. 24. Характеристическая кривая фотометрически определенной электрофореграммы (у — изменение светового потока, х — расстояния в мм от исходной точки электрофореза)
Довольно удобное фотометрическое устройство для анализа проявленной электрофореграммы можно получить заменяя окуляр обычного микроскопа фотоэлементом, подключенным к гальванометру. В этих условиях можно работать с объективом 40 или 8, производя соответствующее диафрагмирование. Кроме того рекомендуется использование со значением около 6000 А (для бромфенола 5 400 А (для азокармина).
Предпочтительно, чтобы используемый фотометр был предварительно подвергнут калибровке, проводимой при помощи электрофореграммы с известными количествами белка.
Применение метода прямого фотометрирования дает весьма значительные погрешности, которые могут достигнуть 30%. Для снижения погрешностей, в случае электрофоретического микроопределения методом прямого фотометрирования, рекомендуется производить проявление с применением амидошварца, дающего равномерно окрашенные черные пятна.
Колориметрия после элюции является более точным методом по сравнению с прямой фотометрией. Так, в оптимальных условиях работы погрешности могут быть снижены до менее 5%.
В зависимости от момента элюции количественная оценка разделенных электрофорезом фракций может производиться двумя способами: колориметрирование элюата после проявления и 2) колориметрирование элюата до проявления.
1) Для колориметрирования после проявления в качестве проявителя используют бромфенол синий, элюирующийся в удовлетворительных условиях и обеспечивающий синий, легко фотометрируемый цвет. После проявления и промывания электрофореграммы этим проявителем пятна вырезываются (каждое в отдельности, или если это не представляется возможным то по несколько вместе) и вводится некоторое количество элюанта(7–10мл).
Элюант приготовляют растворяя 10 г карбоната натрия для анализа в 100 мл бидистиллированной воды. После растворения, непрерывно перемешивая, постепенно добавляют 100 мл метанола.
Раствор элюанта и кусочек бумаги, содержащий пятно, вводятся в колбу Эрленмейера на 50 мл с притертой пробкой. Колба закупоривается и оставляется на 3–6 часов, при частом перемешивании.
В конечном итоге элюат фильтруется для удаления возможных увлеченных бумагой примесей и фотоколориметрируется с фильтром X – 5 900А. В случае использования фотометра Пульфриха используются кюветы на 1 или 2 см и фильтр S 60.
Параллельно, с помощью куска бумаги взятого из электрофореграммы приготовляют контрольный образец, на котором в результате проявления наличие пятен не было выявлено. Этот контрольный образец дает возможность корректировать недостаточно отмытые количества проявителя.
2) Колориметрирование, проводимое на элюате полученной до проявления, дает возможность получить более точные результаты, чем те, которые дает способ колориметрирования пятен.
Для применения этого метода, на той же полосе фильтровальной бумаги необходимо произвести электрофорез по меньшей мере двух образцов, миграционные дорожки которых должны быть предварительно намечены карандашом. По окончании электрофореза одна из дорожек отрезается и подвергается проявлению. Не проявленные дорожки используются впоследствии для определения различных фракций, уровень миграции которых устанавливается с помощью проявленного контрольного образца. После определения уровня фракций, фильтровальная бумага помещается в соответствующем месте и подвергается элюции в колбе.
В качестве элюанта в каждую колбу Эрелнмейера вливают сначала по 2 мл NaOH 0,2 н. Закупоривают и оставляют на 1 час. После этого добавляют еще 1,5 мл медно-винного реактива, содержащего на 100 мл 4%-ый раствор карбоната натрия, 5 мл 2%-го раствора тартрата натрия и 5 мл 1%-го раствора сульфата меди. Флаконы закупориваются, встряхиваются и оставляются еще на 1/2 часа. После этого в каждую колбу для элюции приливают по 0,5 мл реактива Фолин-Чокэлтэу взбалтывают, причем после 30 минут получаемая окраска может быть оценена колориметрическим способом.
Одновременно с образцами элюируется и подвергается такой же обработке (гидрат, медно-винный реактив и реактив Фолин-Чокалтэу) кусок фильтровальной бумаги, подвергнутой электрофорезу, на которой не было выявлено наличие пятен. Этот контрольный образец служит для колориметрической коррекции реактивов.
Фотоколориметрирование производится посредством фильтров, соответствующих 7 500 А. Полученные результаты сопоставляются с приготовленными эталонами, исходя из белковых растворов с известным титром.
Метод Ганзен-Машебеф для получения выделенных электрофорезом белковых фракций
Электрофоретически выделенные белковые фракции, элюированные в вышеуказанных условиях, могут быть использованы для их количественной оценки. Если необходимо их получить в ненарушенном состоянии, элюционные методы необходимо изменить, используя подходящий элюант в отношении pH и ионной силы. Кроме того, необходимо достигнуть достаточно малой скорости элюции для того, чтобы все количество белков можно было растворить в небольшом объеме растворителя.
Для этой цели Ганзен и Машбеф предлагают в качестве элюанта раствор следующего состава:
NaCl
NaHCOg 0,5 г
Дистиллированная вода до 1 000 мл
Значение pH этого раствора должно соответствовать 8,65. Этот раствор обеспечивает получение белков с ненарушенными биологическими свойствами.
Что касается элюционной техники прибегают к использованию системы аналогичной хроматографии. Элюант вводится в размещенную на подставке кювету. Под кювету на штативе ставится пробирка, в которую должен быть собран элюат. Пробирка оснащена воронкой, на которую кладут подвергаемый элюции кусочек фильтровальной бумаги. Связь между кюветом с элюантом и воронкой, содержащей подвергаемый элюции материал, осуществляется посредством полосы чистой фильтровальной бумаги.
Эта полоса пропитывается элюирующим раствором (так же как и в процессе нисходящей хроматографии). Когда полоса фильтровальной бумага полностыо пропитана, раствор достигает уровня препарата, подвергаем элюции в воронке, пропитывая его и затем увлекая элюированный материал через воронку в пробирку.
Так же как и при хроматографии, вся система вводится в хорошо закрытую камеру подходящих размеров.
Таким образом, возникающие пары остаются в камере, обеспечивая необходимую влажность для орошения.
Рекомендуется, чтобы процесс происходил при температуре менее 15°с так как это способствует сохранению целостности элюированной белковой фракции.
Подвергаемый элюции материал получается путем вырезывания проявленной электрофореграммы, после определения уровня анализируемой фракции с помощью проявленного контрольного образца.
Весьма важно, чтобы до начала элюции, кусочек бумаги, содержащий выделенные фракции не высох, чтобы не допустить разрушение белка. Этого можно достигнуть, сохраняя электрофореграмму на холоду под колпаком, в котором поддерживают влажную атмосферу.
После того, как в пробирке собралось около 2 мл орошающего раствора, можно считать, что элюция окончена. Промежуток времени, необходимый для выполнения этой операции в описанных условиях, колеблется от 6 до 10 часов, в зависимости от высоты содержащей элюант кюветы.
С помощью этого метода после выделения электрофоретическим способом белковые фракции могут быть получены в ненарушенном биологическом состоянии. Так, например, если в этих условиях выделяется у-глобулиновая фракция имунной сыворотки, отмечается что вся специфическая активность полностью сохранилась.
Электрофорез в геле
Для определенных опытов (осаждение антиген-антитело, протеолиз и др.) предпочтительно проводить электрофорез белкового раствора в геле вместо фильтровальной бумаги.
Принцип метода и последовательность операции остаются неизменными. Предпочтительно в качестве геля используется 2–3% раствор агара. Из этого раствора, подогретого (50–60°С) на стеклянную пластинку или пластмассовую полосу наносится слой в 2–3 мм. После охлаждения, препарат оставляют в течение 12 часов в дистиллированной воде, а затем еще на 12 часов в используемом для электрофореза буферном растворе, для удаления примесных электролитов из агара.
Затем пластинка с нанесенным слоем агара используется для электрофореза исследуемого материала. Для этого небольшой кусочек (X 5 мм) фильтровальной бумаги пропитывается анализируемым белковым растворов и наносится в поперечном направлении на середину слоя агара (манипуляция производится посредством чистого пинцета). Затем пластинка с агаром кладется между двумя полосами фильтровальной бумаги и размещается в приборе для электрофореза.
Последующие операции производятся так же как и в случае электрофореза на бумаге, лишь с тем различием, что до проявления рекомендуется фиксация и осветление препарата.
В качестве фиксаторов применяются различные растворы: а) для белков – 2%-й раствор ледяной уксусной кислоты в 70% этаноле. Фиксация продолжается 1 час; б) для липидов – водный раствор, содержащий на 1 литр: 20 мл ледяной уксусной кислоты, 20 мл 10% изотонического раствора поваренной соли и 500 мл этилового спирта. И в данном случае фиксация продолжается 1 час.
Для осветления слой агара покрывается фильтровальной бумагой, впитывающей электролиты вместе с водой. В случае необходимости фильтровальную бумагу меняют до высушивания слоя агара. Затем вводят несколько раз 2% раствор ледяной уксусной кислоты и снова сушат или переводят в кювету с красителем.
Красители применяемые для электрофореза в геле не отличаются от используемых при электрофорезе на бумаге. В качестве реактива применяется амидошварц, кармин или бромофенол синий в присутствии фиксаторов (хлорная ртуть или 5% сульфат цинка).
Для окраски белков применяется бромофенолсиний, азокармин, амидошварц и др.
Для окраски липидов пластинку с агаром оставляют в течение 6 часов в насыщенном спиртном растворе Судана черного. Помимо этого используется также насыщенный раствор Судана красного в 6% растворе этанола или насыщенный раствор Ойль Ред в 70% этаноле. После окрашивания пластинки промываются в 50% спирте. В случае кровяной сыворотки красители для липопротеинов дают пятна в зоне глобулинов (соответственно сывороточному холестеролу и фосфолипидам), а также в участке между P-и у-глобулинами (соответственно липопротеинами как таковыми).
Можно прибегнуть также к одновременным окраскам (как для белков, так и для липидов), используя для этой цели смеси, состоящие из Судана черного и азокармина, Оиль Ред и бромфенола синего и др.
Для гликопротеинов пластинка с гелем выдерживается в течение 10 минут в кювете с перйодатом, промывается дистиллированной водой, затем переводится в реактив Шиффа на 10–20 минут. К концу рекомендуется проведение обесцвечивания бисульфитом натрия и промывание ацето-уксусным раствором.
Периодат приготовляют (свежий) растворяя 1 г периодата натрия в 100 мл бидистиллированной воды, к которой добавляют 1 мл азотной кислоты (уд. вес = 1,42).
Реактив Шиффа получают растирая в ступке 1,5 г основного фуксина с дистиллированной водой (200 мл), добавляемой постепенно. После растворения добавляют 1,5 г метабисульфита калия и 3 мл концентрированной соляной кислоты. Оставляют на ночь на холоду для мацерирования; на следующий день фильтруют и сохраняют в темноте в цветной бутылке.
Раствор кислого бисульфита получают растворяя в литре воды 39 г бисульфита натрия и 15 мл концетрированной соляной кислоты (уд. вес=1,24).
В этих условиях, благодаря наличию восстановительных групп, гликопротеины дают красные пятна. В случае кровяной сыворотки получаются три пятна удлиненной формы: одно более яркое между aj-и а2-глобулинами и другие два – менее яркие пятна – сопровождают Р- и у глобулины, Метод электрофореза в геле имеет несколько преимуществ по сравнению с электрофорезом на бумаге. Так, миграция происходит более равномерно, что обеспечивает хорошее разделение липидопротеиновых фракций, прозрачность агарного фона (после фиксации и осветеления) дает возможность легко и удобно произвести фотометрическую оценку разделенных фракций. Как уже было указано, электрофоретический метод в геле применяется для специальных целей в биологии. При этом, в случае электрофореза имунной сыворотки, реакция антиген-антитело с известными выделенными белковыми фракциями может быть выявлена непосредственно в находящемся в геле препарате. Для этой цели перед фиксацией пластинка с подвергаемым электрофорезу образцом сыворотки выдерживается в кювете с раствором антигена.
Диффундируя через слой агара, антиген приходит в соприкосновение с электрофоретически выделенными фракциями. На уровне компонента специфически реагирующего с антигеном образуется осадок, выявление которого не представляет никаких затруднений.
Таким же образом, метод электрофореза в геле используется и для других биологических реакций. Например, введение пластинки с подвергаемым электрофорезу, но нефиксированным препаратом, в энзиматический раствор дает возможность выявить специфическое действие энзима. В результате последующего проявления препарата и сопоставления с необработанным энзимами контрольным образцом можно установить, что пятно электрофоретически разделенной фракции, оказавшейся чувствительной на энзиматическое действие, будет отсутствовать полностью или только частично.
Техника Месробяну – Митрика для проведения микроэлектрофореза в агаровом геле представляет собой количественный метод, допускающий элюцию и колориметрирование белковых фракций, так же как и в случае электрофореза на фильтровальной бумаге.
Авторы описывают следующий способ работы.
Приготовление агара: 50–100 г агара (в порошке или волокнах) растворяют кипячением в водопроводной воде, охлаждают и затеж после гелификации разрезают на кусочки размером в 2–3 см8, которые кладут в марлевые мешочки и диализируют с противотоком водопроводной воды. Спустя три дня мешочки переводятся в сосуд с дистиллированной водой, где их оставляют на 48 часов. Таким образом промытый агар сушат при 80°С; до употребления агар хранят в закупоренных банках при температуре лаборатории.
Для опыта из этого агара – при нагревании – приготовляется 1 % раствор в буферном веронале, имеющий следующий состав:
веронал натриевый веронал
мертиолат (консервирующее) дистиллированная вода
(pH 8,6; ионная сила – 0,05).
Однопроцентный раствор агара фильтруют через плотную ткань и вату, затем в количествах по 10–15 мл переводят в трубки, которые хранят при + 4°С. В момент использования содержания трубок расплавляют на водяной бане.
Отливка агара на используемом носителе. Гель агара отливается в горячем виде на носителе состоящем из пленки или бумаги, а именно следующим образом: на стеклянных микроскопических пластинках или пластинках из простого стекла размером 3 X 16 см, размещенных абсолютно горизонтально кладут фильтр или используемую бумагу. Эти последние разрезаются точно по размерам стеклянного носителя.
Бумага или фильтр предварительно увлажняются буферным раствором для того, чтобы они хорошо прилегали к стеклянному носителю. Затем приступают к разливу агара, который во все время операции должен иметь температуру 70-г-80°С. Количество используемого агара равно 0,2 мл на один см2 носителя.
Разлив производится с помощью пипетки на середине стекла, после чего немедленно с помощью стеклянной палочки размазывается к краям пластинки таким образом, чтобы он равномерно покрыл всю площадь. Пластинки покрываются стеклянными крышками и выдерживаются в течение 30 минут – 1 часа для гелификации.
Приготовление носителя из пленки. Для этой цели используются очищенные белые или желтые рентгенологические пленки, которые оставляют на несколько часов в холодной воде для гидратации. Таким образом желатин легко удаляется. После этого пленки разрезаются на необходимые размеры и сохраняются в сухом месте до использования.
Приготовление бумажных носителей. Для этой цели можно использовать следующие виды бумаги: белую веленевую или полувеленевую бумагу, блестящий картон, картон белый или другого цвета, используемый для изготовления карточек и папок, миллиметрическую бумагу или обычную фильтровальную бумагу. Все эти основы дают аналогичные результаты, причем однако миллиметрическая бумага имеет то преимущество, что благодаря предварительной окраске анализируемой сыворотки несколькими зернышками бромофенола она постоянно указывает во время операции на число миллиметров, на которое мигрировал белок, а после фиксации и окрашивания – число миллиметров, на которое мигрировала каждая фракция.
После того, как гелификация на пленке или бумаге окончилась, предметные стекла переводятся в кювету для электрофореза, в которой имеются два резервуара, заполненных тем же буферным вероналом, которым пользовались для приготовления геля из агара и который предварительно был уравновешен посредством системы, состоящей из сообщающихся трубок. У концов пластинок кладутся изогнутые с одной стороны две фильтровальные бумаги, так, чтобы они точно покрывали пол-сантиметра ширины пластинки в геле; второй конец погружается в резервуар с буфером, куда в противоположную сторону вставляются платиновые электроды.
Нанесение сыворотки на поверхность агарового геля. На сухой бумаге, до увлажнения буфером и розливки геля, карандашом точно на середине проводят перпендикулярно длине небольшую линию. На одном из ее концов отмечается номер сыворотки, дата и др. На пленках предварительно нельзя ставить никаких отметок; все же, на обороте стеклянного носителя пленки вносятся соответствующие данные и проводится линия, на которую наносят пятно сыворотки. К концу электрофореза, после окрашивания и сушки, на пленках можно написать чернилами необходимые данные. Нанесение сывороточного пятна производится следующим образом: разрезаются кусочки фильтровальной бумаги длиной около 1–1,5 см и шириной 0,1–0,2 см. Бумагу пропитывают анализируемой сывороткой и кладут с помощью тонкого пинцета точно на центральную линию, проведенную на бумаге.
Вся система покрывается стеклянным колпаком. Разумеется, наибольшее преимущество представляет изготовление прибора из плексигласа, который можно герметически закрыть. Однако, можно импровизировать баночки из больших коробок Лаверана, как это описали Портокалэ и Боеру.
С помощью электрических проводов полюсы подключены к выпрямителю, а ток регулируется на 0,8 и 1 ма/см ширины пластинок с агаровым гелем. Продолжительность миграции изменяется в описанных условиях ионной силы и данного значения pH в зависимости от длины пластинок, размера сывороточного пятна и сорта бумаги используемой в качестве носителя для геля. В основном, для пластинок 16 см длины миграция происходит в течение 6–8 часов. Миграцию следует остановить, когда фронт белков дошел на расстояние 2,5–3 см до края большой пластинки и на 1,5 см до края микроскопных стекол.
Фиксация предметных стекол. После выключения тока перемычки из фильтровальной бумаги удаляются, а пластинка вместе с бумагой или пленкой, на которой нанесен гель, погружается в фиксатор. Фиксирующий раствор содержит 2% ледяную уксусную кислоту в 60° спирте.
Продолжительность фиксации не меньше 3 часов. Однако, пластинка можно оставлять также и на ночь. В случае использования носителя пленки, рекомендуется, чтобы продолжительность фиксации не превышала 3 часа.
Сушка пластинок. Для успеха операции эта фаза имеет весьма большое значение. Пленку или бумагу с гелем вынимают и размещают на большой стеклянной пластинке, предварительно покрытой куском фильтровальной бумаги. На поверхности геля кладут полосу фильтровальной бумаги. На поверхности геля кладут полосу фильтровальной бумаги, таким образом, чтобы она плотно прилегала к гелю. Поверх кладут куски фильтровальной бумаги, разрезанной в виде небольших квадратов. Все это покрывают стеклянной пластиной. Когда небольшие куски оумаги увлажнились, их меняют, причем эта операция повторяется трижды. Электрофореграмма, покрытая исходной полосой фильтровальной бумаги, нагревается до 37°С, до полного высыхания. Эта операция необходима для равномерной сушки и для поглощения избытка солей в геле, которые в данном случае кристаллизуются на поверхности во время сушки.
Окрашивание электрофореграммы в геле. После этого высушенная электрофореграмма выдерживается в течение 16 часов в ванночке с красителем. Краситель имеет следующую формулу:
0, г бромфенола синего, 50 г сульфата цинка и 50 г ледяной уксусной кислоты в 1000 мл дистиллированной воды.
Промывание пленок или бумаги с гелем. Избыток красителя устраняется, пропуская электрофореграмму в трех ванночках 2% уксусной кислоты, по пять минут в первых двух ванночках и 10 минут в последней.
Виражная ванна содержит 10% уксусную кислоту или 2% ацетат натрия. В этой кювете электрофореграммы оставляют на 2 минуты.
Сушка. Из виражной ванны электрофореграмму вынимают и сушат между двумя чистыми листами фильтровальной бумаги, затем раскладывают на стеклянной бумаге между двумя сухими листами фильтровальной бумаги, покрывают другой стеклянной пластиной и оставляют при 37°С до полного высыхания, когда пятна белковых фракций становится синими.
Элюция. Разделенные пятна мелко нарезаются ножницами и затем элюируются точно также, как при электрофорезе на фильтровальной бумаге. Каждая фракция элюируется в 3 мл следующего элюанта: 4% карбонат натрия в 50% метаноле. Трубки закупориваются пробками и оставляют на час в покое, время от времени взбалтывая.
Фотометрирование. Элюированные фракции колориметрируются в приборе Пульфриха, причем для этого используются кюветы на 1 мл и фильтр с длиной волны 5.500–6.000А. Отсчет делается на шкале затухания, причем сумма отсчитанных затуханий – для каждой белковой фракции – приравнивается к 100, а затем простым тройным правилом производится процентный расчет содержания каждой фракции в анализируемой сыворотке. Этот метод, особенно в случае использования больших пластинок, можно преобразовать в абсолютный метод, нанося с помощью микропипетки на расположенное на фильтровальной бумаге пятно известное количество анализируемой сыворотки (0,01–0,02 мл).
Когда фон окрашен, необходимо прибегнуть к следующей операции. Вырезают кусок носителя (пленки или бумаги) вне зоны миграции и взвешивают; кроме того взвешивают также куски носителя, соответствующие данным фракциям. После элюции контрольного образца и остальных фракций затухание относят к миллиграмму носителя, а затухание соответствующее одному миллиграмму контрольного образца вычитается из затухания одного миллиграмма носителя, соответствующего пятнам. После этого производят процентный расчет.