Определение химического состава биологических препаратов
Основными объективами биохимика в области научных исследований является идентификация химических компонентов анатомических структур и выяснение последовательности биохимических процессов, обеспечивающих развертывание физиологических явлений. Следовательно, методы определения химического состава биологических продуктов и методы определения их энзиматической активности применяются в весьма широком масштабе в биохимических исследованиях. В этих целях были разработаны многочисленные разнообразные способы. Разумеется, изложение всех этих способов не представляется возможным в настоящей работе, вследствие чего будут описаны только основные, то есть наиболее часто применяемые и наиболее точные методы. При разборе излагаемого материала, вместе с тем, было учтено лабораторное оборудование, необходимое для применения описываемых методов. В силу этих соображений некоторые методы, допускающие получение особо точных результатов, но нуждающиеся в специальном оборудовании (анализы, основывающиеся на применении радиоактивных изотопов, спектрофотометрические методы, методы ультрацентрифугирования и др.) описаны только в принципе, причем их технические подробности в настоящей работе не приводятся.
Подробный анализ химических компонентов того или иного биологического препарата обусловлен, в первую очередь, разработкой схемы хода предпринимаемых операций. Поэтому, описанию методов идентификации и очистки основных компонентов биологических препаратов будет предшествовать изложение последовательности операций, необходимых для проведения наиболее полного анализа препаратов.
Под общим термином «биологический препарат» подразумеваются наиболее разнообразные виды продуктов, которые могут быть подвергнуты биохимическому анализу: фрагменты тканей, гуморальные жидкости, клеточные взвеси, тканевые, гуморальные или клеточные экстракты и др. Обычно они используются в их исходной форме, то есть такими, какими их получают из живого организма или из культур in vitro (тканевых культур, культур микроорганизмов). В других случаях биологические препараты предварительно подвергаются консервированию (обезвоживание охлаждению, замораживанию, коагуляции и др.).
Обычно результаты анализов, предпринятых на этих препаратов относятся к 1 г исходного препарата или – что еще лучше – к эквиваленту 1 г сухого препарата. Кроме того, довольно часто практикуется отношение к н-белковому эквиваленту, содержащегося в исследуемом препарате и 1 мг N-эквиваленту 1 мг нуклеиновых кислот. В случае анализа фосфорных препаратов (фосфатиды, фосфо-нуклеозиды и др.) применяется отношение к 1 мг органического фосфора.
Систематика операций в течение химического анализа биологических препаратов
Основными компонентами биологического препарата являются вещества протидного происхождения, липиды, глюциды, вода (растворяющая среда) и минеральные соли. На определенном препарате, который подвергается биохимическому анализу, нельзя одновременно проводить все анализы, необходимые для выявления абсолютно всех компонентов. На одном и том же образце можно определять только воду и минеральные вещества.
Следовательно, для проведения химического анализа, биохимический препарат необходимо предварительно разделить на 4 части (достаточно большие для того, чтобы иметь возможность произвести необходимые операции). Из них часть используется для определения содержания воды и минеральных веществ; другая часть – для анализа азотных органических веществ, третья – для липидов и, наконец, четвертая для глюцидов.
Вода
Биологические структуры характеризуются присутствием весьма обильных количеств воды. Достаточно напомнить о том, что вода входит в состав слюны и пота в соотношении 99,5%, слез – 98%, лимфы – 96%, крови – 79%, мышц – 76% и т. д. Даже костная ткань содержит 22% воды (дентин только 10%).
В биологических препаратах вода находится в двух формах: «вода растворения», являющаяся природным растворителем весьма большого числа биокомпонентов, и «вода связанная» макромолекулярными веществами, пропитывающими коллоиды аналогично кристаллизационной воде. Опыты, проведенные Никлу были весьма показательными в отношении связанной воды: при замораживании биологического препарата при температурах в пределах от –20 и –60°С отмечается, что превращение в лед воды, содержимой соответствующим препаратом, не происходит полностью, а 20–30% этой воды остается незамороженной. Этот факт не может быть объяснен снижением криоскопической точки, поскольку количество кристаллоидов, которые должны были присутствовать для того, чтобы предотвратить подобный эффект, столь велико, что в этих условиях жизнь не была бы ВОЗМОЖНОЙ. Поэтому Никлу был вынужден заключить, что часть тканевой воды участвует в образовании комплексов с молекулами, из которых состоит клеточная протоплазма.
Связанную воду можно измерить криоскопическими методами, посредством измерения диэлектрических констант (учитывая, что связанная вода не реагирует на поляризирующее действие электрического поля, практически будучи диэлектрически насыщенной), или путем исследования способа проникновения спирта, вводимого в воду растворения.
Разница между общей и связанной водой дает возможность определить содержание воды растворения. Напротив, расчет воды растворения (путем определения скрытой теплоты плавления предварительно замороженной воды растворения) и общей воды позволяет установить количество связанной воды.
Обычно на практике определяют общую воду. Для этого используют подходящий сосуд (ампулу для взвешивания, чашку небольшого диаметра – 40 мм, – или часовое стекло), которые хорошо промывают, обезжиривают, споласкивают дистиллированной водой и сушат. Затем путем взвешивания до 4-го десятичного числа определяют тару посуды. (Назовем эту тару – t0). В посуду берут известный объем (0) исследуемого препарата и снова взвешивают (предположим, что tl9 – полученный вес). После взвешивания сосуд вместе с содержимым нагревают в сухой печи при 105°С. После того, как установлено, что вода испарилась, сосуд взвешивают, затем его снова кладут в печь (105°С) и по истечении последующих 30–45 минут взвешивание повторяют. Препарат считается полностью обезвоженным, когда в результате 2–3 последовательных взвешиваний получают одинаковое значение (назовем его г2).
Минеральные вещества (зола)
Анализ неорганических элементов, содержащихся в том или ином биологическом препарате, нуждается в предварительном уничтожении органических веществ. Эту операцию можно осуществить либо прокаливанием, либо обработкой подходящей минерализирующей смесью.
Для обоих видов операции исходят от обезвоженного продукта, то есть от сухого экстракта (см. выше).
Прокаливание (кальцинирование, минерализация)
Обезвоженный продукт берут в фарфоровый тигель (предпочитается производить исходное обезвоживание непосредственно в этом тигеле). Тигель может быть расположен на треножнике над пламенем, газовой горелки Бунсена и нагрет до полного удаления минерального вещества.
Если возможно, следует предпочесть использование платинового тигеля. Лучше всего, если нагрев производится в печи для прокаливания до получения белой золы. В течение всей операции прокаливания необходимо избегать наличие восстановительной атмосферы, которая могла вызвать потерю вещества. К концу прокаливания тигель снимают с помощью никелевых клещей и быстро погружают наполовину в холодную воду. Необходимо соблюдать предосторожность, чтобы капли воды не проникали в тигель. Благодаря этой операции прокаленная масса отделяется от стенка тигеля.
Для удаления кремния получаемую золу растворяют в концентрированной соляной кислоте и затем подвергают выпариванию при 105°С.
Способ прокаливания рекомендуется для растительных тканей. Для животных тканей этот способ связан с неудобствами, зачастую приводя к потере вещества, вследствие проливания и агломерирования материала во время обработки. В случае подобных препаратов следует предпочесть минерализацию с помощью сульфо-нитро-перхлорной смеси.
Минерализация мокрым способом
Для этой операции применяют колбы типа Кьельдаля большой емкости (500–1000 мл), содержащие 3–4 стеклянные бусины, для регулирования кипячения. В эти колбы для минерализации берут обезвоженный материал. Добавляют концентрированную серную кислоту в соотношении 2 мл на 1 г препарата, смесь нагревают до появления темно-коричневого цвета, затем добавляют 15–20 капель дымящей азотной кислоты, продолжая нагрев. Смесь начинает обесцвечиваться, затем становится вязкой и снова приобретает бурый оттенок; в этот момент по каплям добавляют до полного обесцвечивания смесь, состоящую из двух объемов перхлорной кислоты (уд. вес = 1,61) и одного объема азотной кислоты (уд. вес = 1,39). Если препарат содержит значительное количество железа, цвет жидкости останется желтоватым.
После окончания минерализации жидкость из колбы Кьельдаля переводят количественно в фарфоровую чашку, в которой, вместе с промывочными водами она подвергается медленному выпариванию на песочной бане, для удаления избытков серной кислоты. Сухой осадок снова берут с кипящей дистиллированной водой, которую слегка подкисляют соляной кислотой для того, чтобы обеспечить растворение металлов.
Этот раствор не содержит кремния, который стал нерастворимым во время минерализации. Раствор используют для определения минеральных веществ.
Определение натрия
Точное и быстрое определение натрия можно осуществить с помощью пламенного спектрометра, используя для этого подходящий фильтр.
Химическое определение натрия можно производить методом Бланшетьер. Ниже приводим способ, применяемый Дымбовичану и Барбером для бактериальной золы.
Метод состоит из введения натрия в соль Стренга – тройной ацетат уранила, магния и натрия – и в ее определении гравиметрическим или колориметрическим способом.
В качестве реактива используется двойной раствор, формула которого приводится ниже:
Раствора А – ацетат уранила 100 г
кристаллическая уксусная кислота 50 г
дистиллированная вода 1000 мл
Раствора В – ацетат магния 333 г
кристаллическая уксусная кислота 60 г
дистиллированная вода 1000 мл
Растворы сохраняют в темноте в парафинированных бутылках. Перед употреблением смешивают равные части обоих растворов.
Для определения к 5–6 мл солянокислого раствора минеральных солей добавляют 20–25 капель раствора хлорного железа 4% и 1–2 капли бромистой воды. Нагревают в течение часа при 100°С, затем, после охлаждения, подщелачивают аммиаком до появления розовой окраски в присутствии фенолфталеина. Эти операции способствуют осаждению фосфатов, препятствующих образованию соли Стренга. Для ускорения осаждения щелочный раствор слегка нагревают. Осадок удаляют на фильтровальную бумагу, не образующую золу и затем фильтр промывают аммиачной водой.
Объем фильтратов доводят до 2 мл выпариванием на водяной бане. После охлаждения добавляют 20 мл осаждающего реактива (растворы А и В;, после чего материал оставляют в контакте в течение 30 минут. Полученный осадок берут на фильтр Гуча и промывают спиртом 95%. Затем фильтр сушат при 105°С до постоянного веса и подсчитывают вес осадка соли Стренга. Следует учесть, что молекулярный вес соли равен 1 390, то есть в 60,43 раза больше, чем натрия. Следовательно, если вес осадка разделить на 60,43, то получается количество натрия, присутствовавшего в исходном образце исследуемой золы (или биологического препарата).
Для колориметрического определения, не содержащий фосфатов фильтрат смешивают в равных количествах с уксусным раствором фероцианида 1% (ледяная уксусная кислота добавляется к последнему в 2% соотношении в момент использования реактива). Яркость получаемой окраски сопоставляется с окраской эталона, состоящего из разных количеств уксусного раствора фероцианида и раствора, содержащего 0,02 мг тройного ацетата (вышеуказанные растворы А и В).
Определение кальция
Микрометод Веллуз и Дешазо основан на осаждении кальция виде оксалата и последующем волюметрическом определении оксалового радикала. Надосадочную жидкость оксалового осадка используют для микроопределения магния (Иванов).
Предпочитается использование белой золы, получаемой при прокаливании исследуемого биологического препарата. Эту золу берут в 2 мл НС1 5% и выпаривают в водяной бане. Затем осадок растворяют в точно отмеренных 5 мл уксусной кислоты 0,5%. Из раствора 4 мл переводят в центрифужную пробирку (емкостью 12,5 мл), туда добавляют 0,5 мл раствора оксалата аммония 0,1 н (7,2 г °/00. Осторожно встряхивают, оставляют на полчаса в покое, после чего центрифугируют на высоких оборотах. Жидкость сливают, надосадочную жидкость используют для определения магния, а осадок взвешивается в 4 мл взвеси, состоящей из спирта (18 частей), эфира (18 частей) и воды (15 частей).
Также, как и при определении Na и К, в случае определения кальция, следует предпочесть пламенную спектофотометрию, пользуясь соответствующим интерферентным фильтром.
Определение магния
Как уже было сказано, исходят из минерального раствора, из которого был удален осадок оксалата кальция (см. выше параграф относительно определения кальция). Дымбовичану и Барбер пользуются способом Канальса, титрующего раствором азотнокислого серебра фосфорный ангидрид, выделившийся из осадка двойного фосфата магния и аммония.
Для получения осадка, к минеральному раствору, из которого удален кальций, выпаренному до объема 2 мл, добавляют 5 мл раствора хлористого аммония 10% и подщелачивают аммиаком до получения щелочной реакции (лакмус). В этот момент добавляют 5 мл раствора двухнатриевого фосфата 66%, слегка встряхивают и оставляют на ночь в холодильнике.Образующийся в этих условиях осадок двойного фосфата магния и аммония промывают аммиачной водой 10%, растворяют в минимальном количестве НС1 5% и сливают в бутылку из иенского стекла. В этой бутылке титрование производят раствором нитрата уранила 3,55% в присутствии 5 капель кошенильного настоя и 5 капель раствора ацетата 10°/^ в уксусной кислоте. Титрование продолжают до появления устойчивого зеленого цвета.
1 мл раствора азот нокислого уранила, израсходованного для титрования, соответствует 0,5 мг пятиокиси фосфора и в то же время 0,171 мг магния.
Определение железа
Это определение производится легко и быстро методом с роданидом аммония 5%. Весьма важно, чтобы исследуемый образец был разбавлен таким образом, чтобы в конечном итоге он содержал приблизительно 10 мг железа. Затем добавляют 0,1 мл концентрированной азотной кислоты и оставляют на несколько минут в кипящей водяной бане.
Параллельно приготовляют контрольный образец, содержащий 10 (хг железа в виде Fe S047Н20.
После обработки при нагревании азотной кислотой в обе пробирки добавляют по 1 мл раствора NH4SCN 5% и по 1 мл изоамилового спирта. Энергично встряхивают. Яркость получаемой окраски в обоих параллельных образцах сопоставляют в фотометре, а затем применяют обычные для фотометрии расчеты.
Определение меди
В присутствии аммиака медные соли дают интенсивную синюю окраску, легко сопоставимую с окраской контрольного образца, содержащего известное количество сульфата меди (фотометр с оранжевым фильтром). Однако, следует отметить, что синюю сопоставимую окраску дают и соли никеля и кобальта, вследствие чего медь необходимо предварительно отделить из образца осаждением в виде сульфида.
Солянокислый раствор, содержащий минерализованную медь обрабатывают избыточным количеством свежеприготовленного моносульфида натрия (1 объем NaOH 1% насыщают H2S барботированием; затем добавляют еще один объем NaOH 1%). Образуется черный осадок сульфида меди, который собирают центрифугированием и несколько раз промывают горячей бидистиллированной водой.
К осадку добавляют раствор аммиака 20%. Вначале осадок становится желатинообразным и приобретает белый цвет (так как образуется гидрат меди), затем наблюдается его растворение и окрашение раствора в яркий синий цвет. Избыток аммиака не оказывает никакого влияния на яркость синей окраски, в связи с чем аммиак можно добавлять до получения конечного объема образца 10 мл.
Одновременно приготовляется серия контрольных образцов используя для этого известное количество меди в пределах от 0,5 мг до 3 мг к которым добавляют аммиачный раствор до окончательного объема 10 мл. С помощью контрольных образцов фотометрически определяют присутствующее количество меди.
Азотные органические вещества
Целью исследования азотных органических веществ, присутствующих в том или ином биологическом препарате, является определение общих белков, полипептидов, аминокислот, общих нуклеиновых кислот, дезоксирибонуклеиновой кислоты, рибонуклеиновой кислоты и свободных нуклеотидов (дифосфопиридиннуклеотидов, аденозинофосфатов, уридинфосфатов, коэнзима А и др.).
Последнее время было опубликовано значительное количество работ, в которых разбираются методы исследования азотных органических компонентов. На основе этих работ можно описать многочисленные способы анализа этих веществ. Исследования, предпринятые в течение 25 лет Буавен, Месробяну, Вендрели наиболее соответствуют преследуемой цели. На основании методов, описанных этими авторами, можно составить стройную схему последовательности операций, дающих возможность проанализировать азотные органические компоненты того или иного биологического препарата.
Такая схема представлена на рис. 52. Анализ этой схемы показывает, что при наличии установленных данных, можно подсчитать все азотные компоненты а именно:
- Общие белки подсчитывают, умножая на 6,25 разницу между значениями общего и кислоторастворимого N.
- Полипептиды, выраженные в виде полипептидного аминового N, получают в виде разницы между значениями общего аминного и свободного N.
- Аминокислоты выражаются в виде свободного аминного N.
- Общие нуклеиновые кислоты выражают в виде пуринового N общих нуклеиновых кислот.
- Дезоксирибонуклеиновую кислоту определяют непосредственно с помощью реактива Дише.
- Рибонуклеиновую кислоту подсчитывают в виде разницы между значениями общих нуклеиновых кислот и дезоксирибонуклеиновой кислоты.
- Свободные нуклеотиды выражают в виде нуклеотидного кислоторастворимого пуринового N.
- Свободные нуклеозиды и пуриновые основания подсчитывают в виде разницы между общими кислоторастворимыми пуринами и нуклеотидными кислоторастворимыми пуринами.
Как можно заметить, все определения сводятся к 4 видам дозировок - общего N, аминного N, пуринового N, и общего Р.
Определение общего азота
В строгом смысле слова термин «общий N» включает все формы присутствующие в том или ином биологическом препарате (белковый К полипептидный N, аминный N, нуклеиновый N, и др.).
Однако метод определения N один и тот же, даже в том случае, когда из биологического препарата были удалены некоторые азотные фракции.
В подобных случаях название « общий N» ;заменяется названием, соответствующим проводимым операциям. Например, добавление трихлоруксус- ной кислоты к биологическому препарату вызывает осаждение белков; определение азота в кислоторастворимой надосадочной жидкости приведет к гораздо меньшим значениям чем значение общего N, причем получаемые значения соответствуют только кислоторастворимому N (аминокислоты, и свободные основания и др.).
Наиболее часто применяемыми методами определения общего азота в том или ином продукте являются: микроопределение раствором Кьельдаля и манометрический метод ван Слайк-Нейля. Микроопределение раствором Кьельдаля применяется многочисленными авторами с хорошими результатами.
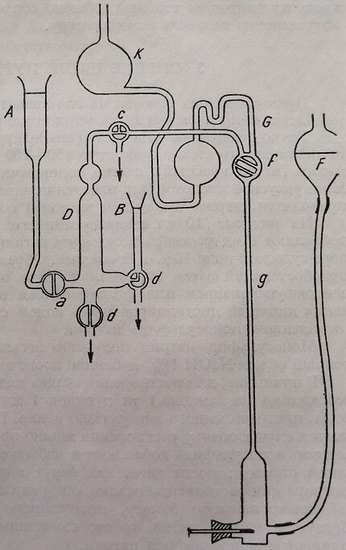
Микроопределение азота по Кьельдалю представляет собой титриметрический метод, с помощью которого N определяют после превращения всего органического N в аммиак. Для этого используют аппарат Прегля, измененный Парнасом и Вагнером (рис. 53), состоящий из: сосуда типа Кьельдаля (рис. 53 а), в который через воронку с краником (рис. 53 б) вводят минерализованное вещество (см. дальше), а также гидрат, необходимый для выделения аммиака. Выделяемый аммиак поступает в бутылку (рис. 53 с), содержащую известное количество соляной кислоты, после того как она предварительно прошла через холодильник d. Увлечение кислоты осуществляют с помощью паров, образовавшихся в колбе.
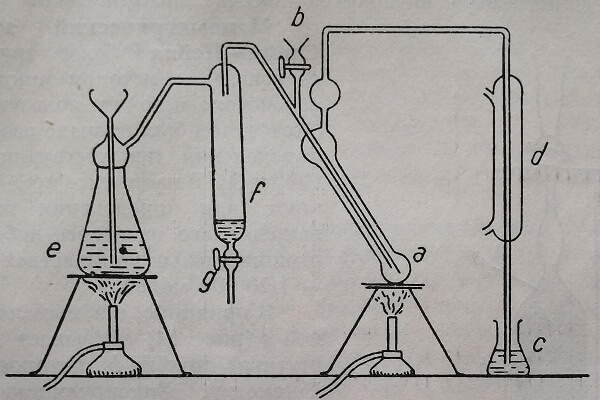
Рис. 53. Схема устройства аппарата для микроопределения азота (Прегль – Парнас– Вагнера).
Промежуточный сосуд используют для споласкивания аппарата, причем промывные воды сливаются в канализацию через кран g.
Анализируемый препарат берут в колбу Кьельдаля соответствующей емкости (50–100 мл). Добавляют 1 мл концентрированной H2S04 для анализа (уд. вес = 1,84), 1 каплю раствора сульфата меди 20% для анализа и несколько кристаллов оксалата калия для анализа. Вместо оксалата калия можно использовать безводный сульфат калия для анализа. Предпочтительно ввести в колбу 2–3 стеклянные бусинки, во избежание образования пузырьков в течение минерализации.
Затем колбу Кьельдаля устанавливают в наклонном положении (65°) на металлической сетке, окружающей ее нижнюю часть, обеспечивая быстрый и равномерный нагрев с помощью небольшого пламени газовой горелки. Нагревают непрерывно, вначале на небольшом пламени (до испарения содержащейся в препарате воды), затем на более сильном огне, продолжая нагревание в течение 30 минут, после чего появляется белый дым. К концу этой операции содержимое должно полностью быть обесцвечено. Параллельно приготовляют контрольный образец с теми же реактивами, но без испытуемого препарата.
После охлаждения колбы добавляют 2–3 мл дистиллированной воды, встряхивают, слегка нагревают на пламени для того, чтобы ускорить растворение, после чего содержание переводят в сосуд а, аппарата Парнаса, через воронку b (рис. 53).
Эту операцию повторяют 2–3 раза для того, чтобы быть уверенным в том, что все количество смеси из колбы Кьельдаля поступило в аппарат Парнаса. Устанавливается флакон с, содержащий 10 мл НС1 н/70 (кончик трубки холодильника d должен быть погружен в жидкость, находящуюся в флаконе с). Пары проходят через а, причем краны b и g закрывают. В воронку берут 10 мл NaOH 6 н, затем кран воронки открывают и затем снова закрывают до того, как все количество гидрата стекло в а.
Примерно по истечении 10 минут выделения паров можно считать, что операция перегонки окончена, после чего титруют НС1, которая не была нейтрализована увлеченным аммиаком. Титрование производят NaOH н/70 или NaaC03 н/70 (индикатор - метил красный).
Аналогичным образом поступают с контрольным образцом.
Если а – количество мл NaOH н/70, израсходованных для титрованания образца и А – число мл, использованных для титрования контрольного образца, то:
(А – а) Х0,2 = мг общего N
присутствующих в исследованном количестве биохимического препарата.
Манометрический метод ван Слайк–Нейля более трудоемок, по сравнению с методом микрокьельдаля вследствие чего им пользуются редко. Этот метод был вначале разработан для определения присутствующих в крови СОа иОа. В настоящее время его применяют для определения любого газа, выделяемого из какого-либо препарата, в минимальных количествах.
В принципе, газ, выделяемый системой а (рис. 54) оказывает давление на ртутный столбик, которое передается манометру, фиксирующему колебания давления (см. и рис. 55).
Для определения, органическое вещество исследуемого препарата окисляется нагреванием со смесью, состоящей из HgS04, SeOa, H2S04 и Н3Р04, причем присутствующий азот преобразуется в сульфат аммония. После разбавления и нейтрализации раствор сульфата аммония переводят в манометрическую камеру (рис. 54а) и обрабатывают гипобромитом, преобразующим количественно аммиак в азот. Таким образом возникающий перепад давления измеряется.
Рис. 54. Манометрическая камера аппарата Ван Слайк – Нейля.
Минерализацию производят в следующих условиях: в колбы типа Кьельдаля берут исследуемый препарат (содержащий N от 0,02 до 10 мг) и добавляют 2 мл окислительной смеси. Эту последнюю приготовляют, смешивая 0,5 г HgS04 с 1 г Se02 в 125 мл бидистиллированной воды (добавляемой постепенно при непрерывном помешивании), 75 мл концентрированной H2S04 (уд. вес = 1,84) и 25 мл Н3Р04 85%.
Одновременно приготовляется контрольный образец, в котором исследуемый продукт отсутствует. Затем колбы Кьельдаля постепенно нагревают на песочной бане до 360° С в течение 1 часа, причем необходимо чтобы жидкости в колбах стали прозрачными. Если жидкости не обесцветились, добавляют дополнительное количество 2 мл окислительной смеси, после чего минерализацию повторяют.
После минерализации колбы оставляют для охлаждения, затем погружают их в холодную баню, постепенно добавляют 5 капель NaOH 10 н, учитывая перегрев, вызываемый реакцией между HaS04 и NaOH. Затем вводят 1 каплю ализарина 0,5% и продолжают добавлять NaOH 10 н до тех пор, пока цвет жидкости не станет пурпурным (обычно необходимо 30–40 капель). Затем добавляют по каплям H2S04 10% до тех пор, пока жидкость не станет снова желтой. Колбы закупоривают и встряхивают кругообразно в наклонном положении, чтобы смыть любой след реактивов.
Из этого раствора в реактивную камеру аппарата (рис. 54) переводят известное число миллилитров таким образом, чтобы содержание соответствовало 0,4–1 мг N (количество в 0,02 мг N достаточно для одного определения, причем однако более высокую точность можно достичь с 20-кратными количествами). Объем дополняют до 10 мл бидистиллированной водой. Затем, с помощью ртутного шарика уровень жидкости повышают до крана, этот последний закрывают, после чего уровень ртути (и жидкости) опускают до метки 50 мл. Систему встряхивают для выделения растворенного в образце воздуха. Затем воздух удаляют, поднимая ртутную сферу до исходного положения и открывая кран осуществляющий связь с атмосферной. В чашу, находящуюся под краном (рис. 54, с) вводят 1–2 мл воды, пользуясь для этого пипеткой, затем на дно чаши, под водой, вводят 1,5 мл NaOH 10 н и 0,5 мл н раствора брома. Затем взбалтывают с помощью двигателя в течение 30 секунд, осуществляя таким образом смешение реактивов. Как можно быстрее в реакционную камеру вливают 1,5 мл смеси щелочного гипобромита, а остальная часть остается в градуированной чаше с. Уровень ртути опускают до 50 мл и встряхивают в течение 3 минут. Затем приступают к манометрическому измерению выделенного азота (см. определение аминного N).
Контрольный образец подвергается аналогичным операциям.
Если р – установленное давление образца, а р0 – установленное давление контрольного образца, то в таком случае разница между ними дает pNa, давление выделившегося из образца азота. Преобразование в микрограммы полученного значения pNa производят, умножая это значение на константу аппарата.
Определение аминного N
Формол-титриметрический метод (Серенсена) и метод Фолена, применяемые для определения общего количества аминокислот недостаточно чувствительны для того, чтобы оценить аминный N в микроанализе биологических препаратов. В подобных случаях предпочтение отдается титриметрическому методу Попе и Стевенса или манометрическому методу ван Слайка. Следует однако отметить, что эти методы отличаются более значительной трудоемкостью.
Титриметрический метод Попе-Стевенса. В мерную колбу на 50 берут препарат, в котором требуется определить содержание аминного. Добавляют 4 капли индикатора тимолфталеина (0,5 г на 250 мл) и вводят по калям NaOH н. до появления слабого голубого оттенка. Затем добавляют 30 мл взвеси фосфата меди, а объем жидкости доводят до метки (50 мл) дистиллированной водой.
Взвесь фосфата меди состоит из 3 растворов, которые смешивают в момент проведения реакции в следующих количествах:
1 объем раствора 2,73 г СиС12 в 100 мл дистиллированной воды;
2 объема тринатрийфосфата (6,45 rNa2HP04. 12Н20 и 0,72 г NaOH на 100 мл дистиллированной воды);
2 объема буферного борного раствора (2,86 г бората натрия и 5 мл НС1 н. на 100 мл дистиллированной воды).
Смесь в мерной колбе энергично встряхивают, затем фильтруют через фильтровальную бумагу. Из абсолютно прозрачного фильтрата берут 10 мл и переводят для титрования в колбу Эрленмейера, емкостью в 100 мл. Добавляют: 0,5 мл ледяной уксусной кислоты, приблизительно 1 г KI ит2-4 капли крахмала 1% в насыщенном растворе NaCl.
Титруют тиосульфатом натрия 0,01 н.
Каждый 1 мл тиосульфата 0,01 н, израсходованный для титрования, соответствует эквиваленту в 0,28 мг аминного N.
Количество тиосульфата х, определенное в вышеуказанных условиях необходимо умножить, помимо эквивалентного фактора 0,28, и на разбавление использованного препарата. В описанном случае разбавление равнялось 5, так как для определения взяли 5-ую часть объема фильтрата.
Можно оперировать также с количествами в 5 или 10 раз меньшими.
Манометрический метод Ван Слайка. Используют аппарат ван Слайка, несколько видоизмененной конструкции (рис. 55), включающий: реакционную камеру D, в которую реактивы вводятся через А, а исследуемый препарат через В; пипетку типа Гемпеля (К), служащую для очищения азота от избытка выделяющейся при реакции углекислоты и манометр Р. Реакционная камера и пипетка Гемпеля расположены на деревянном штативе, допускающем их механическое взбалтывание.
Рис. 55. Схема аппарата Ван Слайк-Нейля.
В основу метода положено измерение аминного N, выделенного в молекулярной форме в присутствии азотистой кислоты.
Вес выделенного молекулярного азота подсчитывают с помощью обычных таблиц, причем каждый мг аминного N, присутствующий в реакционной системе, вызывает, в зависимости от давления и температуры окружающей среды, выделение 1,7–1,9 см8 газообразного азота.Метод включает 3 последовательные фазы: (а) вытеснение воздуха с помощью двуокиси азота; (б) выделение аминного N; (в) поглощение двуокиси азота и измерение выделившегося азота.
а) В целях вытеснения воздуха двуокисью азота, наполняют водой из F как капиллярную трубку g, так и трубку соединяющую краны. Затем в сосуд а берут уксусную кислоту, содержащую октиловый спирт 5% и наполняют 1/5 объема камеры J). Остальную часть камеры D наполняют также через А водным раствором нитрита натрия 30%. В течение всего этого промежутка времени, воздух из D удаляется из аппарата через кран с. Затем механически взбалтывают в течение 2 минут со скоростью трех взбалтываний в секудду, причем кран с закрыт, а кран а – открыт. Выделяющаяся двуокись азота немедленно удаляется через с. Взбалтывание и удаление повторяют до тех пор, пока в D останется лишь приблизительно 20 мл раствора. После этого кран А закрывается и с помощью кранов создается сообщение между D и F.
б) Собственно реакция (отделение аминного N) осуществляется вводя в В 1–2мл исследуемого препарата, с последующим встряхиванием камеры D, в течение достаточного промежутка времени (если аминокислоты находятся свободными в растворе, достаточно 3–4 минут; для белков взбалтывание должно проводиться в течение 5–6 минут).
в) Абсорбцию двуокиси азота производят, переводя образовавшийся газ из D в F, открывая кран а (операцию ускоряют, путем одновременного выпускания в D воды, находящейся в А). Из F с помощью крана/ газ направляют в пипетку Гемпеля. Пипетку Гемпеля встряхивают рукой в течение 1 минуты, для поглощения двуокиси азота.
Чистый азот измеряют в F (куда перешел газ). Принимаем п мл – результат отсчета.
Определение пуринового N
Принцип метода основан на осаждении пуринового N в виде медного комплекса и определении азота методом микрокьельдаля.
Точно отмеренное количество анализируемого препарата берут в чашку из нейтрального стекла (емкостью 150–200 мл). Добавляют 2 капли индикатора (метил красный), слегка подщелачивают (NaOH н.) затем подкисляют уксусной кислотой для изменения окраски метила красного. Операции проводятся, держа чашку над кипящей водяной баней.
На каждые 10 мл анализированного препарата после подкисления добавляют 1 мл раствора бисульфита натрия 30% для анализа и 1 мл раствора сульфата меди 10% для анализа. Образуется зеленовато-белый осадок, приобретающий затем бурый цвет. Этот осадок собирают количественно центрифугированием или фильтрованием и после многократного промывания кипящей дистиллированной водой снова растворяют в свежеприготовленном моносульфиде натрия.
Моносульфид натрия получают насыщая серным водородом отмеренный объем NaOH 1%, добавляя после этого еще один объем NaOH 1%.
В принципе, для растворения осадка медного комплексного соединения, необходимо на каждые 1 мг пуринов 1 мл раствора двунатриевого сульфида, приготовленного как указано выше. Принимая во внимание, что в данном случае оценку растворения можно произвести лишь приблизительно, раствор моносульфида добавляют в избытке, определяя растворение следующим образом: после того, как берут пипеткой достаточное количество раствора для растворения осадка, одну каплю анализируемой смеси наводят на фильтровальную бумагу, пропитанную сульфатом меди 10% и если образуется черное пятно, то это свидетельствует о наличии избыточного количества моносульфида натрия.
После растворения осадка, операция которая также осуществляется в чашке из нейтрального стекла, расположенной на кипящей водяной бане, снова подкисляют уксусной кислотой (до изменения окраски метила красного), оставляют в течение 20–30 минут на водяной бане (для удаления образовавшейся серной кислоты), затем повторяют осаждение, собирание и промывание осадка, и последующее его повторное растворение, согласно приведенным выше указаниям.
В конечном итоге раствор, в котором осадок бы во второй раз растворен, подкисляют уксусной кислотой до перемены окраски метила красного. Этой операцией заканчивается выделение пуринов в растворе.
Фильтруют в горячем состоянии, причем фильтр промывают кипящей дистиллированной водой.
Фильтрат и промывочные воды снова нагревают в течение 30–45 минут на водяной бане (дополняя испарившуюся воду) для того, чтобы испарились следы серного водорода. Иногда над раствором образуется пленка коллоидной серы; для ее удаления раствор фильтруют в горячем состоянии причем чашку и фильтр ополаскивают горячей дистиллированной водой.
Этот последний фильтрат и соответствующие промывочные воды практически представляют собой чистый раствор пуринов (содержащий дополнительно только следы ацетата натрия). Затем раствор переводят количественно в колбу Кьельдаля, в которую добавляют 0,05 г окиси магния для анализа, колбу нагревают в течение 10 минут на небольшом пламени. Этой операцией обеспечивается удаление следов аммиака.
После охлаждения колбы добавляют 2 мл концентрированной H2S04 (уд. вес = 1,84) и около 0,5 г оксалата калия. Производят минерализацию и затем способом микрокьельдаля определяют содержащийся в образце азот.
Одновременно, тем же операциям подвергается контрольный образец, содержащий вместо препарата дистиллированную воду.
Разницу между результатом титрования контрольного и анализируемого образца умножают на фактор 0,14 (если титрование производилось NaOH 0,01 н) или на фактор 0,2 в случае если титрование производилось NaOH н/70), причем полученное значение представляет собой число пуринового N, содержащегося в определяемом образце.
Определение общего Р
Определение общего Р, присутствующего в том или ином биологическом препарате, обычно производят, применяя фотоколориметрический метод Белль-Дуаси, измененный Бриггсом.
Так же как и в случае общего N, количество Р, определяемое методом Бриггса, относится к общему количеству фосфора, присутствующего в анализируемом препарате. Если требуется определение лишь определенной фосфорной фракции в препарате (например, кислорастворимый Р), необходимо предварительно отделить эту фракцию соответствующей обработкой (дезальбуминирование трихлоруксусной кислотой).
Принцип метода основан на превращении минерализованного фосфора в фосфорномолибденовую кислоту с помощью молибдата аммония в кислой среде. В результате восстановления, фосфорномолибденовая кислота превращается в молибденовую синь, концентрацию которой можно установить колориметрически, определяя яркость образовавшейся окраски.
Реактивы, необходимые для применения этого способа, приготовляются следующим образом:
- Кислый раствор молибдата аммония: 25 г молибдата аммония для анализа берут в мерную колбу емкостью в 500 мл и растворяют приблизительно в 300 мл бидистиллированной воды (в случае необходимости раствор фильтруют). Затем осторожно добавляют 75 мл концентрированной кислоты (уд. вес – 1,84) и дополняют водой до 500 мл.
- Раствор гидрохинона: 0,5 г гидрохинона растворяют в мерной колбе в приблизительно 80 мл бидистиллированной воды. Добавляют 1 каплю серной кислоты и доводят до метки бидистиллированной водой. Раствор можно использовать до тех пор, пока он не окрашивается в бурый цвет. Вместо гидрохинона можно использовать аналогичный раствор витамина С, обладающий одинаковыми восстановительными свойствами.
- Раствор сульфита натрия приготовляют в концентрации 20 г на 100 мл дистиллированной воды. Рекомендуется приготовлять этот раствор в день произведения определений.
- Серная кислота 5 н: к 260 мл бидистиллированной воды добавляют 45 мл концентрированной H2S04 для анализа (уд. вес = 1,84).
- Раствор мочевины 2%.
- Концентрированная азотная кислота для анализа (уд. вес= 1,4).
- Стандартный раствор фосфора (контрольный образец для колори метрирования): 0,4 392 г однокалиевого фосфата по Серенсену (Н2КР04) растворяют в 1 литре воды в мерной колбе. Для того, чтобы обеспечить консервирование, добавляют 2–3 мл хлороформа. Из этого раствора в мерную колбу на 200 мл тщательно отмеряют 25 мл и разбавляют до метки бидистиллированной водой. Каждые 2 мл этого раствора содержат 0,025 г Р.
Для определения, в две колбы Кьельдаля, емкостью в 50 мл, берут 3 мл анализируемого препарата (колба I) и 5 мл стандартного раствора Р (колба II). В обе колбы добавляют по 5 мл 5 н серной кислоты и по 2–3 стеклянные бусинки. Колбы помещают с уклоном в 65° непосредственно на пламени микрогорелок Бунсена и нагревают до появления паров S03. В этот момент газовые горелки удаляют и добавляют по каплям концентрированную азотную кислоту, снова нагревая на огне до тех пор, пока растворы в колбах не станут бесцветными.
По окончании минерализации, в каждую колбу добавляют по 2 мл раствора мочевины 2% и нагревают еще 1 минуту. Целью добавления мочевины является связывание образующихся азотистых групп.
Колбы охлаждают до комнатной температуры, после чего их содержание количественно переводят в мерные колбы на 50 мл. Добавляют по 3 мл кислого раствора молидбата и по 1 мл раствора сульфита натрия, а также раствора гидрохинона (или аскорбиновой кислоты). Объем доводят до метки дистиллированной водой. По истечении 10 минут выдерживания при комнатной температуре, оба раствора колориметрируют.
Вариант метода Бриггса, предложеный Машбефом и Дельсалем упрощает операцию минерализации.
Исследуемый препарат (который должен содержать не более 25 мг органического вещества) берут в пробирку Пирекс 18/180. Добавляют точно 0,3 мл концентрированной H8S04 и 0,4 мл концентрированной азотной кислоты. Нагревают на умеренном пламени газовой горелки до тех пор, пока не перестают выделяться пары N02. В этот момент проверяют обесцвечивание жидкости. В противном случае нагревание повторяют после предварительного добавления 0,2 мл азотной кислоты. Весьма важно, чтобы нагревание было приостановлено тотчас же после того, как прекращается выделение белого дыма.
После охлаждения, к остатку добавляют 6 мл воды, причем пробирки помещают на 15 минут в кипящую воду, затем добавляют: 2 мл раствора молибдата аммония 5%, 1 мл раствора сульфита натрия 20% и 1 мл раствора гидрохинона.
По истечении 30 минут производят отсчет на фотометре (оранжевый фильтр).
Одновременно, таким же образом обрабатывают два контрольных образца, содержащие 10 хг и 100 лг Р. (Эти образцы приготовляют, исходя из стандартного раствора содержащего 43,9 мг Н2КР04 на 100 мл воды, в котором 1 мл содержит 100 {лг Р).
Благодаря изменению, внесенному Машбефом и Дельсалем можно определить и весьма малые количества Р, в пределах 0–50 лг.
Определение азотных органических компонентов
Определение азотных органических компонентов в биологическом препарате производят соответственно схеме, приведенной на рис. 52.
Общий N определяют на точно отвешенном количестве препарата. Применяют вышеописанный способ микрокьельдаля.
Общие пурины. Точно отвешенное количество препарата (около 500 мг) берут в колбу из нейтрального стекла и добавляют достаточное количество ИС1 н., таким образом, чтобы кислота покрывала препарат. Затем колбу присоединяют к обратному холодильнику и в этих условиях препарат гидролизуют в течение 8 часов при 100°С. Получаемый гидролизат фильтруют, а колбу и фильтр трижды ополаскивают бидистиллированной водой. Фильтрат и промывочные воды используются для определения общего пуринового N, согласно описанному способу.
Целью подготовки препарата для определения нуклеиновых кислот и кислоторастворимых компонентов является отделение компонентов, растворимых в холодной трихлоруксусной кислоте (аминокислоты, полипептиды, пуриновые и пиримидиновые основания, нуклеотиды и т. д.). Белки и нуклеиновые кислоты в этих условиях нерастворимы. Известное количество исследуемого препарата (10– 15 г), оставляют на 3-10 часов при -f- 4°С в контакте с 200 мл трихлоруксусной кислоты 5%. Затем смесь подвергают тщательному центрифугированию (1 час при 60000 об/мин), после чего надосадочную жидкость сливают для разделения.
С центрифугатом производят второе экстрагирование, но на этот раз уже с небольшим количеством (100мл) тихлоруксусной кислоты 5%. Центрифугирование повторяют и затем получаемую надосадочную жидкость приливают к первой. После этого центрифугат промывают 50 мл трихлоруксусной кислоты 5%, с последующим центрифугированием и отделением надосадочной жидкости (которую добавляют к первым двум надосадочным жидкостям).На центрифугате определяют нуклеиновые кислоты.
В надосадочной жидкости определяют кислоторастворимый азот.
Центрифугат. Центрифугат взвешивают в двойном объеме трихлоруксусной кислоты 5% и нагревают в течение 15 минут на водяной бане при 90°С. Целью этой операции является приведение в растворимое состояние обеих содержащихся в препарате нуклеиновых кислот (рибонуклеиновая кислота и дезоксирибонуклеиновая кислота). Одновременно с этим экстрагированием, нуклеиновые кислоты подвергаются частичному гидро- лизу, не препятствующему однако проведению последующих определений. После 15-минутного экстрагирования при нагревании, взвесь тщательно центрифугируют (1 час при 6000 об/мин), надосадочную жидкость осторожно сливают, а центрифугат подвергают повторному экстрагированию при нагреве.
Экстрагированные жидкости соединяют вместе и затем доводят до определенного объема (необходимо отметить, сколько мг общего N соответствует каждому 1 мл экстракционной жидкости, для проведения последующих расчетов). В этих экстракционных жидкостях при нагревании производятся определения нуклеиновых кислот.
Общие нуклеиновые кислоты определяют в виде пуринового N нуклеиновых кислот. Для этого, точно отмеренное количество (50 мл) экстракционной жидкости берут в горячем состоянии в колбу из нейтрального стекла и добавляют соответствующее количество концентрированной НС1 (5,5 мл), для того, чтобы получить нормальный раствор НС1. Колбу устанавливают на обратном холодильнике и в течение 2 часов при 100° С производят гидролиз жидкости. Все отделившиеся во время гидролиза пурины определяются в виде пуринового N.
Затем определенный пуриновый N пересчитывается в N нуклеиновых кислот, путем умножения полученных значений на 10. Это производится в предположении, что нуклеиновые кислоты являются тетрануклеотидами, имеющими – по Адлерсу – молекулярный вес 1 421.
Дезоксирибонуклеиновую кислоту (ДНК) определяют колориметрически с помощью цветной реакции, вызываемой дезоксирибозой в присутствии реактива Дише (1 г дифениламина для анализа, растворенного в 98 мл ледяной уксусной кислоты для анализа, к которой добавляют 2 мл концентрированной H2S04).
Точно отмеренное количество экстракционной жидкости (которое должно содержать 100 лг – 1 000 лг ДНК) разбавляют при нагреве в дистиллированной воде до 5 мл и затем добавляют 8 мл реактива Дише. Оставляют в течение 10 минут в горячей водяной бане, охлаждают и затем колориметрируют (желтая окраска).
Параллельно приготовляют серию контрольных образцов с разбавлениями ДНК известных концентраций (10, 50, 100, 200, 300.. .3 000 (хг). Для этой цели дезоксирибонуклеиновую кислоту разбавляют в ОД борном буферном растворе с pH 7. Фотоколориметрирование этих разбавлений дает возможность построить калибровочную кривую (на ординате отсчитывают в хг количества дезоксирибонуклеиновой кислоты, а на абсциссе – фотоколориметрически определяемые значения).
Экстраполируя на калибровочной кривой фотоколориметрические значения образца, определяют в лг количество присутствующей в исследуемом образце дезоксирибонуклеиновой кислоты. Учитывая исходное количество взятого препарата, а также число мл горячей экстракционной жидкости, на которой проводились определения, можно высчитать в мг количество дезоксирибонуклеиновой кислоты, присутствующей в 1 г исходного биологического препарата.
Рибонуклеиновую кислоту (РНК), присутствующую в исследуемом препарате, можно определить довольно просто в виде разницы между значением общих нуклеиновых кислот и значением дезоксирибоннуклеиновой кислоты. Однако, этот расчет характеризуется тем недостатком, что он является довольно неточным, так как нуклеиновые кислоты считаются простыми тетрануклеотидами с молекулярным весом 1 421.
Более точный способ определения рибонуклеиновой кислоты предложен Шмидтом и Таннгаузером, проводящими последовательные определения Р в препарате, из которого удалены кислоторастворимые и липидные элементы.
а) Удаление кислоторостворимого компонента обычно производят обрабатывая точно отвешенное количество препарата (0,5–5 г) 20 объемами трихлоруксусной кислоты 7%, охлажденной до 0°С. Взвесь взбалтывают механически в течение 20 минут, затем фильтруют через воронку Бюхнера, на которую кладут фильтровальную бумагу и слой целита (Кисельгур) для ускорения фильтрования. Затем препарат обильно промывают холодной трихлоруксусной кислотой 1% до тех пор, пока реактив Эмбдена уже не вызывает помутнения промывочной жидкости, подтверждая таким образом, что все количество минерального Р удалено. В этот момент приступают к обильному промыванию водой (для удаления кислоты) и затем спиртом и эфиром (для удаления воды).
б) Для удаления липидов вышеуказанный продукт отделяют от фильтра, взвешивают в 30–40 объемах смеси, состоящей из спирта (7,5 объемов) и эфира (2,5 объемов) и кипятят с орошением в течение нескольких минут. Фильтруют и промывают эфиром. Затем осадок растирают в ступке и взвешивают в 30–40 объемах смеси, состоящей из метанола (1 объем) и хлороформа (1 объем). Кипятят с орошением в течение 1/2 часа. Фильтруют и промывают эфиром и затем сушат в вакууме.
в) Полученный порошок экстрагируют точно отмеренным количество КОН н (по 10 мл на каждый 1 г свежего препарата). Экстракционный сосуд закупоривают резиновой пробкой и оставляют на 15 часов при 37°С, обеспечивая таким образом полное растворение препарата.
г) После удаления целита центрифугированием, в количестве 1–2 мл надосадочной жидкости определяют общий Р методом Бриггса.
д) Затем из надосадочной жидкости берут точно отмеренные 5 мл ц добавляют 1 мл НС1 6 н и 5 мл трихлоруксусной кислоты 5%. Образовав» шийся осадок содержит ДНК. При промывании этого центрифугата холод, ной трихлоруксусной кислотой 2,5% и затем при экстрагировании трихло» руксусной кислотой 5% в течение 15 минут при 90°С ДНК растворяется (в осадке остаются белки). Таким образом, в полученном растворе посред. ством метода с реактивом Дише (см. выше) можно определять, дезоксирибонуклеиновую кислоту.
Если на этом осадке определяют фосфор, то получается Р-ДНК. В случае различных тканей, в основном в случае бактерий, общий Р в надосадочной жидкости щелочного гидролизата (d) практически содержит только общий Р нуклеиновых кислот. В этих случаях разница: (общий Р) - (Р-ДНК) может служить для получения значения Р-РНК.
е) После удаления осадка РНК (см. выше, пункт д), определение общего фосфора надосадочной жидкости дает возможность определить Р-РНК, к которому добавляют фосфопротеиновый Р. Однако фосфопротеины содержат фосфор, который может осаждаться в виде двойного фосфата аммония и магния или в виде трикальциевого фосфата. Следовательно, фосфопротеиновый Р можно определять отдельно как неорганический Р.
В коническую центрифужную пробирку берут 5 мл определяемого раствора (надосадочную жидкость согласно пункту д) которые нейтрализуют концентрированным аммиаком (индикатор – фенолфталеин). Затем добавляют еще 0,2 мл аммиака, 1 мл раствора СаС12 2,5% и 1 мл водной взвеси карбоната магния 0,5%. Пробирку встряхивают, оставляют на 30 минут, снова встряхивают и затем центрифугируют. Осадок содержит неорганический Р, происходящий из фосфопротеинов. Этот последний можно снова растворить в трихлоруксусной кислоте, причем в образовавшемся растворе можно определить неорганический Р по методу Бриггса.
Разница между общим Р надосадочной жидкости и неорганическим Р дает значение Р-РНК.
Надосадочная жидкость. Общий кислоторастворимый N определяют в надосадочной жидкости, полученной при холодной экстракции исходного препарата трихлоруксусной кислотой 5%. Из этой надосадочной жидкости параллельно берут 2 образца по 1 мл и 5 мл, которые переводят в колбы Кьельдаля для минерализации. Содержимое количество азота определяют методом микрокьельдаля.
Свободный аминный N также определяют в надосадочной жидкости трихлоруксусной экстракции без нагревания, применяя метод Попе-Стевенса или ван Слайка.
Общий кислоторастворимый аминный N. Из надосадочной жидкости берут 2 образца по 10 мл, переводят в колбы из нейтрального стекла, добавляют по 1 мл соляной кислоты 5 н, получая окончательную концентрацию НС1 в н/1 и затем гидролизуют с орошением в течение 4 часов при 100°С. На таким образом полученном гидролизате проводят определение аминного N методом Попе-Стевенса или ван Слайка.
Аминный N кислоторастворимых полипептидов подсчитывают, вычитая значение свободного аминного N из значения общего кислоторастворимого аминного N.
Кислоторастворимый аммиачный N. Из надосадочной жидкости холодной экстракции берут 10 мл и переводят в колбу оснащенную барботирующей системой, вместе с 20 мл раствора NaOH 40%. Через эту смесь в течение 30–60 минут пропускают струю горячего воздуха (50–60°С). Воздух предварительно пропускают через серную кислоту для удаления аммиака. После того как струя воздуха пробарботировала смесь, она увлекается в известное количество (25 мл) серной кислоты 0,01 н. Путем титрования не нейтрализовавшейся серной кислоты (индикатор – красный нейтральный) можно подсчитать количество аммиачного N, присутствующего в исследуемом продукте.
Кислоторастворимый свободный пуриновый N обычно определяют непосредственным титрованием пуринового N в надосадочной жидкости холодной экстракции трихлоруксусной кислотой.
Общий кислоторастворимый пуриновый N определяют дозировкой пуринового N в надосадочной жидкости холодной экстракции после предварительной гидролизации с орошением надосадочной жидкости в течение 8 часов, в присутствии НС1 с нормальной конечной концентрацией.
Пуриновый N кислоторастворимых нуклеотидов. Из надосадочной жидкости холодной экстракции одновременно в центрифужные пробирки берут по два образца по 15 мл, к которым добавляют небольшое количество фосфата натрия (приблизительно 0,1 г). Смесь нейтрализуют (индикатор – метил красный), затем добавляют по 2 мл насыщенного раствора ацетата уранила. Образуется желатинообразный осадок, состоящий из ураниловых производных нуклеотидов и из фосфата уранила. Нуклеозиды и пурины остаются в растворе.
По истечении 24 часов образовавшийся осадок собирают центрифугированием и промывают 2–3 раза насыщенным раствором фосфата уранила. После промывания осадок растворяют в НС1 н. Затем кислый раствор подвергают в течение 4 часов гидролизу с орошением при 100°С.
После гидролиза отделившийся уранил удаляют слегка подщелачивая среду гидратом или аммиаком (индикатор – метил красный). Образующийся осадок щелочного ураната собирают центрифугированием и снова растворяют в разбавленной соляной кислоте. Затем производят повторное осаждение (подщелачивавшем), а таким образом полученную надосадочную жидкость присоединяют к первой.
Обе соединенные надосадочные жидкости содержат общее количество кислоторастворимых нуклеотидных пуринов, присутствующих в анализируемом образце. Их определение производят вышеописанным способом в виде пуринового N.