Физические основы интерференционной микроскопии
Микроскоп является одним из самых распространенных оптических приборов, нашедших широкое применение в биологии и медицине. Однако при помощи обыкновенного биологического микроскопа можно наблюдать только такие объекты и структуры, которые по отношению к окружающей среде поглощают свет в разной степени, то есть обладают некоторой естественной контрастностью.
Это обусловлено способностью человеческого глаза к восприятию структур, изменяющих интенсивность (а следовательно, и амплитуду) светового вектора проходящего через них луча. Если же амплитуда не меняется, а возникает только сдвиг фазы, зависящий от показателя преломления и толщины объекта, то он не виден или почти не виден под микроскопом. В связи с указанными причинами возможности исследования прозрачных и непоглощающих свет объектов с помощью световой микроскопии весьма ограничены. Однако именно этими свойствами обладают живые и неокрашенные фиксированные клетки и ткани.
Для увеличения контрастности биологических препаратов широко используется их дифференциальное окрашивание. Однако этот метод имеет ряд существенных недостатков. Во-первых, не все объекты и не все детали в них поддаются действию красителей. Во-вторых, при окрашивании трудно учесть изменения, вызванные обработкой клеток различными химическими агентами. В-третьих, данная методика мало пригодна дли изучения живых объектов из-за токсичности почти всех красителей, применяющихся в настоящее время.
Наблюдение неокрашенных живых и фиксированных клеток и тканей стало возможным с разработкой специальных методов увеличения их контрастности. К наиболее простым относится уменьшение диаметра диафрагмы конденсора, но при сильном диафрагмировании происходит ослабление освещения и снижение разрешающей способности микроскопа. Другим приемом, повышающим контрастность, является косое освещение. Этот способ, хотя и позволяет подчеркнуть рельеф, но не дает четкого соответствия изображения объекту. Метод темного поля (при косом и центральном падении света), выявляя лишь контуры объекта, может исказить его восприятие и вызвать ошибки, связанные с преувеличением контраста.
Более совершенными способами получения изображения прозрачных объектов являются открытые в 1893 г. интерференционный и в 1932 г. фазовый контрасты. Создателем первого метода является английский ученый Дж. Сиркс, второго— голландский физик Ф. Цернике. С помощью этих методов прозрачные объекты можно сделать видимыми путем превращения фазовых сдвигов, вносимых объектом, в амплитудные изменения, воспринимающиеся глазом. Интерференционная и фазовоконтрастная микроскопия весьма близки по своей физической сущности, но различны по техническому воплощению.
При фазовом контрасте световые лучи, претерпевшие изменения при прохождении через прозрачный объект, интерферируют в плоскости изображения с нерассеянными лучами, искусственно сдвинутыми по фазе с помощью специального устройства (фазовой пластинки). Следовательно, осуществление увеличения контраста при данном методе связано с необходимостью вмешательства в процесс образования изображения оптической системой микроскопа. Такое вмешательство не могло не привести к ряду существенных недостатков и ограничений метода. Так, хотя фазовоконтрастная микроскопия и позволила изучать живые клетки, их органоиды и включения, слабой ее стороной осталась небольшая четкость изображения тесно уложенных и примыкающих структур, плохое воспроизведение растянутых предметов со сравнительно большим поперечным размером, наличие ореолов вокруг изображения.
Более перспективным методом изучения живых и неокрашенных фиксированных клеток и тканей является интерфренционная микроскопия. Ее отличительная особенность заключается в превращении фазовых изменений в амплитудНЬ1е без вмешательства в процесс формирования изображения.
Луч света SA (рис. 1) расщепляется на два пучка зеркалом или кристаллом. Один из них ABCF проходит через исследуемый объект О (рабочий луч), другой ADEF— через среду М, в которой этот объект находится (луч сравнения). У световых волн, падающих на объект и среду, фазы колебаний одинаковы. Но, проходя через объект, рабочий луч начинает запаздывать по фазе относительно луча сравнения, причем величина этого запаздывания зависит от показателя преломления объекта и его толщины t. Вышедшие из препарата лучи приобретают, таким образом, разность хода. Оптически складываясь, они интерферируют, в результате чего прозрачный объект становится видимым. Возникшая вследствие различий в оптическом пути через объект и среду разность хода (сдвиг фазы), может быть измерена специальными устройствами.
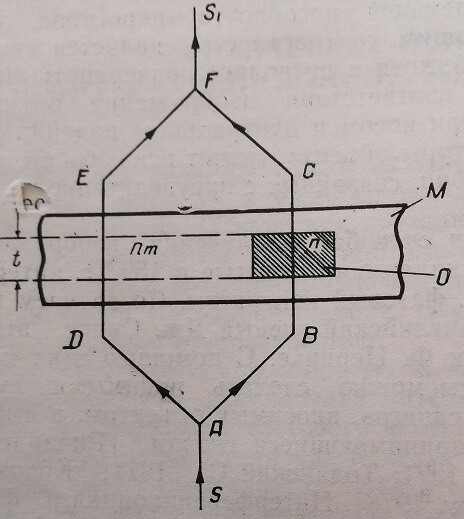
Рис. 1. Принципиальная схема интерференционного микроскопа. О — объект; М — среда; п, пт — показатели преломления объекта и среды; ABCF, ADEF — световые лучи; t — толщина объекта
Зная сдвиг фазы, можно вычислить показатель преломления, толщину и объем, содержание и концентрацию сухих веществ в клетке. Кроме того, интерференционная микроскопия дает возможность производить измерения, на основе которых могут быть определены такие параметры, как светопропускаемость, двойное лучепреломление, угол касания и другие физические величины. Основным достоинством интерференционной микроскопии является высокая точность измерения толщины и сухой массы объекта, хорошая воспроизводимость результатов, интерференционная микроскопия может использоваться как отдельный самостоятельный метод. Однако ее ценность значительно возрастает при сочетанном применении с гистохимическими исследованиями, так как дает основу для количественного выражения результатов. Благодаря перечисленным достоинствам, интерференционная микроскопия в последние годы находит все большее применение для изучения клеток и их структур.
Теория методов как фазового, так и интерференционного контраста базируется на векторном представлении Zernike (1934, 1952), которому Barer (1952, 1954, 1957) придал количественную форму и применил к интерпретации получения интерференционного изображения.
Преимуществом векторного изложения теории интерференционной микроскопии является то, что она позволяет представить графически общий принцип работы системы без применения сложных математических методов.
Из физической оптики известно, что свет – это электромагнитные волны, а любая волна характеризуется четырьмя параметрами: амплитудой, частотой, фазой и поляризацией. При прохождении света через вещество может изменяться любой из этих параметров. Например, абсолютно прозрачные объекты не влияют на амплитуду и интенсивность световой волны, а лишь изменяют ее фазу. Такие объекты называют «фазовыми», в то время как объекты, изменяющие амплитуду и интенсивность, – «амплитудными» (рис. 2).
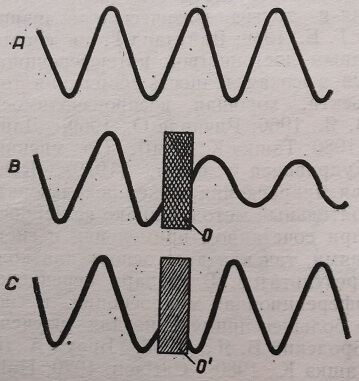
Рис. 2. Изображение световых волн, прошедших через прозрачный и непрозрачный объекты. Л, В, С – когерентные световые волны; О – амплитудный объект (непрозрачный) ; О1 – фазовый объект (прозрачный)
Свет, проходя через прозрачный объект, показатель преломления которого отличен от такового окружающей среды, меняет свою фазу так, что прибывает в данную точку либо с замедлением, либо с опережением по фазе по сравнению с волной, минующей объект, то есть зависит от толщины и показателя преломления объекта, который может быть либо больше, либо меньше, чем у среды.
Согласно теории Zernike (1934, 1952) и Barer (1952, 1954, 1957) световые колебания данной фазы и амплитуды можно представить вектором. Его длина пропорциональна амплитуде, а ориентация соответствует фазе колебания. Интенсивность света, как известно, определяется квадратом амплитуды.
Световая волна, изображенная на рис. 3 вектором 0\А, после прохождения через элементарный участок прозрачного объекта не изменит интенсивности. Следовательно, длина вектора сохранится постоянной. Но поскольку объект обладает коэффициентом преломления п, то волна изменится по фазе на некоторый угол <р. Поэтому прошедшая волна изображается вектором 0\Р. Аналогичным образом всем совершенно прозрачным частям объекта могут быть приведены в соответствие вектора (рис. 4), концы которых лежат на окружности с центром Оi радиуса 0\А. Последняя называется «кругом объекта».
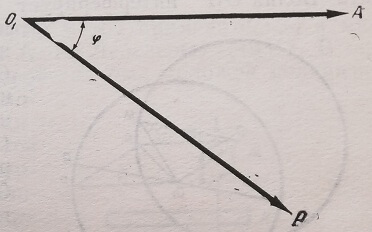
Рис. 3. Векторное изображение колебаний, проходящих через прозрачный объект
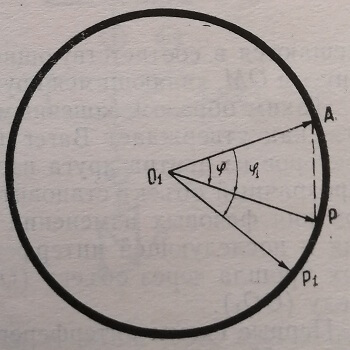
Рис. 4. Векторное изображение колебаний, прошедших через прозрачный объект
Вектора могут складываться и вычитаться по правилу параллелограмма. Поэтому вектор 0\Р может быть изображен как сумма векторов 0\А и АР. Физически это означает что прошедшая волна 0\Р, образуется в результате взаимодействия падающей волны 0\А с новой волной АР. Последняя создается объектом, поскольку возникает лишь в его присутствии, являясь светом, который диффрагировал на объекте и распространился, заполняя апертуру объектива. Проходя через объектив микроскопа, падающая волна, или волна фона, оптически складывается с волной, диффрагированной на каждой детали объекта, образуя изображение. Оно будет невидимым, так как глаз не воспринимает изменения по фазе, а различий по контрасту в данном случае не создается.
Zernike (1934, 1952) и Barer (1952) указали путь получения контраста прозрачных объектов почти без ухудшения качества изображения и разрешающей силы, что достигается введением разности фаз между прямой и диффрагированной волнами, проходящими через систему (рис. 5).
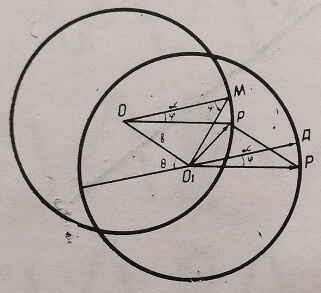
Рис. 5. Векторное изображение интерференционного контраста в общем виде
Падающая волна ОИ амплитуды а проходит через элементы фазового объекта. Прошедшая волна обозначается 0\Р. Круг с центром 0\ и радиусом 0\А является кругом объекта. Волна 0\Р интерферирует с другой когерентной (т. е. испущенной одним точечным источником) волной 0\0, имеющей амплитуду ь и разность фаз по отношению к падающей волне (СМ–180°–0). Результирующая двух волн ОхО и 0\Р, проходящих через оптическую систему, определяется по правилу параллелограмма и изображается диагональю 0\р параллелограмма ОхО рР.
Таким образом, конечным результатом получения контраста, как утверждает Barer (1952), является перенос начала векторов из центра круга изображения в новое положение О. Прозрачный объёкт становится видимым вследствие преобразования фазовых изменений в амплитудные путем соединения и последующей интерференции двух волн, одна из которых прошла через объект (ОР), другая через окружающую среду (001).
Первые схемы интерференционных микроскопов были созданы в 30-х годах нашего столетия А. А. Лебедевым (1931) и В. П. Линником (1933). В последующем были найдены многочисленные технические приемы получения интерференционного контраста.
В настоящее время оптическая промышленность производит интерференционные микроскопы около 40 различных типов, а их конструкций описано более 100. Принципиальные отличия этих конструкций заключаются главным образом в способе получения дополнительной интерферирующей световой волны от источника света, которым освещается объект.
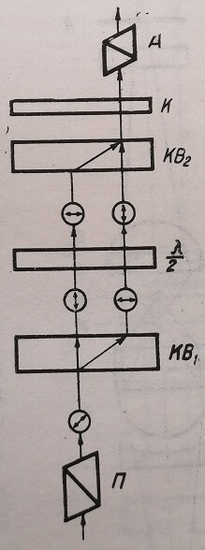
Впервые интерференционный метод применительно к микроскопии был осуществлен А. А. Лебедевым (1931). В основу разработанного им устройства был положен поляризационный интерферометр, а способ получения интерференционного контраста базировался на разделении луча в микроскопе с помощью двоякопреломляющих кристаллических пластинок. Схема прибора его конструкции приведена на рис. 6.
Рис. 6. Схема интерференционного микроскопа А. А. Лебедева. П – поляризатор; КВь, КВг – двоякопреломляющие пластинки; Я/2 – полуволновая пластинка; К – компенсатор; А – анализатор
Световой луч проходит через поляризатор 77, линейно поляризуется и раздваивается двоякопреломляющей пластинкой KBi. Далее оба луча пропускаются через полуволновую пластинку Х/2 и вновь соединяются, проходя через двоякопреломляющую пластинку КВ2, аналогичную первой. Направляясь затем через компенсатор, который служит для измерения разности фаз, и анализатор, который сводит колебания лучей в одну плоскость, они образуют световое поле, наблюдаемое через окуляр.
Если объект не вносит фазовых изменений в проходящую через него волну, то при скрещенных анализаторе и поляризаторе, поле остается темным, так как оба луча, интерферируя, гасят друг друга.
Если же сдвиг фазы, вносимый объектом, отличается от нуля, то на темном фоне появляется изображение объекта. В зависимости от величины сдвига фазы яркость изображения изменяется.
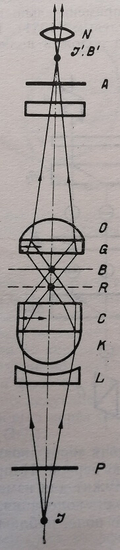
Этот же принцип был применен в конструкции двухфокусного интерференционного микроскопа, разработанного А. Н. Захарьевским и соавт. (1958) А. Н. Захарьевским, А. Ф. Кузнецовой (1961). Его экспериментальный образец схематично изображен на рис. 7.
Рис. 7. Схема двухфокусного микроскопа с кристаллическими двоякопреломляющими пластинками. I – источник света; Р – поляризатор; А – анализатор; L -– кварцевая отрицательная линза; К – конденсор; С – кварцевая пластинка; R, В – фокальные плоскости; О – микрообъектив, G – кальцитовая пластинка; N – окуляр
Луч света от источника поляризуется поляроидом Р и падает на слабую отрицательную кварцевую линзу L, помещенную в переднем фокусе конденсора К. Комбинация кварцевой пластинки С и конденсора К дает два изображения источника света, которые расположены в плоскостях R и В и поляризованы во взаимно перпендикулярных направлениях. На фронтальную линзу микрообъектива О наклеена кальцитовая пластинка G, вновь соединяющая изображения R и В в точке I'. Кварцевая отрицательная линза введена в схему для более точной компенсации взаимодействия пластинок С и G.
В случае, когда анализатор А скрещен с поляризатором в поле зрения наблюдается гашение света.
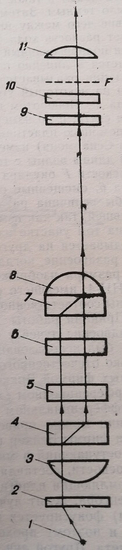
В последующем оптическая схема поляризационного микроинтерферометра Л. Л. Лебедева с некоторыми модификациями была положена в основу интерференционного биологического микроскопа МБИН- 4, выпускаемого в настоящее время отечественной промышленностью. Но подробное описание приведено в работах Г. Е. Скворцова и соавт. (1969), Ю. В. Коломийцова (1976).
Пучок лучей (рис. 8), вышедший из источника света 1, линейно поляризуется поляроидом 2, проходит через конденсор 3 и разделяется кальцитовой пластинкой 4 на обыкновенный и необыкновенный лучи, поляризованные в двух взаимно перпендикулярных плоскостях и следующие на некотором расстоянии друг от друга. Полуволновая пластинка 5 поворачивает плоскости поляризации проходящих через нее лучей на 90°, благодаря чему в кальцитовой пластинке 7 (той же толщины, что пластинка 4) обыкновенный луч направляется по пути необыкновенного луча, а необыкновенный следует по пути обыкновенного.
Рис. 8. Схема интерференционного биологического микроскопа МБИН-4. 1 - источник света; 2 – поляризатор; 3 – конденсор; пластинки; 5 – полуволновая пластинка; 6 - препарат; 8 – микрообъектив; 9 – пластинка в 1/4 Я; 10– анализатор; F – плоскость изображения препарата; И – окуляр
После прохождения через пластинку пучка лучей оптически складываются, при отсутствии аппарата они имеют нулевую разность хода. Поляроидом поворачивают в такое положение, чтобы поле зрения окуляра было темным. Затем в ход лучей вводят препарат 6, вследствие чего между интерферирующими лучками лучей возникает разность хода Ф, и из пластинки 7 выходит эллиптически поляризованный свет.
Пластинкой 9 в 1/4 X он превращается в линейно поляризованный. Однако плоскость поляризации оказывается повернутой к первоначальной плоскости на некоторый угол <р, зависящий от величины разности хода Ф. Поворотом поляроида 10 вновь добиваются погашения света, и по измеренному углу поворота <р определяют ф, С помощью пластинки 9 в 1/4 Я и поляроида 10 (компенсатор Сенармона) измеряют разность хода Ф в пределах от одной длины волны с точностью от 0,01 до 0,02Я. В фокальной плоскости F окуляра 11 наблюдают два изображения препарата 6, смещенные относительно друг друга.
Желательно, чтобы величина раздвоения изображения была как можно большей, так как измерение разности хода Ф возможно только на том участке изображения препарата, которое не накладывается на другое изображение. Лучшим является полное раздвоение, когда величина смещения изображения больше размера изображения. Величины смещения микроскопа МБИН-4, имеющего сменные объективы 40X0,65 и 40ХО, равны соответственно 0,165 и 0,330 нм.
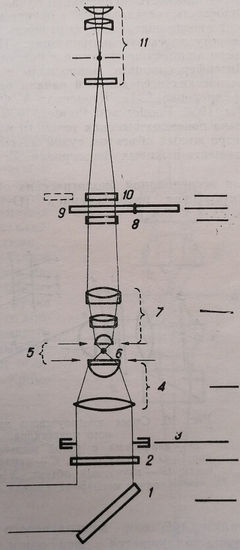
Принцип работы микроинтерферометра А. А. Лебедева (раздвоение лучей с помощью двоякопреломляющих элементов) был использован в интерференционных микроскопах не только отечественного производства, но и в приборах, выпускаемых фирмой Виккерс (Англия) и Оптон (ФРГ), в О А – интерференционном микроскопе фирмы Бейкер (США), в дифференциальном микроскопе фирмы Никон. Для иллюстрации можно привести схему интерференционного микроскопа фирмы Бейкер (рис. 9).
Поступающий в микроскоп когерентный свет поляризован в плоскости, составляющей 45° с осью осветителя. Двоякопреломляющая пластинка, наклеенная на фронтальную линзу конденсора, делит луч света на два. Один из них (луч сравнения) фокусируется в плоскости, расположенной выше объекта, и поэтому проходит в основном мимо исследуемого предмета. Другой луч следует через изучаемый объект. Двоякопреломляющий элемент, расположенный в объективе микроскопа, воссоединяет оба луча.
Рис. 9. Схема интерференционного микроскопа фирмы Бейкер. 1 – зеркало; 2 – поляризатор; 3 – ирисовая диафрагма; 4 – конденсор; 5 – двоякопреломляющие пластинки; 6 – препарат; 7 – объектив; 8 – пластинка в волны; 9 – анализатор; 10 – сменные светофильтры; 11 – окуляр
Воссоединенный луч направляется через пластинку в 1/4 X, превращающую эллиптически поляризованный свет в плоско поляризованный, затем проходит через анализатор, с помощью которого определяется плоскость поляризации луча. В отсутствие объекта эта плоскость составляет 45° с оптической осью микроскопа. Объект вносит определенную разность хода, что приводит к повороту плоскости поляризации. Измерения оптической разности хода осуществляется с помощью анализатора.
Интерференционные микроскопы этого типа для медико- биологических исследований начали применяться в 50-х годах. Уже в то время была показана высокая точность метода при определении диаметра живых объектов, сухой массы и концентрации плотных веществ в живых, фиксированных клетках и их структурах.
Для исследования биологических объектов используется и многолучевая интерференция. Принцип действия многолучевого интерференционного микроскопа заключается в следующем (рис. 10).
На параллельные плоскости S и С, обладающие высоким коэффициентом отражения, падает параллельный пучок монохроматических лучей.
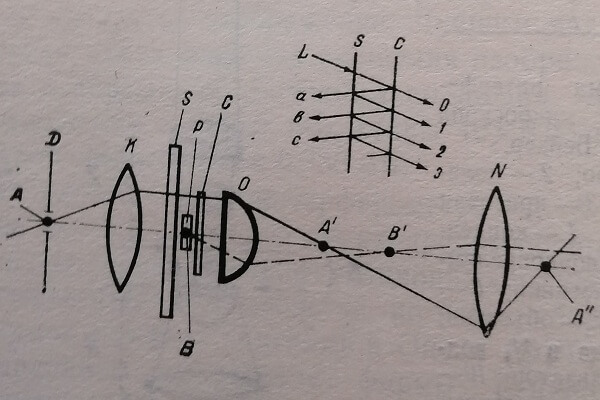
Рис. 10. Схема многолучевого интерференционного микроскопа. D - диафрагма с узкой щелью; К – конденсор; О – объектив; S, С – параллельные плоскости; Р – изучаемый объект; N–окуляр; L – пучок монохроматических лучей
Выходящие лучи 0, 1» 2, 3-й и т. д. усиливают друг друга и дают максимальную яркость, если разность хода между соседними лучами равна целому числу длин волн. При клоненных друг к другу отражающих поверхностях 5 и С интерференционная картина имеет вид узких светлых линий на темном фоне.
Изображение микроскопической частицы, помещенной между параллельными плоскостями 5 и С, имеет яркость, отличающуюся от яркости поля. При наклоненных плоскостях 5 и С интерференционные полосы на частице сдвинуты относительно полос в поле. В качестве плоскостей S и С используют предметное и покровное стекла с металлизированными поверхностями.
Недостатком многолучевой интерференционной схемы является необходимость применения параллельного пучка лучей. Для этого в фокусе конденсора К устанавливается диафрагма D с точечным отверстием, что уменьшает освещенность изображения. Кроме того, к недостаткам данного метода относится потребность в большом числе дорогих металлизированных стекол.
Следующим методом исследования прозрачных объектов являются ширинг-системы (системы сдвига) и интерференционные окуляры.
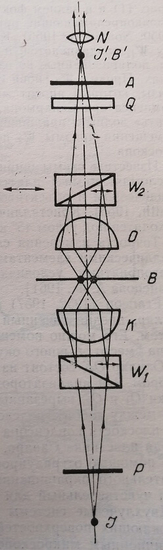
В ширинг-микроскопе в переднем фокусе конденсора (рис. 11) и в заднем фокусе микрообъектива О установлены двоякопреломляющие призмы Волластона Я и W2. Каждый луч, проходящий через призму W раздваивается, и через препарат В проходят два луча, поляризованные во взаимно перпендикулярных направлениях. Призма Wz снова соединяет раздвоенные лучи. Сдвиг фазы, который вносит микрообъект, измеряется с помощью компенсатора Сенармона, состоящего из пластинки Q в «четверть» волны и вращающегося анализатора А, или путем перемещения призмы W2 перпендикулярно оптической оси микроскопа.
Рис. 11. Схема ширинг-микроскопа с двоякопреломляющими призмами Волластона. К – конденсор; О – микрообъектив; W, Wi – двоякопреломляющие призмы Волластона; Q – пластинка в 1/4 волны; Р – поляризатор; А – анализатор; В – препарат; 1 – источник света
Известны схемы ширинг-микроскопов с плоскими двояко- преломляющими пластинками, расположенными между конденсором и объективом микроскопа. Кристаллические оси пластинок в этом случае находятся под углом 45° к их поверхностям.
Точность измерения сдвигов фаз в микроскопах с кристаллическими элементами достигает 1/50–1/100 а при благоприятных условиях даже 1/300 X.
Frangon (1952, 1957) сконструировал интерференционный окуляр, предназначенный для работы с поляризационным светом. Его можно помещать в тубус монокулярного микроскопа вместо обычного окуляра.
Окуляр О/С состоит из пластинки Савара (между поляризатором Р и анализатором А помещаются кварцевые пластинки Qi и Q2, вырезанные под углом 45° к оси и скрещенные между собой), полевой L и глазной N линз. В фокальной плоскости конденсора устанавливается узкая щель S или вторая пластинка Савара. Разность хода может быть измерена с помощью отградуированного компенсатора путем последовательного окрашивания объекта и окружающей его среды в чувствительный для глаз пурпурный цвет (рис. 12).
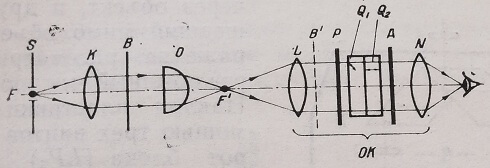
Рис. 12. Схема интерференционного окуляра Franon. S — диафрагма с узкой щелью; К — конденсор; В — препарат; О — объектив; L — полевая линза; N—глазная линза; Р — поляризатор; Л — анализатор; Qi, Q2 — кварцевые пластинки; О К — окуляр
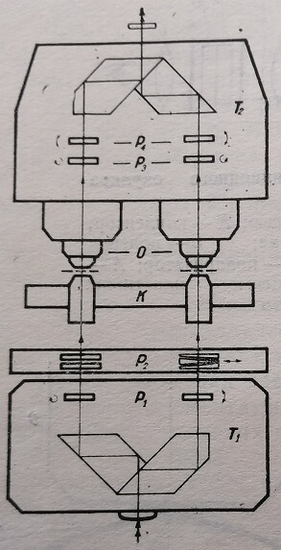
Двухлучевые системы с раздвоением лучей при помощи отражающих поверхностей могут быть представлены интерференционным микроскопом Dyson, выпускаемым английской фирмой Cooke (рис. 13). Раздвоение луча осуществляется частично алюминированными отражающими пластинками. Объект В заключен между предметным 5 и покровным С стеклами. Между стеклами Рч и С, а также между стеклами S и Р\ введена иммерсионная жидкость (вода или масло). Верхняя плоскость пластинки Pi полупрозрачная, а на нижней – имеется маленькая зеркальная площадка R.
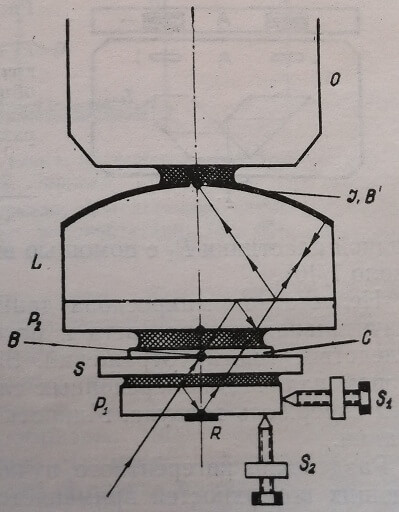
Рис. 13. Схема интерференционного микроскопа Dyson. В – объект; С – покровное стекло; S – предметное стекло; R – зеркало; L – сферическая линза с плотно аллюминированной поверхностью; 1 – непрозрачный участок сферической поверхности линзы L1, Р1, Р2 – пластинки с иммерсионной жидкостью; О – микрообъектив; Sj – измерительный винт; S2 – регулировочные винты
Одна из поверхностей линзы L сферическая, алюминированная, за исключением малого участка на оптической оси. Линза L приклеена к пластинке Рг, обе поверхности которой полупрозрачные. Верхняя плоскость пластинки Р находится посередине между объектом В и зеркалом R. Центр кривизны сферической поверхности линзы L лежит в плоскости зеркала R. Пластинки Р1 и Р2 представляют собою клины с малыми углами. В плоскости 1, где образуется изображение объекта, интерферируют два луча: один – прошедший через объект, и другой – прошедший мимо объекта. Изображение рассматривается через обычный микрообъектив О. Наклон пластинки Р помощью трех винтов S2 и поворот блока вокруг оси микроскопа позволяют изменять ширину интерференционных полос. Сдвиг фазы, вносимый объектом, вычисляется по величине перемещения клиновидной пластинки Р1 с помощью винта Si. Точность измерения около 1/40L.
Недостатком микроскопа данной конструкции является значительная потеря света и рассеянный свет, возникающие вследствие многих отражений. Затрудняет работу с микроскопом наличие иммерсионных слоев, поскольку они не должны содержать воздуха. Микроскоп очень чувствителен к вибрации.
Разделение когерентного пучка на два с помощью отражающих поверхностей применяется и в интерференционном микроскопе Leitz (рис. 14). Разделенные лучи проходят через различные микрообъективы и интерферируют; образуя интерференционно-контрастное изображение. Оно обусловлено разностью, хода лучей, один из которых прошел через объект, а второй через ветвь сравнения. Микроскоп этой конструкции позволяет за счет двух объективов измерить объекты больших размеров и с большей разностью хода, чем однообъективные микроскопы. Однако его недостатком является значительное расстояние между препаратом и конденсором, что не позволяет использовать конденсор с большой апертурой.
Рис. 14. Схема интерференционного микроскопа Leitz. Р1 – поляризаторы; Яг – клиновые компенсаторы; К – конденсоры, О – объективы; Р$, Рц–компенсаторы в виде пластинок; Т1 – призма для разделения лучей; Гг –призма для воссоединения лучей
Намного реже в медико-биологических исследованиях используются интерференционные микроскопы, предназначенные для изучения рельефа поверхности непрозрачных отражающих объектов.
Первый прибор такого типа был сконструирован В. П. Линником (1933). Его микроинтерферометр состоит из двух отражательных микроскопов с общим окуляром. Они дают совмещенные когерентные изображения: один – изображение исследуемого объекта, а другой – изображение плоского зеркала 3.
Таким образом, создается однородное поле, «проявляющее» фазовую структуру поверхности исследуемого объекта. Если зеркало 3 слегка наклонить, то изображение образует неоднородное полё с периодически меняющейся по координате фазой, а в плоскости изображения возникают интерференционные полосы. Их форма воспроизводит фазовую структуру изображения объекта, профиль его поверхности (рис. 15).
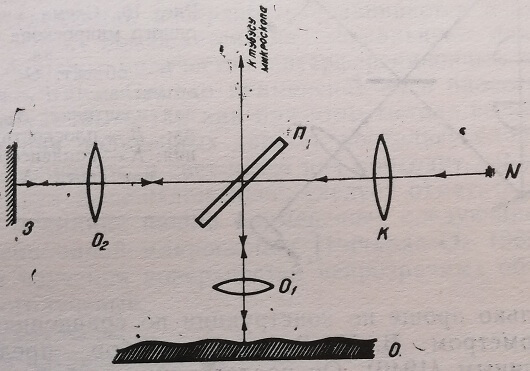
Рис. 15. Оптическая схема микроинтерферометра В. П. Линника. О – объект; 3 – зеркало; N – источник света; К – коллиматор; 0 – микрообъектив; О – объектив; П – пластинка, делящая луч света на два
Интерференционный микроскоп В. П. Линника применяется в машиностроении, и лишь отдельные исследователи с его помощью определяли толщину эритроцитов человека, структуру диатомей, упруго-объемные изменения в нерве при его возбуждении.
Несколько проще по конструкции по сравнению с микроинтерферометром В. П. Линника прибор, предложенный В. А. Савиным (1949). Он представляет собой соединение интерферометра с так называемым обратно-круговым ходом лучей и микроскопа (рис. 16). Объект В помещается между двумя идентичными микрообъективами 01 и 02. Полупрозрачная пластинка Р и зеркала Si и 5г расположены так, что два пучка проходят через объект в противоположных направлениях. Один из объективов сфокусирован на объект, а другой несколько расфокусирован. При этом один из интерферирующих пучков приобретает сдвиг фазы, вносимый объектом. Второй пучок лучей, идущих в обратном направлении, проходит мимо объекта и не изменяет фазы. После соединения пучков в плоскости изображения В' наблюдается интерференционная картина. Измерение сдвига фазы осуществляется с помощью специального компенсатора.
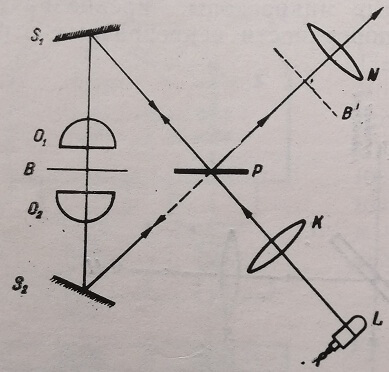
Рис. 16. Схема интерференционного микроскопа В. А. Савина. В – объект: Ои, 02 – микро объективы; Р – полупрозрачная пластинка; Щ – зеркала; В – плоскость изображения; К – конденсор; L – источник света; N – окуляр
Аналогичная система была разработана Philpot (1948).Для изучения поверхностей непрозрачных объектов используют как многолучевые, так и двухлучевые методы. При многолучевой интерференции когерентный монохроматический пучок света падает на оптически плоскую поверхность стекла, находящуюся в контакте с отражающей поверхностью. Вследствие ее неоднородности наблюдаются изменения в интерференционной картине.
Основной областью применения метода многолучевой интерференции при изучении непрозрачных объектов является исследование металлов, кристаллов и других сильно отражающих поверхностей. В медико-биологических исследованиях этот метод был применен Р. К. Даниловым, JI. И. Егоровой (1980) для определения толщины гистологических препаратов.)
При изучении непрозрачных объектов двухлучевыми методами исследуемая поверхность сравнивается с эталонной, для чего объект помещается на зеркальную поверхность. Описано большое количество интерференционных микроскопов данного типа. Однако применение их в биологии оказалось мало удачным, так как при этом методе весьма трудна интерпретация полученных данных, поскольку биологические объекты прозрачны, и свет через них проходит дважды.
Резюмируя вышеизложенное, следует отметить, что в биологии и медицине нашли применение следующие методы интерференционной микроскопии:
I. Для изучения поверхностей непрозрачных объектов:
А. Многолучевые.
Б. Двухлучевые.
II. Для изучения прозрачных объектов:
A. Многолучевые.
Б. Ширинг-системы (или системы сдвига) и интерференционные окуляры.
B. Двухлучевые системы:
а) раздвоение лучей с помощью отражающих поверхностей;
б) раздвоение с помощью двоякопреломляющих элементов.
Наиболее просты по конструкции и удобны в обращении интерференционные микроскопы с двоякопреломляющими элементами и ширинг-системы.
Интерференционная микроскопия в биологии и медицине применяется в основном для определения сухой массы и концентрации плотных веществ в клетках или их структурах.
Величина, непосредственно измеренная интерференционным микроскопом, есть разность оптического пути.