Титрование
Известно, что вещества реагируют между собой в эквивалентных количествах. В момент реакции 1 эквивалент вещества А реагирует с 1 эквивалентом вещества В. Следовательно, если мы возьмем 1 л 1 н. раствора вещества А, то для того, чтобы вещество А прореагировало с веществом В без остатка, потребуется тоже 1 л 1 н. раствора вещества В.
Если раствор вещества А будет 1н., а раствор вещества В будет 2 н., то для реакции с одним л раствора А потребуется 500 мл раствора В, то есть объемы различных растворов, количественно реагирующих между собой, обратно пропорциональны концентрациям этих растворов: У – объем раствора реагирующего вещества; N – нормальность раствора.
Это положение легло в основу титриметрических определений. Для определения концентрации одного из растворов (или количества вещества в данном растворе) необходимо знать точно объемы реагирующих растворов, точную концентрацию другого раствора и установить момент, когда два вещества прореагируют в эквивалентных количествах.
Процесс определения количества вещества или точной концентрации раствора (титра) объемно-аналитическим путем называется титрованием. При определении количества вещества объемным путем применяют те же правила, что и при установке титра. При титровании у нас имеется два раствора:
- Рабочий раствор – раствор, которым проводят титрование. Этот раствор прибавляют из бюретки, следовательно его точный объем измеряется бюреткой.
- Титруемый раствор – раствор, концентрацию которого определяют; объем титруемого раствора измеряется пипеткой.
Работа с пипетками
Пипетки бывают двух видов: пипетки Мора и пипетки градуированные. Градуированные пипетки применяют для отмеривания различных объемов жидкости.
Пипетки Мора предназначены для переноса определенного объема жидкости из одного сосуда в другой. Этими пипетками пользуются при отмеривании титруемого раствора.
Пипетка должна быть вымыта хромовой смесью до полного стекания воды, промыта водой из-под крана и несколько раз снаружи и внутри ополоснута дистиллированной водой из промывалки. После этого пипетку снаружи вытирают кусочком фильтровальной бумаги, а каплю воды, оставшуюся в кончике, выдувают.
Перед тем как отбирать пипеткой какой-либо раствор, ее споласкивают 1-2 раза небольшим количеством этого раствора. Для этого в пипетку всасывают немного раствора, вынимают пипетку из раствора и, держа горизонтально, вращают и наклоняют ее то в одну, то в другую сторону так, чтобы раствор омыл все внутренние стенки. После этого раствор из пипетки выливают в раковину. Если вовремя выполнения определенного анализа приходится отбирать пипеткой один и тот же раствор, нет необходимости каждый раз промывать пипетку.
Для наполнения пипетки жидкостью ее берут большим и средним пальцами и опускают нижний конец ее в жидкость; верхний конец пипетки берут в рот и всасывают жидкость в пипетку так, чтобы уровень ее поднялся выше метки. Быстро закрывают указательным пальцем верхнее отверстие пипетки, не давая вытекать жидкости. Вынимают нижний конец пипетки из жидкости и обтирают его снаружи кусочком фильтровальной бумаги, чтобы снять приставшие к нему капли. Держа пипетку строго вертикально, поднимают ее так, чтобы метка оказалась на уровне глаз, затем понемногу ослабляют нажим пальца на верхнее отверстие пипетки, чтобы жидкость медленно вытекала. В тот момент, когда нижняя часть мениска опускающейся жидкости коснется метки, опять плотно закрывают пальцем верхнее отверстие.
Ядовитые и сильно пахнущие жидкости, а также крепкие растворы кислот и щелочей рекомендуется отбирать резиновой грушей, присоединяя ее к верхнему концу пипетки. После наполнения пипетки выше метки грушу снимают и жидкость доводят до метки так, как было указано выше.
Для выливания жидкости из пипетки в какой-либо сосуд можно рекомендовать два метода:
- Прикасаются нижним концом пипетки к стенке сосуда, в который требуется вылить жидкость и, подняв палец, дают жидкости свободно вытечь из пипетки. Когда свободное вытекание жидкости из пипетки прекратится, оставляют конец пипетки в соприкосновении со стенкой еще в течение 15 с, слегка поворачивая ее, и вынимают пипетку. Не следует выдувать тот столбик жидкости, который остается в кончике пипетки;
- Держа пипетку близко к стенке сосуда, дают жидкости свободно вытечь из пипетки. Затем прикасаются кончиком пипетки к стенке сосуда, зажимают верхнее отверстие указательным пальцем, а левой рукой берутся за расширенную часть пипетки. От тепла руки воздух внутри пипетки нагревается и расширяется, а оставшаяся в кончике пипетки жидкость вытекает. Необходимо при работе с пипеткой всегда придерживаться одного и того же способа выливания жидкости.
По окончании работы пипетку тщательно промывают проточной водой, ополаскивают дистиллированной водой, помешают в специальный штатив или убирают в ящик лабораторного стола. Во время работы нельзя класть пипетку на стол, чтобы не загрязнить ее посторонними веществами. Отобрав очередную порцию раствора, пипетку ставят в штатив.
Работа с бюретками
Раствор, которым титруют, помещают в бюретку. Как и всякая мерная посуда, бюретка должна быть тщательно вымыта хромовой смесью и водой. Затем бюретка ополаскивается 3-4 раза дистиллированной водой и 3 раза небольшими порциями того раствора, которым она заполняется. Каждый раз после промывания дают жидкости возможно полнее стечь из бюретки. Затем бюретку наполняют раствором несколько выше верхней черты и открывают кран или зажим так, чтобы кончик бюретки наполнился раствором и вышли все пузырьки воздуха. Если из кончика пузырек не выходит, надо, согнув каучуковую трубку, поднять кверху кончик бюретки и открыть зажим. Пузырек быстро поднимается вверх и выходит. Если бюретка имеет кран, можно удалить пузырек, резко открыв кран и пустив большую струю раствора или при помощи резиновой груши.
После того, как бюретка подготовлена и уровень жидкости в ней находится немного выше нулевой черты, вынимают маленькую воронку, при помощи которой наполнялась бюретка, и доводят уровень жидкости в бюретке до нулевой черты. Бюретка должна находиться в строго вертикальном положении.
Для удобства отсчета за бюретку помещают лист белой бумаги, на фоне которого деления лучше видны. Глаз наблюдателя должен находиться на уровне мениска жидкости. При работе с раствором, имеющим густую окраску (раствор йода, перманганат калия), отсчет делений производят по верхнему краю мениска. Доводить уровень жидкости в бюретке до нулевой черты надо перед самым началом титрования. Каждый раз титрование новой пробы, необходимо наполнять бюретку раствором и доводить уровень жидкости до нулевого деления. Окончив титрование, надо сразу же записать объем раствора, пошедшего на титрование, более часто применяют бюретки объемом 25 мл, где каждое деление бюретки соответствует 0,1 мл, объем жидкости необходимо измерять с точностью до 0,03 мл. Для этого нужно расстояние между соседними делениями бюретки мысленно разделить на 3 части и положение мениска определить по отношению к этим воображаемым делениям (рис. 50). Если титрование ведется из бюретки объемом 50 мл, точность отсчета будет равна 0,05 мл.
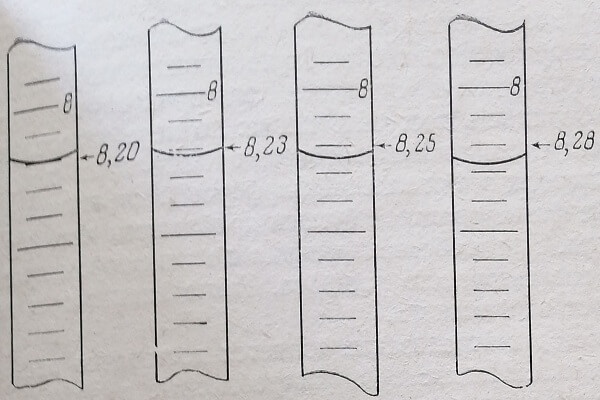
Рис. 50. Отсчет объема жидкости, выпущенной из бюретки
По окончании титрования оставшийся раствор надо вылить из бюретки, но не в склянку с титрованным раствором. После этого бюретку тщательно промывают проточной водой и прополаскивают дистиллированной водой. Заполняют бюретку до самого верха дистиллированной водой и закрывают сверху перевернутым маленьким стаканом или пробиркой. Если с бюреткой долго не будут работать, то ее тщательно моют под краном (особенно необходимо хорошо промыть кран и каучуковую трубку), ставят в штатив перевернутой или убирают в ящик и между пришлифованными частями крана и отверстия для него кладут полоску фильтровальной бумаги.
Индикаторы
При титровании употребляют не избыток реактива, а количество его, эквивалентное количеству определяемого вещества. Ясно, что необходимым условием при определении количества вещества титриметрически является точное установление того момента, когда заканчивается реакция между титруемым веществом и рабочим раствором, т, е. фиксирование точки эквивалентности. Чем точнее определяется конец реакции, тем точнее будет результат анализа.
Для определения конца реакции применяют особые реактивы, так называемые индикаторы. Действие индикаторов в большинстве случаев сводится к тому, что они по окончании реакции между титруемым веществом и рабочим раствором в присутствии небольшого избытка последнего претерпевают изменения и меняют окраску раствора или осадка. При прибавлении из бюретки такого количества рабочего раствора, которое вызывает заметное изменение окраски титруемого раствора, говорят, что достигнута точка конца титрования. Она может точно не совпадать с точкой эквивалентности. Но так как определение титра рабочего раствора проводят с тем же индикатором и в тех же условиях, что и сам анализ, несовпадение точки конца титрования с точкой эквивалентности практически не отражается на точности определения.
В различных титриметрических методах применяют различные индикаторы и причины изменения окраски титруемого раствора в точке конца титрования различны.
Некоторые индикаторы меняют свою окраску при изменении концентрации водородных ионов в растворе (pH раствора). Этой способностью обладают многие органические вещества, чаще всего красители. Такие индикаторы обычно употребляются при титриметрических определениях, основанных на реакции нейтрализации.
В определениях, основанных на реакции осаждения, применяют в качестве индикаторов растворы солей, дающие с веществом, из которого приготовлен титрованный раствор, окрашенное соединение. Лишняя капля титрованного раствора вызывает изменение окраски.
В некоторых случаях, например при титровании раствором перманганата калия, индикатор не применяется. Такой раствор сам окрашен, и первая капля титрованного раствора, которая не прореагирует с определенным веществом, будет окрашивать последний в розовый цвет.
Индикаторы обычно прибавляют в количестве нескольких капель или в отдельных случаях 1-2 мл.
В большинстве случаев индикаторы прибавляют к раствору исследуемого вещества и титрование происходит в присутствии индикатора. Такие индикаторы называются внутренними. Однако в некоторых случаях бывает необходимость поступить иначе: по мере титрования исследуемого раствора отбирают капилляром по капле раствора, к этой капле на фарфоровой пластине или кусочке фильтровальной бумаги прибавляют каплю индикатора. Таким образом реакция с индикатором происходит вне титруемого раствора. Такие индикаторы называются внешними.
Метод нейтрализации является достаточно распространенным. Индикаторы, употребляемые в этом методе, так называемые кислотно-основные индикаторы, меняют свой цвет при изменении pH раствора. Наиболее часто употребляются следующие индикаторы: метиловый красный, метиловый оранжевый и фенолфталеин.
Приводим способы приготовления растворов этих индикаторов.
Метиловый оранжевый: 0,05 г красителя растворяют в 100 мл воды; индикатор применяют в количестве 3-4 капель на 25 мл титруемого раствора.
Метиловый красный: 0,2 г красителя растворяют в 100 мл смеси, состоящей из 60 мл спирта и 40 мл воды; индикатор применяют в количестве 1-3 капель.
Фенолфталеин: 0,1 г красителя растворяют в смеси 70 мл спирта и 30 мл воды; индикатор применяют в количестве 2 капель.
Смешанные индикаторы. В некоторых случаях вместо одного какого-либо индикатора лучше применить
смесь двух индикаторов. При правильном соотношении между концентрациями индикатора и краски или двух индикаторов изменение цвета происходит резко при определенном pH. Примером является индикатор Ташира, представляющий собой смесь метилового красного и метиленового синего. При значениях pH раствора меньше 4 цвет этого индикатора фиолетовый, а при значениях больше 6 – зеленый. Можно рекомендовать множество таких смесей, способы приготовления которых можно найти в учебниках и справочниках по объемному анализу. К смешанным индикаторам относятся так называемые универсальные индикаторы, которые представляют собой смесь нескольких индикаторов, подобранных так, что цвет универсального индикатора меняется в большом интервале pH, причем каждое изменение pH на 0,5 или на 1 меняет цвет индикатора.
Техника титрования
Титрование производится в конических или так называемых колбах Эрленмейера (см. рис. 2). Размер колбы подбирается так, чтобы общий объем жидкости в конце титрования занимал не более половины объема колбы. Колба, особенно ее горло, должна быть вымыта хромовой смесью до полной стекаемости, тщательно промыта водой под краном и затем ополоснута 2-3 раза дистиллированной водой. Сам процесс титрования состоит в том, что из бюретки прибавляют титрованный раствор к другому раствору, находящемуся в колбе. Раствор из бюретки прибавляют до тех пор, пока количество прибавленного вещества не будет эквивалентно количеству вещества, находящемуся в колбе. Этот момент называется точкой конца титрования.
Перед началом титрования заполняют бюретку раствором так, как было указано в § 36, доводят уровень жидкости до нулевой черты. В коническую колбу помещают титруемый раствор и добавляют нужное количество индикатора. Затем проверяют правильность установки уровня жидкости в бюретке на нулевое деление. Это надо делать обязательно перед самым началом титрования.
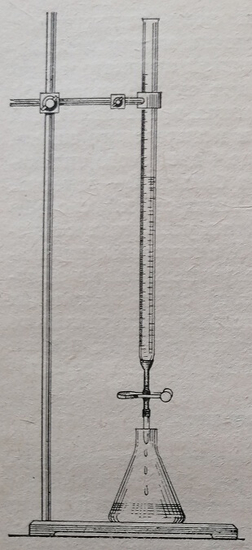
Подставляют колбу с титруемым раствором под бюретку. Кончик бюретки не должен находиться слишком высоко над колбой или опускаться слишком низко. Правильное положение при титровании показано на рис. 51.
Рис. 51. Положение колбы при титровании.
Под колбу надо положить лист белой бумаги, чтобы лучше отличитъ изменение цвета раствора. Колбу держат в правой руке, а левой открывают и закрывают кран или зажим, выпуская жидкость из бюретки.
При титровании раствор не должен выливаться из бюретки слишком быстро. Раствор должен вытекать по каплям, сначала быстрее, а вблизи конечной точки очень медленно. Во время титрования раствор в колбе надо все время перемешивать вращательным движением. Вблизи конечной точки титрования следует обмывать стенки колбы дистиллированной водой, особенно верхние ее части, где могут оказаться брызги реактива.
Когда изменение окраски раствора покажет, что наступил конец титрования, прекращают
прибавление раствора и определяют объем рабочего раствора, пошедшего на титрование (показание бюретки) (см. рис. 50).
Если при титровании наступает момент, когда нельзя сказать с уверенностью, достигнута конечная точка или нет, следует записать показания бюретки, прибавить еще одну каплю раствора и наблюдать, происходит ли заметное изменение в окраске титруемого раствора.
Записывать результаты титрования надо сразу в рабочий журнал, не допуская никаких черновых записей на листочках. Точность отсчета при титровании из бюреток на 25 или 50 мл соответственно 0,03 или 0,05 мл, поэтому записывают результаты титрования до второго десятичного знака (10,53 мл; 11,20 мл; 9,00 мл).
Необходимо брать такое количество исследуемого раствора, чтобы на титрование пошло не менее 1/3 объема бюретки, но не более полного объема бюретки, так как при доливании жидкости в бюретку увеличивается возможность ошибки отсчета. Наилучшие результаты получаются в том случае, когда при титровании из бюретки вместимостью 25 мл выливают от 10 до 20 мл титрованного раствора, а из бюретки вместимостью более 50 мл – от 20 до 40 мл титрованного раствора.
Для того, чтобы убедиться в правильности результатов титрования проводят так называемое параллельное определение. Для этого в другую коническую колбу помещают такое же количество титруемого раствора, наполняют бюретку рабочим раствором и повторяют титрование. Если результаты двух определений расходятся не более чем на 0,1 мл (для бюреток вместимостью 25 или 50 мл), их можно считать правильными. В случае расхождения полученных результатов титрование повторяется. В ответственных случаях проводят 3 параллельных определения. Для расчета берут среднее арифметическое из сходящихся результатов. Однако в рабочем журнале должны быть записаны все результаты параллельных определений (кроме явно испорченных).
Установка титра рабочего раствора
При помощи титрования можно определять количества различных веществ. Для того чтобы с помощью рабочего раствора рассчитать количество определяемого вещества, надо знать объем рабочего раствора, пошедшего на титрование, и его титр. Как определять объем рабочего раствора было сказано выше
Существует два метода приготовления титрованных растворов, то есть растворов точно известной концентрации.
1. Точная навеска, взятая на аналитических весах, растворяется в мерной колбе, т. е. готовится раствор, в котором известно количество растворенного вещества и объем раствора. Такие растворы называются растворами с приготовленным титром.
2. Раствор готовится приблизительно нужной концентрации, а точную концентрацию определяют титрованием, имея другой раствор с приготовленным титром. Титрованные растворы, точную концентрацию которых находят в результате титрования, называются раствором с установленным титром.
Рабочие растворы, как правило, готовят приблизительно нужной концентрации, а их точную концентрацию устанавливают. Необходимо помнить, что титр растворов с течением времени меняется и его надо периодически проверять через 1-3 недели (это зависит от вещества, из которого приготовлен раствор), т. е. титр раствора соответствует приготовленному ограниченное время.
Для определения точной концентрации рабочего раствора (установление титра) используют так Называемое исходное вещество, которое должно отвечать следующим требованиям:
- вещество должно быть химически чистым, практически не содержать примесей и точно соответствовать формуле; не должно быть гигроскопичным и быстро терять на воздухе кристаллизационную воду;
- вещество должно быть устойчивым в растворе: реагировать с рабочим раствором по строго определенному химическому уравнению и с большой скоростью.
При установке титра рабочего раствора необходимо помнить об одном из основных правил титриметрического анализа: титры рабочих растворов нужно устанавливать в тех же условиях, в каких будет выполняться анализ. Установку титра рабочего раствора можно проводить двумя способами:
1) по отдельным навескам – более трудоемкий и более точный способ. На аналитических весах берут 3 навески исходного вещества. При определении точной концентрации раствора рекомендуется брать такие количества вещества, на титрование которых используется примерно 15-20 мл титрованного раствора, однако навеска не должна быть менее 100 мг.
Взятую навеску аккуратно переносят в коническую колбу так, как переносят навеску при приготовлении точного раствора. Надо стараться, чтобы объем воды, использованный на обмывание бюкса и воронки, был не более 50-60 мл. Вращательным движением перемешивают содержимое колбы, пока навеска полностью не растворится. Полученный раствор титруют рабочим раствором, соблюдая все правила титрования;
2) по точному раствору – менее точный метод, 110 более быстрый, чем первый и чаще применяется на практике. Иногда устанавливают титр одного раствора по отмеренному объему исходного раствора, приготовленного по точно взятой навеске или из фиксанала. Необходимо только, чтобы концентрация определяемого рабочего раствора была примерно такой же, как и концентрация взятого исходного раствора. Определенное количество исходного раствора отмеряют пипеткой, помещают в колбу, в которой производится титрование и титруют рабочим раствором.
По результатам титрования рассчитывают точную нормальную концентрацию раствора, его поправочный коэффициент и титр по определяемому веществу. Установив точную концентрацию рабочего раствора, используют этот раствор для титриметрического определения различных веществ, определяемых с помощью данного рабочего раствора.
Расчеты при титриметрических определениях
Вычисление точной нормальной концентрации рабочего раствора. В основе вычисления точной нормальной концентрации лежит формула. Где V — объем раствора, а N — нормальность раствора.
Точную нормальную концентрацию высчитывают с точностью до четвертого десятичного знака.
Вычисление поправочного коэффициента. При выражении точной нормальной концентрации рабочего раствора часто применяют так называемый поправочный коэффициент. Это величина, на которую нужно умножить величину предполагаемой нормальности раствора, чтобы получить точную концентрацию раствора. Например, имеется приблизительно 0,1 н. раствора, для которого К=0,945. Следовательно, точная нормальная концентрация раствора равна 0,1x0,945=0,0945. Величину К находят, разделив определенную титриметрнческн нормальность раствора на величину предполагаемой нормальности раствора.
Титр обычно рассчитывают до четвертой значащей цифры.
Вычисление количества определяемого вещества. Как было сказано выше, приготовив рабочий раствор и определив его точную концентрацию, используют этот раствор для титриметрического определения количества различных веществ, которые можно титровать данным рабочим раствором.
Для этого определенное количество испытуемого раствора титруют данным рабочим раствором, определяют его объем пошедший на титрование и рассчитывают количество вещества по формуле
Р = I/Т,
где Р – количество определяемого вещества, г; V – объем рабочего раствора, пошедшего на титрование, мл; Т – титр рабочего раствора по определяемому веществу.
Титрование при микроопределениях
Микрохимические методы количественного анализа находят широкое применение в медицинских и биологических лабораториях, поэтому необходимо уметь пользоваться наиболее распространенными микробюретками и микропипетками.
Особая чистота микробюреток и микропипеток и посуды для титрования является необходимым требованием, предъявляемым к микроаппаратуре. Плохое отекание растворов делает результаты анализа неудовлетворительными. Чистку приборов и посуды производят хромовой смесью (иногда теплой), мыльной водой, реже спиртом и эфиром. Рекомендуется обработка посуды водяным паром. Признаком чистоты является хорошее стекание, полное отсутствие прилипания капелек к стенкам прибора.
Титриметрические методы и правила титрования при микроопределениях те же, что и при макроопределениях. Однако рабочие растворы используются более разбавленные, обычно 0,01 н.
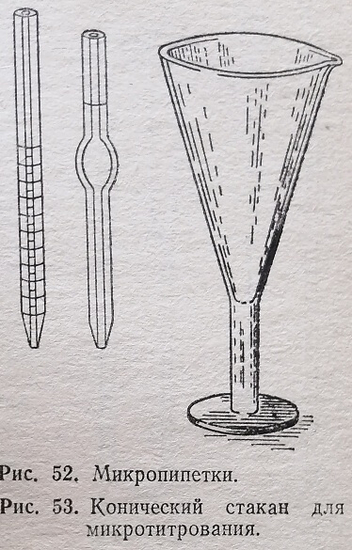
Микропипетки. Пипетки, применяемые в микроанализе, представляют собой толстостенные капилляры, объемом в 0,1-0,2 мл с делениями 0,01 или 0,001 мл (рис. 52). Для отмеривания 1-3 мл раствора имеются пипетки соответствующего объема с одной меткой. При работе с пипеткой соблюдают все необходимые правила. Однако во многих лабораториях для наполнения микропипеток, особенно при работе с вредными и едкими жидкостями, применяют вакуум.
Посуда для титрования. Титрование при микроанализе производят в конических стаканчиках (рис. 53) или в обыкновенных химических стаканчиках вместимостью 20-30 Мл. Маленькие объемы жидкости титруют в пробирках и микростаканах. Для перемешивания раствора во время титрования служат тонкие стеклянные палочки с шариками на концах.
Титрование при помощи микробюретки. Микробюретки бывают разных конструкций.
Абсолютно чистую бюретку ополаскивают 3-4 раза дистиллированной водой и 3 раза тем раствором, которым она будет заполняться. Для того чтобы промыть бюретку или заполнить ее раствором, наполняют сначала резервуар, затем открывают кран, и жидкость равномерно наполняет бюретку, поднимаясь вверх. Затем, открывая кран бюретки, устанавливают уровень раствора в бюретке на нулевом делении. После этого начинают титровать, выпуская раствор по каплям из бюретки. Капли раствора должны быть не более 0,01 мл.
Для уменьшения объема капель к выводной части микробюретки присоединяют встык с помощью кусочка каучуковой трубки тонкую стеклянную трубку, оттянутую в капилляр.
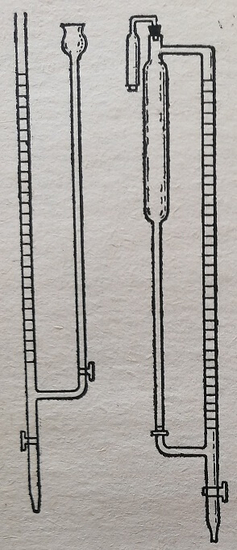
Микробюретка Банга непригодна для растворов, быстро изменяющихся от воздействия воздуха, так как в ее резервуаре нельзя продолжительное время сохранять такие титрованные растворы. Поэтому часто пользуются микробюретками с закрытым резервуаром, например, микробюретка Романа (рис. 55).
Рис. 54. Микробюретка Банга.
Рис. 55. Микробюретка Романа.
Проверка (калибрование) мерной посуды
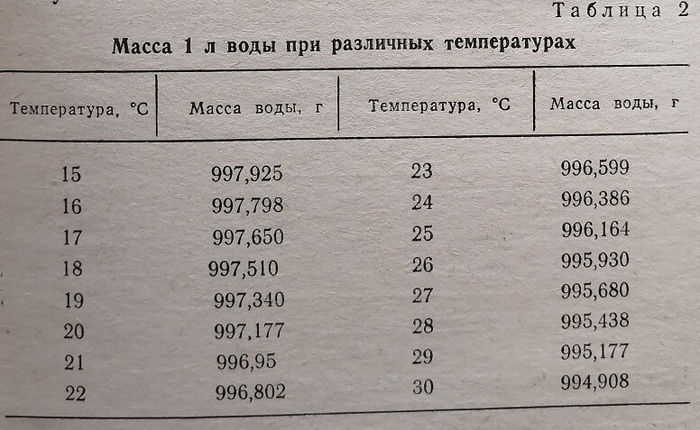
Перед употреблением каждая измерительная посуда должна быть обязательно проверена тем работником, который будет с ней потом работать. Аналитик всегда должен знать, насколько точна применяемая посуда, чтобы установить точность производимых анализов. Проверка измерительной посуды основана на определении массы чистой воды, которая либо налита в измерительную посуду, либо вылита из нее. Необходимо иметь в виду, что 1 л чистой воды имеет массу, точно равную 1 кг только при взвешивании в пустоте и при температуре 3,98°С.
Так как проверку производят при комнатной температуре и в воздухе, то при расчетах пользуются таблицей, в которой дана точная масса 1 л дистиллированной воды при различной температуре и нормальном атмосферном давлении. Перед калиброванием посуды надо очень тщательно вымыть ее и освободить от малейших следов жира. После этого посуде и той воде, которая будет применяться при калибровании, надо дать постоять некоторое время в комнате, чтобы температура той и другой сравнялась с температурой воздуха.
Для калибрования применяют обыкновенную дистиллированную воду. Температуру воды определяют термометром, градуированным на целые градусы, с точностью до 0,5°С.
Проверка мерных колб. Проверку мерных колб производят на технических весах с максимальной нагрузкой в 2 кг и чувствительностью в 0,01 г при максимальной нагрузке. Подлежащая калиброванию колба должна быть совершенно сухая. Для этого чистую колбу, после ополаскивания дистиллированной водой, ополаскивают 1-2 раза спиртом (х. ч.) или ацетоном (х. ч.). После этого колбу сушат в сушильном шкафу или током нагретого воздуха, профильтрованного через вату. После высушивания колбе надо дать остыть до комнатной температуры. Предназначенную для проверки мерную колбу помещают на левую чашку весов и уравновешивают ее другой тарой и дробью. Наполняют колбу дистиллированной водой точно до метки. Внутреннюю часть шейки колбы (выше метки) обтирают фильтровальной бумагой, свернутой в трубку. Снова колбу с водой ставят на левую чашку весов и уравновешивают весы добавлением на правую чашку гирь и миллиграммовых разновесов. Подсчитывают массу гирек, которая и равняется массе воды, налитой в мерную колбу.
Пример. Масса воды, налитой в мерную колбу, вместимостью 250 л равна 249,68 г. Температура воды – 19,5°С. В табл. 2 находим, что масса 1 л воды при этой температуре равна 997,27 г. Составляем пропорцию.Следовательно, истинный объем колбы 250,36 мл.
Проверка пипеток. Для взвешивания воды при проверке пипеток применяют маленькие конические колбы с притертыми пробками (50-100 мл) или большие бюксы. Пустую (совершенно сухую) колбу или бюкс взвешивают с точностью до 0,005 г. Далее наполняют пипетку дистиллированной водой точно до метки, выпускают жидкость в колбу или бюкс и взвешивают их вместе с водой. Вычитают из суммарной массы массу пустого сосуда и находят массу вылитой из пипетки воды. Проверку пипетки надо проводить три раза, причем результаты отдельных определений должны отличаться один от другого не больше чем на 0,01 г. Из полученных данных берут среднее арифметическое и производят расчет, пользуясь таблицей массы воды, при различной температуре.
Проверка бюреток. Предназначенную для проверки бюретку наполняют дистиллированной водой определенной температуры. Проверяют отсутствие пузырьков и доводят уровень воды до нулевой отметки. Взвешивают коническую колбу вместимостью 50-100 мл или бюкс с точностью до 0,005 г. Подставляют под бюретку сухую колбочку (или бюкс) и по каплям выливают из бюретки 10 мл воды с такой скоростью, чтобы вытекание происходило в течение 50-60 с. Закрыв кран, прикасаются кончиком бюретки к внутренней стенке колбы и вынимают оставшуюся на кончике каплю воды. Окончательно положение мениска в бюретке определяют спустя 30 с и отмечают точный объем вылившейся жидкости с точностью до 0,02 мл.
Колбу или бюкс с водой взвешивают на аналитических весах с точностью до 0,005 г, вычитают из этой массы массу пустой колбы (или бюкса) и таким образом находят массу воды, вылитой из бюретки. Затем проделывают все описанное выше, но выливают порцию воды от деления 10 мл до деления 20 мл в другую сухую колбу. Таким образом продолжают проверять бюретку с интервалами 5 или 10 мл, вплоть до ее последнего деления. Все определения повторяют затем еще раз. Проверяют расчет, пользуясь указанной выше таблицей. Расхождения между параллельными определениями не должны превышать 0,02 мл. По полученным данным составляют таблицу поправок данной бюретки.
Работающему с определенной бюреткой необходимо знать «цену капли», т. е. объем одной капли данной бюретки. В зависимости от величины отверстия носика бюретки объем вытекающей капли бывает различным. Определяют его следующим образом. Наполняют бюретку до нулевого деления, выпускают из бюретки 100 капель воды и отмечают новое положение мениска. Разделив объем вылитых капель на 100, получают объем одной капли. Обычно он колеблется от 0,02 до 0,05 мл. Таких определений объема капли рекомендуется сделать не менее трех и из них взять среднее.
Лупа – простейший оптический прибор, представляющий собой двояковыпуклую линзу, вставленную в оправу с держателем или укрепленную на штативе. С помощью такой линзы рассматривают объекты, находящиеся на близком от нее расстоянии. Лупа дает изображение объекта» увеличенное в 2, 3 и 5 раз. Более сильное увеличение можно получить при помощи системы, состоящей из двух или нескольких линз.