Система эритроцитарной фосфоглюкомутазы
Фосфоглюкомутаза (ФГМ) (КФ 2.7.5.1) является фосфотрансферазой, катализирует перенос фосфатной группы глюкозы из положения 1 в положение 6. Фермент широко распространен в живой природе, играет большую роль в метаболизме углеводов. Его активность проявляется не только в эритроцитах крови человека, но и различных органах и тканях, а также в некоторых выделениях.
Впервые генетически обусловленную гетерогенность эритроцитарной ФГМ выявили N. Spencer и соавт. (1964). После электрофореза гемолизатов эритроцитов различных лиц в крахмальном геле авторы наблюдали три различных изоферментных спектра, что дало основание высказать предположение о генетической природе такой полиморфности. N. Spencer и соавт. показали, что в гемолизатах эритроцитов можно выявить семь зон активности ФМГ: а, b, с, d, е, f и g (по возрастающей скорости миграции к аноду). Обнаружены три основные группы (или фенотипы) ФГМ, обозначенные ФГМ-1, ФГМ-2-1 и ФГМ-2. Они различаются между собой только по медленно мигрирующим изоферментам зон а, b, с и d. Быстро мигрирующие изоферменты зон е, f и g давали одинаковую электрофоретическую картину для всех трех типов. Большинство исследователей при выявлении групп ФГМ с помощью электрофореза в крахмальном геле используют две основные буферные системы: непрерывную «ТЭММ»-систему по N. Spencer и соавт. (1964) и прерывистую «ФТВ»-систему по G. Radam и Н. Strauch (1969).
Электродный буфер – непрерывная «ТЭММ»-система: 0,1 М триса, 0,1 М малеиновой кислоты, 0,01 М ЭДТА-Na (этилендиамин- тетраацетат натрия), 0,01 М MgCl2l до pH 7,4 буфер доводят раствором NaOH. Гелевым буфером служит электродный буфер с дистиллированной водой 1 : 10.
Прерывистая «ФТВ»-система. Электродный буфер: 0,33 М триса а 0,33 М винной кислоты, pH 7,4 (27,9 г триса и 15 г винной кислоты в 1 л дистиллированной воды). Гелевый буфер: 0,33 М фосфатного буфера, pH 7,2 (12,7 г КН2НР04 и 42,8 г Na2HP04 в 1 л дистиллированной воды). Этот основной 0,33 М фосфатный буферный раствор используют для получения гелевого буфера и непосредственно перед употреблением его разводят до концентрации 0,0029 М.
Электрофорез проводят при 4°С – минус 6°С в течение 16– 18 ч при напряжении 5–5,5 В/см2.
Активность ФГМ определяют в инкубационной смеси: 100 мл 0,2 М трис-HCl буфера, pH 8,0, содержащего 600 мг глюкозо-1-фосфата (Г1Ф) в виде натриевой или калиевой соли, 200 мг MgCl2, 20 мг НАДФ, 20 мг феназинметасульфата (ФМС), 20 мг тиазолие- вого или тетразолиевого МТТ (МТТ), 10 мкл глюкозо-6-фосфатде-гидрогеназы (Г6ФД) (0,4–1,0 ед). Инкубацию проводят при 37 °С в течение 1 х1%–2 ч до появления фиолетовых зон формазана в местах расположения электрофоретически разделенных групповых изоферментов ФГМ.
Для экономии дефицитных реагентов, входящих в состав инкубационной смеси, предложено использовать метод агаровой аппликации. Инкубационную смесь, состоящую из 25 мл 0,06 М трис- HCl буфера с pH 8,0 (6 мг НАДФ, ФМС и МТТ; 50 мг Г1Ф; 20 мг MgCl2 и 5 мкл Г6ФД), нагревают до 37 °С и смешивают с 25 мл 2% водного раствора агара, находящегося при температуре 50–55 °С. Затем смесь немедленно выливают тонким слоем на поверхность геля, продольно разрезанного в местах расположения изоферментов ФГМ, на участке 8–10 см к аноду от стартовых лунок. После наложения агаровой аппликации гель помещают во влажную камеру и инкубируют при 37 °С до появления фиолетовых зон в местах проявления активности ФГМ.
А. С. Гладких, А. В. Тюрин (1975) и А, В. Тюрин (1979) показали, что при использовании непрерывной «ТЭММ»-буферной системы изоферменты ФГМ лучше разделяются тогда, когда для приготовления гелевого буфера электродный буфер разводят дистиллированной водой в соотношении не 1 : 10, а 1 : 15. При применении преры* вистой «ФТВ»-системы наилучшее разделение достигалось в том случае, если на катоде используют трис-впнный электролит с 0,46 М триса и 0,2 М винной кислоты, а на аноде – в 2 раза меньшую концентрацию электролита. Для выявления группового полиморфизма ФГМ существуют и другие виды электрофореза: в гелях агара, агароаа, ПААГ и на ацетатцеллюлозных мембранах.
С помощью семейных обследований доказана генетическая обусловленность полиморфизма ФГМ. Появление трех фенотипов фермента (двух гомозиготных ФГМ-1 и ФГМ-2 и одного гетерозиготного ФГМ-2-1) обусловлено действием в генном локусе этой системы двух аутосомальных аллельных генов, обозначенных ФГМ1 и ФГМ2.
Уже при открытии изоформ ФГМ N. Spencer и соавт. (1964) обратили внимание на то, что у быстро мигрирующих вариантов ФГМ (е, f и g) не было полиморфности во всех трех типах ФГМ. На основании этого авторы предположили, что их появление контролируется другим, по-видимому, мономорфным генным локусом, обозначенным ФГМг. В соответствии с этим генный локус, аллели которого обусловливали полиморфизм ФГМ, назвали локусом ФГМ1, а два его основных аллеля – аллелями ФГМ\ и ФГМ21.
Дальнейшие исследования показали, что в генном локусе ФГМ\, помимо двух основных аллелей ФГМХ\ и ФГМ2\, содержатся редкие атипичные аллели, которые обозначили ФГМ31 – ФГМ8\. Эти аллели чаще находятся в генотипической комбинации с одним из основных аллелей. Таким образом, даже один генный локус ФГМ1 теоретически может обусловливать появление 36 возможных фенотипов этой ферментной системы. На практике же в основном встречаются атипичные фенотипы ФГМ, гетерозиготные по атипичному и одному из основных аллелей данного локуса, хотя уже найдены и редкие фенотипы, генотипически являющиеся гомо- или гетерозиготными па атипичным аллелям генного локуса ФГМ1 (например, фенотипы ФГМ-3-5, ФГМ-4-4 и др.).
О правильности генетической гипотезы N. Spencer и соавт. (1964) о существовании двух генных локусов системы ФГМ свидетельствует обнаружение генетически обусловленных вариантов фермента, различающихся только по быстро мигрирующим изоферментам е, f и g. По фамилии членов семьи, у которых впервые были выявлены эти атипичные наследуемые варианты ФГМ, их обозначили фенотипами ФГМ-1 (Atkinson) и ФГМ-2-1 (Atkinson). В настоящее время доказано, что в генном локусе ФГМг, кроме основного аллеля ФГМ'я, имеется еще по* крайней мере четыре редких атипичных аллеля: ФГМ22 – ФГМ\ . Эти аллели теоретически могут обусловливать появление еще 15 различных фенотипов ФГМ2.
Таким образом, система ФГМ является довольно сложной и полиморфной генетически детерминированной ферментной системой: во-первых, контролируется многочисленными алллеями в различных генных локусах, и, во- вторых, в каждом локусе имеются довольно редкие аллели, которые в комбинации с основными аллелями этой системы или в комбинации друг с другом обусловливают появление большого числа так называемых атипичных фенотипов ФГМ.
Большой научный и практический интерес вызвало открытие в плаценте, фибробластах и лейкоцитах крови человека генетически обусловленных вариантов ФГМ, не связанных с эритроцитарным полиморфизмом фермента. Поскольку данный полиморфизм не совпадал с эритроцитарными фенотипами ФГМ, контролируемыми аллелями генных локусов ФГМ1 и ФГМг, было высказано логическое предположение о существовании третьего генного локуса системы ФГМ, обозначенного локусом ФГМз.
Доказан простой кодоминантный порядок наследования лейкоцитарных, плацентарных или фибробластных групп ФГМ. Это свидетельствует о существовании в генном локусе ФГМз двух кодоминантных аллелей; их обозначили ФГМ‘3 и ФГМ2з. Эти аллели обусловливают генетическую реализацию трех фенотипов ФГМз, два из которых (ФГМз-1 и ФГМз-2) гомозиготны по соответствующим аллелям, а один (ФГМз-2-1) – гетерозиготен. Каких-либо редких атипичных аллелей в генном локусе ФГМз в отличие от генных локусов ФГМ1 и ФГМг до сих пор не обнаружено.
Три генных локуса системы ФГМ не являются тесно сцепленными. Более того, установлено, что генные локусы этой системы располагаются даже не на одной и той же аутосомальпой хромосоме, а на различных аутосомах. В настоящее время известно, что генные локусы системы ФГМ, и системы ФГД находятся либо па коротком плече, либо на проксимальном участке длинного плеча хромосомы № 1, в то время как генный локус системы тканевых антигенов HLA и генный локус ФГМз сцеплены и располагаются на хромосоме № 6.
Судебно-модицннекие эксперты, использующие генетически обусловленный полиморфизм системы ФГМ в экспертизах спорного отцовства, должны помнить, что групповые изоферменты а, Ь, с, d, е, f и g, являющиеся генетическими продуктами аллелей генных локусов ФГМ, и ФГМг, полиморфны не только в эритроцитах крови, н0 во всех тканевых клетках и большинстве выделений века, а полиморфизм системы ФГМз проявляется в лейкоцитах фибробластах и плаценте. (Это связано в первую очередь с тем, что подавляющая часть активности ФГМ контролируется локусами ФГМ1 и ФГМг (90–96% всей активности), а 5–10% активности – локусом ФГМз. В последние годы, правда, появились сообщения о возможности выявления группового полиморфизма ФГМз в лизатах сперматозоидов, а также эритроцитах крови человека, что представляет несомненный интерес с судебно-медицинской точки зрения.
Перспективность выявления групп ФГМз в сперме и крови человека для нужд судебной медицины очевидна. Поэтому при экспертизах желательно, по-видимому, не только использовать повышенную концентрацию реагентов, выявляющих активность ФГМ (в первую очередь глюкозо-1,6-дифосфата), но и применять неспецифические активаторы фермента типа неионных детергентов (тритон Х-100), а также некоторые меркаптосоединения.
Высокая частота встречаемости основных аллелей ФГМ в генных локусах ФГМ1 и ФГМз (аллелей ФГМ1 и ФГМ21, ФГМ*з и ФГМгз) среди населения Земного шара позволяет использовать полиморфизм этой ферментной системы в судебно-медицинских экспертизах, проводимых в делах, связанных со спорным происхождением ребенка. Например, вероятность исключения мужчины, не являющегося отцом ребенка, по одной только системе ФГМ1 в трех расовых группах, по данным К. Chakraborty и соавт. (1974), составляет 14,57; 14,76 и 13,44% соответственно» для европеоидных, монголоидных и негроидных популяций.
Средняя вероятность исключения отцовства только по» одной системе ФГМз среди этих популяций также достаточно велика: соответственно 15,54; 13,06 и 17,40%. Естественно, что одновременное выявление группового ферментною полиморфизма генных локусов ФГМ1 и ФГМ2 в гемолизатах эритроцитов и лейкоцитов крови проходящих по делу лиц значительно повысит информативность этой системы в судебно-медицинских экспертизах спорного отцовства.
Для выявления полиморфизма ФГМз в лейкоцитах нужно не менее 13 мл цельной крови, поэтому кровь у всех проходящих по делу лиц берут не из пальца, как обычно, а из вены. Для получения лейкоцитарной пленки кровь гепаринизируют и длительно центрифугируют. В результате на поверхности крови образуется белая пленка или слой лейкоцитов, его осторожно снимают и обрабатывают ультразвуком для получения лизатов лейкоцитов.
Главными условиями для четкого выявления групповых изоферментов ФГМз, обладающих очень низкой активностью и очень высокой скоростью миграции, следующие. Во-первых, электрофоретическое разделение нужно проводить в очень длинном (около 40 см) крахмально-гелевом блоке в течение довольно продолжительного времени (18–20 ч) при высоком градиенте напряжения (6–7 В/см). Во-вторых, из-за низкой активности изоферментов ФГМз в буферные растворы прерывистой «ТЭММ»-буферной системы непосредственно перед электрофорезом добавляют значительное количество Г1Ф, содержащего следы Г16ДФ, и НАДФ.
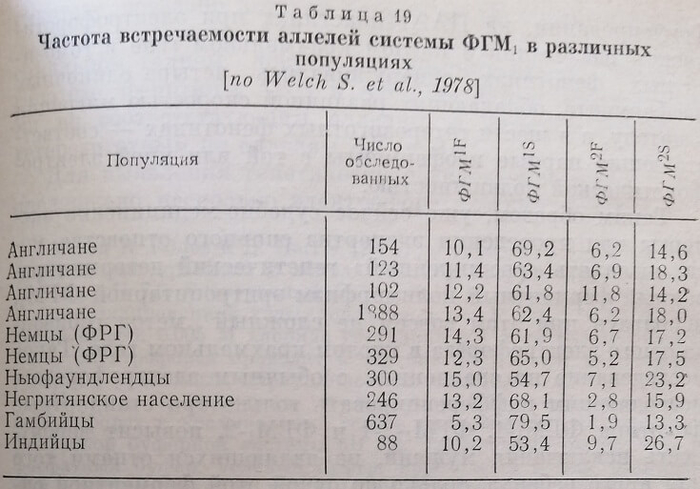
Частота встречаемости основных аллелей генных локусов ФГМ1 и ФГМз среди различных популяций варьирует незначительно и составляет в среднем для аллелей ФГМ1! 75%, ФГМ2! 25%, ФТМ'з 70% и ФГМ23 30%.
Схематическое изображение групповых изоферментов ФГМ, являющихся генетическими продуктами основных и атипичных аллелей всех трех генных локусов ФГМ1, ФГМ2 и ФГМ3, представлено на рис. 14.

Рис. 14. Схематическое изображение генетических продуктов трех генных локусов ФГМ1, ФГМ2, ФГМЪ [Hopkinson D., Harris Н., 1968].
Несомненный практический интерес для судебно-медицинских экспертов, использующих полиморфизм системы ФГМ для решения вопросов, связанных со спорным происхождением ребенка, представляет также наличие в генном локусе ФГМ1 атипичного «немого» аллеля ФГМ°. исключение возможности проявления которого может привести к ошибочным заключениям. Впервые действие этого аллеля и его наследственную передачу наблюдали Н. Fiedler и Н. Pettenkofer (l968) в одной немецкой семье. У одного члена данной семьи в гемолизатах эритроцитов крови отсутствовала активность ФГМ генного локуса ФГМ1 (групповые изоферменты а, b, с и d), выявлялась нормальная активность ФГМ генного локуса ФГМг (изоферменты е, f и g). У обоих родителей этого человека, имевших якобы гомозиготный фенотип ФГМ-1, наблюдалось резкое снижение интенсивности окрашивания изоферментов а и с, являющихся генетическими продуктами аллеля ФГМ1, активность ФГМ оказалась почти в 2 раза меньше, чем в норме.
Эти наблюдения, без сомнения, свидетельствовали о том, что отец и мать этот необычного по группам ФГМ лица были генотипически гетерозиготными по обычному аллелю ФГМ1! генного локуса ФГМ] и аллелю ФГМ0! этого локуса. Очевидно также, что своему ребенку отец и мать передали по наследству аллель ФГМ°1; их сын был генотипически гомозиготным ФГМ°1/ФГМ°1 по этому «немому» аллелю и обладал необычным фенотипом ФГМ-0.
G. Wendt и соавт. (1971) описали случай «противоположной» исключающей гомозиготности по аллелям ФГМ у одной женщины и ее дочери, причем возможность перепутывания ребенка в родильном доме полностью исключалась. Дочь имела слабовыраженый фенотип ФГМ-2, ее мать – слабовыраженный фенотип ФГМ-1, ее отец – нормальный фенотип ФГМ-2. Авторы также высказали предположение о наследственной передаче в этой семье «немою» аллеля от матери к дочери, правильность которого в дальнейшем была доказана обследованием родителей матери ребенка.
Поскольку частота встречаемости «немого» аллеля ФГМ°1 среди различных популяций еще не выяснена, по мнению О. Prokop и W. Gohler (1976), судебно-медицинским экспертам в случаях исключения отцовства или материнства по противоположной гомозиготности в системе ФГМ! всегда надо помнить о возможности наследственной передачи «немого» аллеля ФГМ0, маскирующего истинную готерозиготность мнимой гомозиготностью. Мы считаем, что судебно-медицинский эксперт во всех подобных случаях должен прежде всего обращать внимание на активность групповых изоферментов ФГМ у ребенка и его предполагаемого отца или у ребенка и его матери. При снижении интенсивности окрашивания групповых изоферментов ФГМ необходимо провести количественный анализ активности ФГМ в эритроцитах крови проходящих по делу лиц, а также расширенное исследование групп ФГМ у ближайших родственников «исключенных» отца или матери.
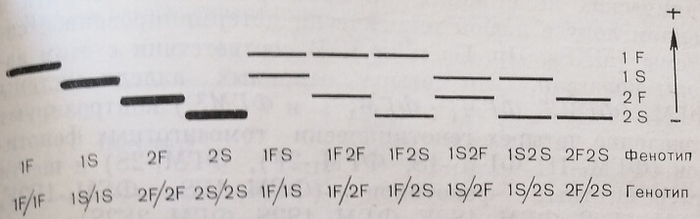
Через 12 лет после открытия генетически детерминированного полиморфизма эритроцитарной ФГМ, локуса ФГМ и признания правильности формально-генетической гипотезы наследования групп ФГМ1 J. Bark и соавт. (1970) с помощью изоэлектрического фокусирования на ПААГ-пластинах выявили «расширенную» полиморфность в зоне миграции четырех групповых изоферментов ФГМ1 (а, b, с и d), выявляемых электрофорезом в геле крахмала. Авторы обнаружили 10 различных комбинаций этих изоферментов (рис. 15). На основании наблюдений они предположили, что в генном локусе ФГМ1 существуют не два, а четыре основные аллеля: ФГМ}Р, ФГМIs, ФГМxF и ФГМ'? . В 10 различных комбинациях изоферментов были отмечены четыре единичные изофермента ФГМ1 с различной скоростью миграции и 6 различных парных комбинаций, в которых каждый изофермент ФГМ обладал тождественной скоростью миграции с одним из четырех указанных выше изоферментов. С другой стороны, число как раз и соответствовало числу возможных парных генотипических комбинаций четырех различных аллелей в генном локусе любой генетически детерминированной ситемы (MNSs, Нр, Gc и др.). В соответствии с этим авторы полагали, что четыре основных аллеля систра ФГМ! (ФГМ1/, ФГМIs, ФГМГ и ФГМР) контролируй появление четырех генотипически гомозиготных фенотипов и шести гетерозиготных фенотипов.
Рис. 15. Схематическое изображение 10 фенотипов фосфоглюкомутазы (ФГМО), выявляемых с помощью изоэлектрофокусирования в полиакриламидном геле.
Правильность новой формально-генетической гипотезы наследования групп ФГМ] в настоящее время доказана не только многочисленными семейными обследованиями, но и исследованиями пар мать – ребенок, гомозиготных близнецов, а также популяционно-генетическими обследованиями. Результаты последних свидетельствуют о тождественной частоте встречаемости в конкретной популяции двух «прежних» аллелей ФГМ\ и ФГМ2\ и четырех «новых» аллелей ФГМ1, ФГМ}s, ФГМ/ и ФГМ*? (имеется в виду сравнение суммарной частоты встречаемости «прежнего» аллеля ФГМХ\ и соответственно суммарной частоты встречаемости двух «новых» аллелей ФГМ1 и ФГМ™ с частотой встречаемости «прежнего» аллеля ФГМ21).
S. Welch (1978) наблюдал 33 так называемые «критические» родительские пары, в которых оба родителя имели соответствующие гомозиготные фенотипы ФГМг (29 родительских пар 1SX1S, одна родительская пара 1FX1F и 3 родительских пары 1SX2S). Все 69 детей, родившихся в этих семьях, имели единственно возможный для них гомо- или гетерозиготный фенотип ФГМ1 (59 детей с фенотипом 1S, 3 детей с фенотипом 1F и 7 детей с фенотипом (1S2S).
Частота встречаемости четырех основных аллелей системы ФГМ среди различных популяций представлена в табл. 19.
Хотя «расширенный» полиморфизм эритроцитарной ФГМ генного локуса ФГМ был открыт с помощью изоэлектрического фокусирования на ПААГ-пластинах, многие исследователи предприняли попытку использовать для этого обычные электрофоретические методы исследования. Так, P. Ktihnl и соавт. (1977) удалось впервые обнаружить полиморфизм ФГМ с помощью электрофореза в геле агарозы (результаты параллельного исследования одних и тех же образцов гемолизатов эритроцитов крови электрофоретическим и изоэлектрофокусическим методами были тождественными). Большой интерес представляют данные, полученные Bissbort и соавт. (1978).
Гемолизаты готовили путем трехкратного отмывания эритроцитов изотоническим раствором NaCl, центрифугирования, разрушения осадка толуолом и последующего повторного центрифугирования. Для электрофореза использовали непрерывную трис-гистидиновую буферную систему с pH 5,9. Электродный буфер: 0,25 ЛГ триса и 0,55 М водного раствора хлорида гистидина, доведенного до pH 5,9 1 NHC1. Гелевый буфер: электродный буфер, разведенный дистиллированной водой 1:35. Электрофорез проводили при +4–6°С 20–24 ч, напряжение 9 В/см. Зоны активности изоферментов определяли по методу N. Spencer et al. (1964), используя, агаровую аппликацию.
При такой технике электрофоретического исследования авторы отчетливо выявили все десять возможных фенотипов ФГМ каждому из которых соответствовала единственно возможная для него генотипическая комбинация. При этом групповые изоферменты ФГМ мигрировали от старта не к аноду, как обычно, а к катоду, в то время как изоферменты, являющиеся генетическими продуктами генного локуса ФГМ2, обладали анодной электрофоретической подвижностью. Наибольшей скоростью миграции к катоду обладал изофермент, являющийся генетическим продуктом аллеля ФГМ, затем – аллелей ФГМ\ъ ФГМ? и ФГМ1*. Так же как и при изоэлектрическомфокусировании, на ПААГ-пластинах при электрофорическом разделении в кислом крахмальном геле в гомозиготных фенотипах обнаруживались четыре одиночных изофермента, обладающих различной скоростью миграции к катоду, а в шести гетерозиготных фенотипах – соотвествующие парные изоферменты с той или иной электрофоретической подвижностью.
Таким образом, уже сейчас судебно-медицинские эксперты при проведении экспертиз спорного отцовства могут выявлять «расширенный» генетический детерминированный ферментный полиморфизм эритроцитарной ФГМ. используя при этом совсем не сложный метод горизонтального электрофореза в кислом крахмальном геле. Такое исследование по сравнению с обычным электрофорезом, позволяющим дифференцировать только три стандартные фенотипа ФГМ1-2-1 и ФГМ1-2, повысит вероятность исключения мужчин, не являющихся отцами того или иного ребенка, только по одной этой ферментной системе с 13–14 до 25-26%.