Система Gm
Система Gm была открыта R. Grubb (1956), а также R. Grubb и A. Laurell (1956). Эта система является одной из наиболее сложных генетических систем крови человека, включающей в себя большое число различных факторов, связанных друг с другом сложными генетическими отношениями.
Первая единая номенклатура факторов, фенотипов и аллелей Gm была принята в 1960 г. и в 1961 г. опубликован R. Grubb. Аллели обозначались Gma, Gmb и т. д. факторы – Gm(a), Gm(b) и т. д., фенотипы – Gm(a + b + ), Gm(a b-f-) и т. д. В 1965 г. ВОЗ приняла новую номенклатуру системы Gm. Согласно этой номенклатуре, аллели обозначаются Gm1, Gm и т. д., факторы – Gm (1), Gm (2) и т. д., фенотипы – Gm(l–2,5) и т. д. по числу исследованных факторов, наличие которых обозначается цифрой без минуса, а отсутствие – минусом перед соответствующим цифровым обозначением фактора. Факторы друг от друга отделяются в фенотипе запятой.

По-видимому, факторы Gm(3) и Gm(4), Gm(5) и Gm(12), Gm(13) и Gm(25) идентичны.
Необходимо отметить, что все факторы Gm являются подклассоспецифичными и каждый подкласс отличается специфичным полиморфизмом.
Для лучшего понимания генетики системы Gm попытаемся разобрать все ее подклассовые маркеры.
Все факторы системы Gm являются генетическими маркерами четырех подклассов IgG человека: IgG1, IgGa, IgG3, IgG4.
Генные комплексы системы Gm
Генетическое управление отдельными подклассоспецифичными факторами системы Gm происходит гаплотипично, т. е. все подклассе специфичные аллели системы Gm, контролирующие появление всех ее аллотииических маркеров, или факторов наследуются не по отдельности, а целыми генными комплексами.
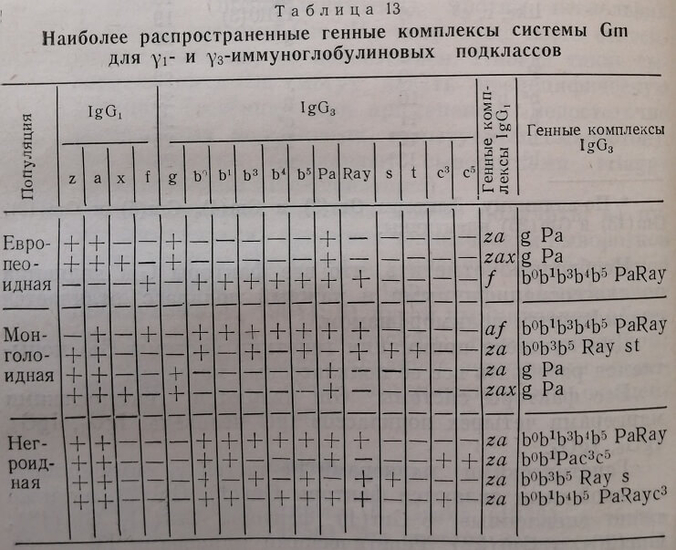
В этом плане сывороточная система Gm очень близка к эритроцитарной системе Ph и системе тканевых антигенов HLA. При этом следует также помнить, что все наиболее распространенные генные комплексы системы Gm четко разграничиваются по трем основным человеческим расам (европеоидной, монголоидной и негроидной). В табл. 13 приведены важнейшие генные комплексы системы Gm для подклассов IgG1 и IgG3 с учетом их встречаемости в трех различных расовых группах.Детальное ознакомление с данными табл. 13 дает судебно-медицинскому эксперту значительную информацию о возможности использования генных комплексов и генотипов системы Gm (а не отдельных факторов этой системы, как, к сожалению, до сих пор и исследовали) в экспертизах спорного происхождения детей.
Действительно, если ограничиться, например, исследованием только трех хорошо выявляемых факторов системы Gm: Gm(a), Gm(x) и Gm (f), то И тогда можно почти точно (если речь идет об европеоидных популяциях) устанавливать один из шести возможных генотипов Gm yi-иммуноглобулинов. На основании этого и будет решаться вопрос о возможности или невозможности рождения ребенка от определенной родительской пары. Отсутствие довольно редкой сыворотки анти-Gm(z) или анти-Gm (17), открывающей фактор Gm(z) или Gm(17), не будет при этом иметь никакого значения, поскольку в европеоидных популяциях наблюдается полная корреляция факторов Gm(a) и Gm(z), проявляющаяся их одновременным нахождением или отсутствием у того или иного лица.
Из табл. 13 видно, что в европеоидных популяциях для IgGi имеются только три аллельных сочетания, или генных комплекса, системы Gm: za, zax. Из этого следует, что все люди белой расы по системе Gm 71-иммуноглобулинов генотипически могут быть подразделены на шесть групп (табл. 14).

Для установления истинного генотипа Gm в данном случае могут быть использованы сыворотки анти-Gm (х), улавливающие «эффект дозы», т. е. значительно сильнее серологически взаимодействующие с факторами, антигенная реализация которых обусловлена соответствующими аллелями или аллельными сочетаниями в генных локусах двух гомологичных хромосом по сравнению с факторами, появление которых обусловлено действием соответствующего аллеля или аллельного сочетания в генном локусе только одной из двух гомологичных хромосом.
Каким же путем следует идти судебно-медицинскому эксперту при подборе сывороток анти-Gm (х), улавливающих «эффект дозы». Во-первых, ему прежде всего необходимо иметь в качестве образца сыворотку крови европеоида с фенотипом iGm(a+x+f+), который отражает его единственно возможную генотипическую характеристику zax/f. Этот генотип гетерозиготный, поскольку аллельный комплекс zax, антигенно реализующий появление фактора Gm(x) наряду с факторами Gm(a) и Gm(z) располагается в соответствующем генном локусе системы Gm лишь на одной гомологичной хромосоме, на другой же хромосоме в генном локусе Gm соответствующего аллельного комплекса, ответственного за реализацию фактора Gm(x), не имеется. Имея в распоряжении такую сыворотку, эксперт предельно разводит ее изотоническим раствором NaCl (приблизительно 1:30–1:40) и испытывает ее с имеющейся сывороткой (или сыворотками) анти-Gm(x) желательно низкого титра (1:4–1:8). При предельном разведении испытуемой сыворотки Gm с генотипом zax/j, после ее взаимодействия с сывороткой анти-Gm(х) и последующего добавления OR1o-эритроцитов, сенсибилизированных неполными антителами анти-Rho со специфичностью Gm(x), не наступает полной задержки агглютинации сенсибилизированных эритроцитов, а отмечается их микроагглютинация («песок»). В аналогичных условиях исследуют серию сывороток с фенотипом Gm(a-|-x+f–), которые генотипически могут характеризоваться как zajzax или же zax/zax. Если в некоторых образцах значительно разведенных сывороток Gmi(a-f-x-|-f–) наступает полная задержка агглютинации, а в других лишь значительное ее ослабление («мелкопесочная» микроагглютинация), то, вероятнее всего, примененная экспертом сыворотка анти-Gm (х) улавливает, по-видимому, «эффект дозы» и неодинаково реагирует с фактором Gm(x) при генотипах za/zax и zax/zax.
Такой путь подбора улавливающих «эффект дозы» сывороток анти-Gm(х), используемых в дальнейшем для выяснения истинного генотипа у лица с фенотипом Gm(a+x+f–), не единственный. Более сложным, но, пожалуй, наиболее правильным и гарантирующим верную оценку серологических свойств имеющихся в распоряжении сывороток анти-Gm (х) является несколько иной путь, заключающийся в следующем. Для того чтобы найти сыворотку анти-Gm (х), улавливающую «эффект дозы», в принципе нужно иметь для сравнения всего два образца сывороток Gm(x+): один – генотипически гетерозиготный zaxlf, другой – генотипически гомозиготный zaxlzax. Первый образец найти сравнительно просто, поскольку фенотип Gm(a+x+f+) отражает как раз единственно возможную гетерозиготную генотипическую комбинацию zax/f, а второй же – значительно труднее. Это объясняется тем, что фенотип Gm(a-{-x+f–), отражающий гомозиготную генотипическую комбинацию zaxlzax, может также соответствовать и гетерозиготному генотипу za/zax.
Как же в имеющихся образцах сывороток крови Gm(a+x-f-f–) точно узнать, какому из двух возможных генотипов zalzax или zaxlzax соответствует каждый из них? В этом случае эксперту может помочь только исследование крови родителей или ближайших родственников (братьев, сестер), лица, имеющего фенотип Gm(a-|-x-|- f–). Если, например, донор Gm(a+x+f–) имеет отца и мать с фенотипом Gm(a+x-|-f+), отражающим генотипическую комбинацию zaxlf, то этим самым доказывается, что их ребенок, имеющий фенотип Gm(a-(-x-(-f–), является генотипически гомозиготным zax/zax. Конечно же, такой поиск не прост, однако крупные судебно-медицинские учреждения совместно с учреждениями служб крови должны находить соответствующие образцы сывороток, необходимые для проведения контрольных исследований. Судебно-медицинский эксперт, имеющий в распоряжении генотипически гомо- и гетерозиготные образцы Gm(x+), сможет подобрать сыворотку анти-Gm(х), улавливающую «эффект дозы». Таким образом, с помощью трех сывороток анти-Gm (а), анти-Gm (х) и анти-Gm (f) можно четко диагностировать среди европеоидных популяций шесть возможных генотипов, обусловливающих появление аллотипических генетических маркеров, или факторов, Gm на 7-иммуноглобулиновых полипептидных цепях: Gm(a,l), Gm(x,2), Gm(f, 4) и Gm(z,17).
Обязательное комплексное исследование факторов системы Gm значительно расширит возможности при проведении экспертиз в делах о спорном происхождении детей. Продемонстрируем это следующим примером.
В настоящее время даже в крупных судебно-медицинских лабораториях нашей страны при использовании в экспертизах спорного отцовства системы Gm главным образом фактора Gm(a) и в лучшем случае совместно факторов Gm(a) и Gm(x) результаты исследования крови ребенка, его матери и предполагаемого отца оценивают изолированно, по отдельным факторам Gm, не принимая во внимание гаплотипичный порядок наследования алло-типических маркеров этой системы. При этом исходят из того, что в браках Gm(a^-)XGm(a–) и соответственно Gm(x–)XGm(xi) не могут родиться дети Gm(a-j-) и Gm(x+), а в браках Gm(a+)XGm(a+) или Gm(x-f)X XGm(x-f-) рождение детей Gm(a–) и Gm(x-) возможно.
Действительно, это так. Но это слишком упрощенный подход к законам наследования генетически обусловленных маркеров крови человека, основанный на недостаточно глубоком знании всех генетических особенностей системы Gm. Как, например, рассуждает неквалифицированный эксперт, обнаружив у матери ребенка и у предполагаемого отца фактор Gm(a), а у ребенка отсутствие этого фактора? Он делает вывод о том, что отцовство ответчика в отношении данного ребенка по фактору Gm(a) системы Gm не исключается. Обосновывает эксперт это тем, что, согласно законам наследования, у ребенка не может быть генетического признака, отсутствующего у его родителей, и, наоборот, может отсутствовать признак, имеющийся у обоих родителей. Знающий эксперт объяснит это более грамотно, поскольку он понимает, что любой фенотипически проявившийся генетический признак генотипически мог быть как гомозиготным, так и гетерозиготным по соответствующим аллелям. Если у обоих родителей ребенка имелся гетерозиготный генотип какого-то реализованного признака и если у обоих на гомологичной хромосоме в соответствующем генном локусе имелся аллельный ген, не обусловливающий реализацию этого признака, то каждый из родителей мог передать его по наследству своему ребенку, в связи с чем у него будет отсутствовать признак, имеющийся у родителей. Однако применительно к данному случаю квалифицированный эксперт отметит следующее. У ребенка с фенотипом Gm(a–) может быть единственно возможный гомозиготный генотип, причем один аллель он унаследовал от матери, другой – от отца. Далее опытный эксперт будет рассуждать приблизительно так. Фенотип Gm(a+), выявленный им у матери ребенка и его предполагаемого отца, в принципе означает лишь то, что оба они генотипически могут характеризоваться следующими пятью возможными комбинациями: za/za, za/zax, za/f, zax/zax и zax/f. У матери ребенка может быть, естественно, только один из двух возможных генотипов zalf или zaxlf, иначе это не ее ребенок. Истинный отец ребенка, или, как сейчас говорят, «биологический» отец, также должен иметь один из этих двух генотипов, в противном случае он не может быть отцом ребенка с фенотипом Gm(a–).
Таким образом, учитывая гаплотипичный порядок наследования факторов системы Gm, судебно-медицинский эксперт обязательно должен провести исследование крови ответчика на наличие фактора Gm(f,4), которое в данном случае может быть решающим, поскольку отсутствие фактора Gm(f,4) у ответчика исключает его в качестве отца этого ребенка. Это же сочетание – мать Gm(a-j-), ребенок Gm (a-S) – можно использовать (естественно, наряду с другими генетически детерминированными системами крови) для выяснения вопроса о возможном перепутывании или замене детей в родильных домах.
Отсутствие в крови матери 7-иммуноглобулинового фактора Gm(f,4) при наличии фактора Gm (а, 1) фенотип Gm(l,4) исключает ее материнство по отношению к ребенку, имеющему фенотип Gm(1,4).
Приведем еще один пример, демонстрирующий важность знаний гаплотипичного характера наследования факторов системы Gm для решения судебно-медицинских вопросов о спорном происхождении ребенка.
Ребенок имеет фенотип Gm(a-f-x-|-f–), мать ребенка – фенотип Gm(a-|-x+f-f-), ответчик – фенотип Gm(a-j-x+f–). Если же оценивать эти данные изолированно по отдельным факторам системы Gm, то эксперт сделает вроде бы безошибочный вывод о том, что отцовство ответчика в отношении данного ребенка с учетом исследования трех факторов системы Gm [Gm(a), Gm(x) и Gm(f)] не исключается. Однако этот вывод вытекает из устаревших воззрений на генетическую природу наследования факторов системы Gm и в настоящее время не может быть признан правильным. Сейчас, когда в результате многочисленных популяционно-генетических исследований расширились и углубились знания о наследственной передаче генетических маркеров системы Gm, вправе требовать от судебно-медицинских экспертов более конкретных выводов в отношении возможности или невозможности рождения ребенка от упомянутой выше родительской пары.
Эксперт должен понимать, что ребенок и предполагаемый отец этого ребенка с фенотипом Gm(a-{-x-|-f–) могут иметь два возможных генотипа zaxlzax или za/zax а мать ребенка, имеющая фенотип Gm(a-f-x-f-f+), обладает единственно возможной для нее генотипической комбинацией zax/f. При этом ребенок, не имеющий в у-иммуно-глобулиновом наборе фактора Gm(f), мог получить от матери только ту хромосому, в соответствующем генном локусе которой содержится аллельное сочетание, или генный комплекс, ответственный за появление факторов Gm(a) и Gm(x), т. е. zax. Другую же хромосому, несущую генную информацию для обоих факторов Gm(a) и Gm(x) или же только для одного фактора Gm(a), он получил от отца. Итак, мать передала ребенку генный комплекс zax, его отец – либо zax, либо za. Сложилась весьма любопытная ситуация, при которой чрезвычайно важно знать истинные генотипы ребенка и его предполагаемого отца. Действительно, если эксперт сумеет доказать, например, тождественность генотипических комбинаций ребенка и его предполагаемого отца (za/zax или zax/zax), то ответчик не может быть исключен в качестве отца ребенка. В противном случае при несовпадении генотипических комбинаций ребенка и его предполагаемого отца (zax/zax у ребенка и za/zax у предполагаемого отца и наоборот) отцовство ответчика в отношении данного ребенка исключается. На что в этом случае должен обращать внимание судебно-медицинский эксперт? Естественно, на характер реакции сыворотки анти-Gm (х), улавливающей «эффект дозы», с образцами сывороток крови всех проходящих по делу лиц.
В данном случае большое значение имеет выраженность торможения агглютинации сенсибилизированных эритроцитов со специфичностью Gm(x) сывороткой крови матери ребенка, поскольку только на одной ее хромосоме имеется аллельный комплекс, ответственный за появление фактора Gm(x). Сравнивая выраженность фактора Gm(.x) в крови ребенка, его матери и предполагаемого отца (па выраженности задержки агглютинации), эксперт может получить весьма ценные данные о генотипах системы Gm ребенка и ответчика и в зависимости от этого решить вопрос, может ли ответчик быть отцом ребенка или же его отцовство исключается. Например, если выраженность фактора Gm(x) у ребенка и его матери будет приблизительно одинаковой, а у предполагаемого отца значительно выше чем можно будет судить по реакции с сывороткой анти-Gm (х)], то это свидетельствует о том, что ребенок и ответчик хотя и имеют одинаковый фенотип Gm(a-|-x+£–), однако обладают различными генотипическими комбинациями, причем если у ответчика имеется гомозиготный генотип zax/zax, то у ребенка он гетерозиготный za/zax.
На основании логических размышлений и учитывая характер серологических реакций, в данном случае эксперт должен исключить ответчика в качестве отца ребенка. Мы уже знаем, что мать ребенка с генотипом zax/j передала ему генный комплекс zax. Ее ребенок, имеющий гетерозиготный генотип za/zax, генный комплекс zax получил от матери, а генный комплекс za мог получить только от отца. Ответчик же, генотипически гомозиготный zax/zax, не мог передать ребенку генный комплекс za, поскольку он отсутствует в его генотипическом наборе. Следовательно, ответчик исключается в качестве отца ребенка.
Поскольку такой вывод является чрезвычайно ответственным, эксперт должен точно установить генотипическую гомозиготность ответчика (zax/zax), исключающую его отцовство. При этом иногда эксперту может помочь исследование крови родителей ответчика. Действительно, если ответчик с фенотипом Gm(a-f-x-|-f–-) (возможные генотипы zax/zax или za/zax) имеет отца и мать с фенотипом Gm(a-j-x+f+) (единственный возможный генотип zax/f), то этим самым доказывается генотипическая комбинация zax/zax и исключается возможность генотипической комбинации za/zax.
Приведенные примеры убедительно свидетельствуют о перспективности использования генетически обусловленного полиморфизма системы Gm (даже одного Yi-иммуноглобулинового подкласса!) для судебно-медицинской экспертизы спорного происхождения детей. Однако, помимо четких и глубоких знаний генетических особенностей системы Gm, оно требует от эксперта и высокой квалификации, позволяющей избежать возможности ошибочно интерпретировать результаты реакции задержки агглютинации. Приведенные примеры демонстрируют также исключительную ценность расширенного исследования гаплотипичного набора генетических маркеров систем Gm у родителей и ближайших родственников лиц, проходящих по делу в связи со спорным происхождением ребенка. Такое исследование очень часто (приблизительно в 50% случаев) дает информацию о генотипическом наборе ребенка, его матери и предполагаемого отца, без знания которого решение вопроса о возможности рождения ребенка от конкретной родительской пары не представляется возможным.
Использование исключительно широкого Gm-полиморфизма уз-иммуноглобулинового подкласса [факторы Gm(g,21), (Ь°Д1), (Ь1,5), (Ь3ДЗ), (Ь4,14), (Ray «не-маркер»), (s,15), (t,16), (с3,6), (с5,24)] из-за трудности получения и крайней редкости большинства антисывороток, выявляющих эти факторы, не нашло пока широкого применения в судебно-медицинских экспертизах в делах о спорном происхождении ребенка. Это, правда, не относится к антисыворотке анти-Gm (10), выявляющей в сыворотке крови людей фактор Gm(b5,10). Достаточно отметить, что многие зарубежные фирмы, институты и лаборатории, изготавливающие для диагностит ческих целей иммунные серологические препараты и реагенты, выпускают даже так называемую «сцепленную» антисыворотку анти-Gm (f, Ь5,4,10), выявляющую оба фактора Gm(4) и Gm(10), несмотря на то что последние располагаются на разных полипептидных цепях у-иммуноглобулинов.
Результаты многочисленных популяционно-генетических обследований, проведенных в различных расовых популяциях, свидетельствуют о том, что фактор Gm(10) наряду с факторами Gm(l), Gm(2) и Gm(4) должен найти широкое применение в судебно-медицинских экспертизах спорного происхождения детей. Учитывая эти генетически обусловленные маркеры системы Gm у представителей трех рас, можно выявить основные аллельные сочетания, генные комплексы или гаплотипы, которые передаются ребенку от его родителей. По этим основным гаплотипам системы Gm можно определить число основных генотипических комбинаций, на основании которых и решается вопрос о возможности или невозможности рождения ребенка от определенной родительской пары.
Например, европеоиды характеризуются тремя основными гаплотипами системы Gm 1, 1,2 и 4,10 с частотой встречаемости соответственно 18–20, 2–10 и 65-70%.
У монголоидов возможны четыре гаплотипа, два из которых (1 и 1,2) свойственны также и европеоидам, а два других (4,4,10 и 1,10) у европеоидов не встречаются. Данные антропологической популяционной генетики свидетельствуют о том, что частота встречаемости этих четырех гаплотипов среди различных монголоидных популяций значительно варьирует и составляет для гаплотипов 1; 1,2; 1,4,10 соответственно 20–70, 2–10, 10–100 и 10-25%. В негроидных популяциях, как отмечалось выше, отсутствуют факторы Gm(x,2) и Gm(f,4), поэтому гапло-типичный набор генных комплексов с учетом всех перечисленных факторов системы Gm будет несколько скуднее. Он включает три основных гаплотипа 1,5,10, 1 и 1,10, причем гаплотип 1,5,10 преобладает, а гаплотип 1,10 крайне редок и наблюдается лишь у бушменов.
Для нашей многонациональной страны, в которой проживают не только многочисленные народы и нации, но и огромное число людей, родившихся от «смешанных» браков, знание экспертами основных гаплотипов системы Gm, особенно характерных для европеоидных и монголоидных популяций, является обязательным. Без этого в настоящее время нельзя уловить генотипические комбинации системы Gm у проходящих по делу лиц, а следовательно, нельзя в полной мере использовать генетическое многообразие этой системы для судебно-медицинского решения вопроса о спорном происхождении ребенка.
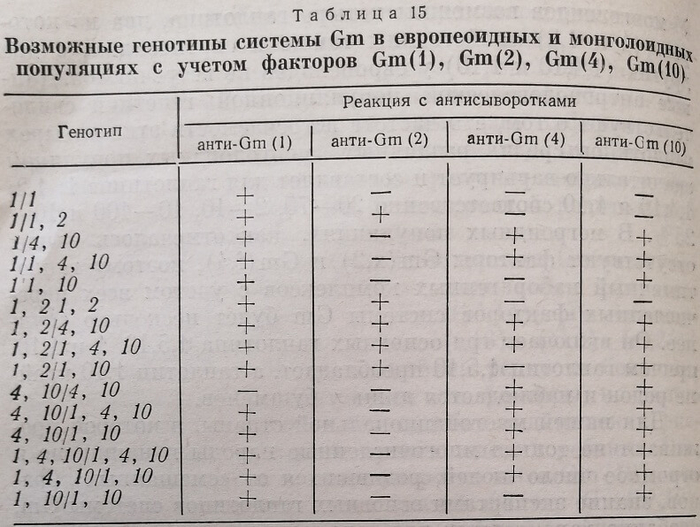
При использовании системы Gm [четырех ее факторов Gm (l)j (2), (4) и (10)] в судебно-медицинских экспертизах спорного происхождения детей можно, по-видимому, встретиться не с тремя гаплотипами, характерными для европеоидных, а с пятью, характерными как для европеоидных, так и монголоидных популяций. Гаплотипы 1; 1,2; 4,10; 1,4,10 и 1,10 могут образовать 15 генотипических комбинаций системы Gm (табл. 15).
По реакции с четырьмя сыворотками (см. табл. 15) судебно-медицинский эксперт непосредственно может установить лишь три генотипа системы Gm, поскольку фенотипы Gm(l,–2,–4,–10), Gm(l,2,–4,10) и Gm(–il, –2,4,10) характеризуют единственно возможные генотипические комбинации для данных фенотипов: 1/1, 1,2/1,10 и 4,10/4,10 соответственно. Каждому из трех других фе- иотипов системы Gm – Gm(l,2,–4,–10), Gm(l,–2, –4,10) и Gm (1,2,4,10) могут соответствовать две возможные генотипические комбинации: для фенотипа Gm(l,2,–4,-10) генотипы 111,2 и 1,2/1,2, для фенотипа Gm(l, –2,–4Д0) генотипы 1/1,10 и 1,10/1,10, для фенотипа Gm(l,2,4,10) генотипы 1,2/4,10 и 1,2/1,4,10. Установить истинный генотип у лиц, имеющих один из трех названных фенотипов, эксперту помогут исследования крови ближайших родственников этого человека.
Например, мать ребенка имеет фенотип Gm(l,2,–4,—10), т. е. генотипически может быть как 1/1,2, так и 1,2/1,2. Для выяснения вопроса о возможности рождепия ребенка от конкретной родительской пары эксперту чрезвычайно важно знать истинный генотип матери ребенка, по которому он сможет определить, какой генный комплекс – 1 или 1,2 (или только 1,2\) – она передала своему ребенку. Исследование крови бабушки и дедушки ребенка по матери показало, что они имеют фенотип Gm(l,2–4,10), который соответствует единственно возможной генотипической комбинации 1,2/1,10. G учетом фенотипа матери ребенка судебно-медицинский эксперт, логически размышляя, может легко установить ее истинный генотип 1,2/1,2 и тем самым доказать возможность передачи по наследству своему ребенку только генного комплекса 1,2, исключить возможность передачи генного комплекса, отсутствующего в генотипическом наборе матери.
Установить истинный генотип системы Gm у лица с фенотипом (1,–2,–4,10) (возможные генотипы 111,10, или 1,10/1,10) также довольно просто. Если, например, один из родителей этого человека или же его братья и сестры имеют фенотип Gm(l,–2,–4,–10), отражающий единственно возможный генотип 1/1, то этим самым доказывается, что у этого лица возможен только генотип 1/1,10 и исключается возможность генотипической комбинации 1,10/1,10. Тот же подход позволит эксперту установить истинный генотип системы Gm у лица с фенотипом Gm (1,2,440), отражающим две возможные генотипические комбинации 1,2/4,10 или 1,2/1,4,10. Если у кого-нибудь из ближайших родственников этого человека (матери, отца, братьев, сестер) имеется фенотип Gm(а–), отражающий единственно возможный генотип 4,10/4,10, то этим доказывается его генотипическая комбинация 1,2/4,10 и исключается генотипическая комбинация 1,2/1,4,10.
Таким образом, комплексное исследование четырех генетически сцепленных факторов системы Gm [Gm(l), (2), (4) и (10)] наряду с расширенным исследованием крови ближайших родственников лиц, проходящих по делам о спорном происхождении ребенка, дадут возможность точно установить 9 из 15 возможных генотипических комбинаций системы Gm, по которым эксперт и будет судить о возможности или невозможности рождения ребенка от конкретной родительской пары.
Дифференцировать шесть других генотипических комбинаций (1/4,10, 1/1,4,10, 4,10/1,4,10, 4,10/1,10,4,10/1,4,10, 1,4,10/1,10) несколько труднее, но все же возможно. И в этом эксперту опять же придет на помощь исследование крови ближайших родственников лица с фенотипом Gm(l,–2,4,10), отражающим шесть возможных перечисленных выше генотипических комбинаций. Если, например, кто-либо из ближайших родственников лица с фенотипом Gm(l,–2,4,10) имеет фенотип Gm(l, –2,–4,–10) (единственно возможная генотипическая комбинация 1/11), то сразу же исключается возможность наличия у этого человека четырех генотипических комбинаций (4,10/1,4,10, 4,10/1,10, 1,4,10/1,4,10, 1,4,10/1,10) и эксперту остается дифференцировать у него лишь два оставшихся возможных генотипа (1/4,10 или же 1/1,4,10). При наличии ближайшего родственника с фенотипом Gm (а–), отражающим единственно возможный генотип 4,10/4,10, у этого лица совершенно четко определяется его истинный генотип 1/4,10 и исключается последний; а «возможных» генотипов 1/1,4,10.
Приблизительно так же эксперт должен рассуждать если он у лица с фенотипом Gm(l,–2,–/10) обнаружил близкого родственника с фенотипом Gm(a–). Этим сразу же сужается круг возможных генотипических комбинаций с шести до трех (исключаются генотипы 1/1,4,10 1,4,10/1,4,10 и 1,4,10/1,10). Дальнейшая дифференцировка трех оставшихся возможных генотипических комбинаций (1/4,10, 4,10/1,4,10 и 4,10/1,10) для установления истинного генотипа системы Gm должна проводиться по тому же принципу с исследованием крови ближайших родственников этого человека, а также с использованием антисывороток анти-Gm (4) и анти-Gm (10), улавливающих так называемый «эффект дозы».
Заканчивая главу, посвященную использованию генетически обусловленных маркеров систем Gm в судебно-медицинских экспертизах спорного происхождения детей, упомянем о сроках онтогенетического формирования факторов Gm в сыворотке крови человека.
Показано, что в начале внутриутробной жизни в организме плода синтез иммуноглобулинов не происходит и в этот момент у плода имеются только материнские у-иммуноглобулины. Самостоятельный синтез IgG начинается у ребенка только в первые месяцы со дня его рождения, поэтому этот факт должен обязательно приниматься во внимание экспертами при использовании полиморфизма системы Gm в судебно-медицинских экспертизах спорного происхождения детей, особенно при проведении их в ранние сроки жизни ребенка.
В крови новорожденных уровень IgG достаточно высок, что позволяет, например, беспрепятственно выявлять в крови фактор Gm(a). Однако показано, что этот у-иммуноглобулиновый маркер не ребенка, а матери. Материнский у-иммуноглобулин постепенно исчезает из крови ребенка и примерно через 3 месяца после рождения уже не обнаруживается. Некоторые исследователи указывают на более ранние сроки исчезновения материнского IgG из крови ребенка. В возрасте 3-4 мес собственного IgG у ребенка вырабатывается очень мало, поэтому в этот срок генетические факторы Gm у ребенка можно и не обнаружить со всеми вытекающими из этого последствиями. Уровень у-иммуноглобулина в сыворотке крови ребенка с возрастом постепенно повышается и в конце первого года жизни достигает нижней границы содержания у-иммуноглобулина взрослого человека.
Большинство исследователей отмечают, что уже в возрасте 7–10 месяцев у детей можно выявлять почти все генетические маркеры системы Gm. Другие авторы приводят и более ранний возраст. Так, J. Herbich (1962), исследовав большую группу детей, пришел к выводу, что уже в возрасте 4–6 мес у ребенка можно выявлять «собственный» фактор Gm(a). Некоторым исследователям удавалось обнаружить фактор Gm(a) у детей и в более раннем возрасте, причем о его «детской», а не материнской природе свидетельствовал материнский фенотип Gm(a–). Однако некоторые исследователи указывают, что для судебно-медицинских целей можно принимать во внимание исследование детей только в возрасте старше 8 мес. С этим мнением нельзя не согласиться, добавив, что в случаях исключения отцовства по генотипам системы Gm при ранних сроках жизни ребенка, по-видимому, необходимо повторное контрольное исследование факторов Gm у ребенка в возрасте 8 месяцев и более.
Приведенные сведения об онтогенетическом формировании маркеров Gm касаются в основном фактора Gm(a). Относительно сроков онтогенетического формирования других факторов системы Gm у человека сведений гораздо меньше. По данным J. Lundevall (1965), полная выраженность фактора Gm(x) в сыворотке крови ребенка достигается только к 10-му месяцу его жизни.
Учитывая, что все «тормозные» факторы системы Gm, являющиеся аллотипическими генетически обусловленными маркерами, по своей природе относятся к IgG, можно было бы предполагать, что физиологическая агаммаиммуноглобулинемия новорожденных также будет влиять и на содержание и определение этих факторов в крови детей в первые месяцы их жизни. Однако данные С. Ropartz и соавт. (1965) опровергают это предположение и в определенной степени не согласуются с приведенными выше сведениями. При исследовании 81 пары мать – новорожденный авторы отметили только два случая, когда у матери не было факторов Gm(a) и Gm(e), но они присутствовали у детей. Наоборот, отсутствие у ребенка того или иного фактора Gm, имеющегося у матери, наблюдалось довольно часто. Так, фактор Gm(e), имеющийся у матери, отсутствовал у ребенка в 24%, фактор GHI(B) – в 9% и фактор Gm(a) в 3% случаев.
Эти данные представляют большой интерес, поскольку свидетельствуют о способ ности не всех молекул 7-иммуноглобулина матери в одинаковой степени проникать в кровяное русло ребенка. По всей видимости, одни IgG, имеющие определенную Gm-специфичность, проникают через плаценту в кровь ребенка легче, а другие задерживаются плацентой.
Определенный интерес представляют исследования генетических маркеров системы Gm при агаммаиммуногло- булинемии и гипергаммаиммуноглобулинемии. R. Grubb и А. В. Laurell (1956) впервые отметили, что в случаях физиологической или патологической агаммаиммуноглобули- немии из-за резкого снижения концентрации IgG в сыворотке крови человека генетические маркеры системы Gm могут не выявляться, а это может привести к ошибочной диагностике ее фенотипов. Авторы исследовали 5 случаев агаммаиммуноглобулинемии, которая была подтверждена электрофоретическим анализом, и во всех этих случаях обнаружили фенотип Gm(a–). Впоследствии было исследовано еще 25 случаев агаммаиммуноглобулинемии, при которой также в 100% случаев диагностировалась группа Gm(a–).
Некоторые из этих сывороток иселедовали на содержание в них такого чрезвычайно распространенного фактора, как Gm(B), причем во всех случаях он не выявлялся и диагностировалась группа Gm(b–). Авторы исследовали одну сыворотку, в которой имелось незначительное количество у-иммуноглобулина. Эта сыворотка имела совершенно необычную группу Gm(a–х–b–), практически отсутствовавшую у здоровых людей.
Все эти наблюдения, вне всякого сомнения, свидетельствуют о том, что групповые факторы системы Gm могут не выявляться при отсутствии достаточного количества 7-иммуноглобулинов в сыворотке крови человека. Такое состояние может быть как физиологическим (например, у новорожденных), так и при патологических процессах, когда агаммаиммуноглобулинемии или гипогаммаиммуноглобулинемия является врожденной или возникает в процессе жизни.
При использовании полиморфизма системы Gm в судебно-медицинских экспертизах спорного происхождения детей важно знать результаты исследования ее групповых факторов у лиц не только с агаммаиммуноглобулинемией, но и гипергаммаиммуноглобулинемией.
Необходимо отметить, что некоторые сыворотки анти-Gm (а) типа Ragg могут снижать свою серологическую активность («тормозиться») под влиянием сывороток Gm(a ) с высокой концентрацией IgG. Это относится также и к другим антисывороткам, например, к сывороткам анти-Gm (х) и анти-Gm(Ь). В настоящее время считается установленным, что гипергаммаиммуноглобулинемия может повышать также тормозную способность сыворотки группы Gm(a-j-). Однако следует помнить, что повышенное содержание у-иммуноглобулина в сыворотке Gm(a–) не может, естественно, привести ее к переходу в группу Gm(a+), а может только лишь завуалировать ее истинный фенотип. Использование же более специфичных сывороток типа SNagg и соответствующее разведение испытуемых сывороток (которое обязательно указывается в аннотации к каждой серии сывороток анти-Gm) гарантируют эксперта от ошибок при исследовании факторов Gm у лиц с гипергаммаиммуноглобулинемией.
Исследования групповых факторов системы Gm у больных с различными патологическими процессами показали, что эти состояния все же не могут вызвать появления специфического или неспецифического у-иммуноглобулинового тормозного фактора Gm в сыворотке крови больных, не имевших его до заболевания. Патологические изменения белков крови могут, однако, маскировать истинную группу системы Gm. Это обстоятельство нужно непременно учитывать как при генетическом изучении у-иммуноглобулиновых групп системы Gm, так и при проведении судебно-медицинских экспертиз спорного отцовства, в которых исследуются генетически обусловленные маркеры этой системы.
При проведении судебно-медицинских экспертиз в делах о спорном отцовстве с использованием групп системы Gm эксперт должен помнить, что ввиду физиологической агаммаиммуноглобулинемии у ребенка определение его Gm-факторов может производиться не ранее чем через 6–8 мес после рождения. При исключении ответчика в качестве возможного отца ребенка, который не достиг возраста 6–8 месяцев (и если такое исключение основывается только на генотипах системы Gm), эксперт обязан провести контрольное исследование сыворотки крови ребенка по достижении последним указанного возраста.
Гипо- или агаммаиммуноглобулинемия может обусловить негативный результат выявления генетических маркеров системы Gm. Поэтому в случаях необнаружения в сыворотке того или иного фактора Gm необходимо выяснить (а еще лучше самому установить, например мощью электрофореза или иммуноэлектрофореза), нет ли у данного лица гипо- или агаммаиммуноглобулинем. Необходимо также напомнить, что судебно-медицинское выявление факторов системы Gm надо проводить либо чело веческими антисыворотками типа SNagg, либо иммунным сыворотками анти-Gm, значительно более специфичными чем человеческие сыворотки анти-Gm типа Ragg.
В заключение отметим, что для предотвращения возможных неточностей или ошибок судебно-медицинский эксперт при выявлении того или иного фактора системы Gm обязательно должен использовать в качестве контроля известные ему образцы сывороток крови, в которых присутствует и отсутствует исследуемый у-иммуноглобулиновый фактор Gm. При этом в первом случае агглютинация сенсибилизированных эритроцитов должна полностью отсутствовать, а во втором должна быть хорошо выраженной. Кроме этих контролей эксперт обязан параллельно проводить еще три контрольных исследования, два из которых относятся к так называемым «отрицательным» контролям и один – к «положительному».
Первый «отрицательный» контроль: сенсибилизированные эритроциты + исследуемая сыворотка (в том же разведении, что и в основном опыте). Агглютинация эритроцитов должна отсутствовать. Второй «отрицательный» контроль: несенсибилизированные эритроциты + сыворотка анти-Gm. Агглютинация эритроцитов должна отсутствовать.
«Положительный» контроль: сенсибилизированные эритроциты + сыворотка анти-Gm. Должна быть хорошо выраженная агглютинация сенсибилизированных эритроцитов, видимая невооруженным глазом.