Система группоспецифического компонента (Gc)
В 1959 г. J. Hirschfeld с помощью иммуноэлектрофорез в агаровом геле при использовании имммунной антисыворотки, преципитирующей белки человека, обнаружил в зоне аг-глобулинов новый протеин, названный им группоспецифическим компонентом Gc. При этом автор наблюдал либо быстро мигрирующую, либо медленно мигрирующую дугу преципитации, либо общую слитую дугу. Быстро мигрирующий белок группоспецифического компонента был обозначен Gol, а медленно мигрирующий – Gc2.
Автор выдвинул гипотезу, согласно которой полиморфизм системы Gc контролируется двумя аутосомальными кодоминантными аллелями Gc1 и Gc2 в едином генном локусе без доминирования. При этом аллель Gc1 ответствен за образование белка Gel, а аллель Gc2 – за образование белка Gc2. Из этого вытекает, что существуют три группы, или типа Gc: Gel –1 (содержит только быстро- мигрирующий белок Gel), Gc2–2 (содержит только медленно мигрирующий белок Gc2) и Gc2–А (содержит оба белка Gel и Gc2) (рис. 7).
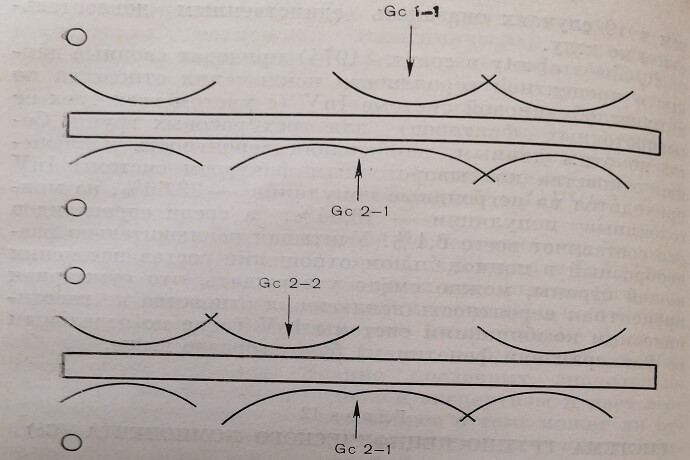
Рис. 7. Схематическое изображение дуг преципитации Gc в фенотипах Gcl-1, Gc2-2 и Gc2-1 после иммуноэлектрофоретического исследования.
Методик и различных модификаций иммуноэлектрофоретического выявления групп системы Gc предложено» много. Мы остановимся лишь на классическом методе – иммуноэлектрофорезе в агаровом геле (по Hirschfeld, 1960).
Буферная система Hirschfeld включает электродный и гелевый буфер. Электродный буфер готовят из 6,9 г веронала, 43,8 г мединала, 1,92 г лактата кальция, до 5 л дистиллированной воды. Гелевый буфер состоит из 3,32 г веронала, 21,02 г мединала, 3,07 г лактата кальция, до 2 л дистиллированной воды. Для получения 1–1,5% агарового геля агар специальной очистки (например, агар Difco, Kobe-Agar 1 и др.) растворяют в водяной бане с разведенным гелевым буфером до концентрации агара 1–1,5%. Смесь выливают на стеклянную пластинку размером 13x18 мм (на одну пластинку требуется около 50 мл расплавленного агара). После застывания в геле вырезают стартовые лунки и каналы для иммунных осаждающих белки человека антисывороток или же для моновалентных иммунных сывороток анти-Gc.
Электрофорез проводят при напряжении 7–8 В/см в течение 2–21/5 ч. После проведения электрофореза каналы заполняют иммунной сывороткой анти-Gc и пластинки помещают во влажных камерах в термостат при + 37 °С на 20 ч, за это время антисыворотки диффундируют в гель и образуют зоны преципитации. После проведения иммунной диффузии агаровые пластинки промывают ют избытка белка изотоническим раствором NaCl или дистиллированной водой, затем высушивают и окрашивают 5 мин в красителе следующего состава: 1 часть уксусной кислоты, 5 частей метилового спирта, 5 частей дистиллированной воды. На 100 мл этой смеси добавляют 100 мг амидошварца 10В. После окрашивания пластинку обесцвечивают в том же растворе, но без амидошварца.
Линия преципитации белка Gc расположена вблизи канала. Распознавание линий Gc значительно облегчается при сравнении иммуноэлектрофореграммы с результатами контрольных исследований сывороток с заведомо известными типами Gc. Трудности определения линий преципитации Gc привели к необходимости получения специфичных моновалентных антисывороток анти-Gc, с помощыо которых чётко выявляются все три группы протеина.
Частота встречаемости аллеля Gc1 среди населения Земного шара превышает частоту встречаемости аллеля Gc2 и составляет в среднем для европеоидов 60–65%* для монголоидов 75–80% и для негроидов 90–95%. Результаты посемейных обследований свидетельствуют о том, что имеются бесспорные исключения из общепризнанного порядка наследования групп системы Gc, обусловленные, по-видимому, действием каких-то редких атипичных аллелей в генном локусе этой системы.
Т. Beinskou (il963) обнаружил, что быстромигрирующий компонент Gc является гетерогенным: при пролонгированном иммуноэлектрофорезе образуются две дуги преципитации Gel–1 и три дуги Gc2–1. Поскольку все исследованные сыворотки типа Gel–1 и Gc2–1 давали такую- картину, автор сделал вывод о том, что белок Gel состоит из двух протеинов GclF и GclS, генетическая реализация которых обусловлена аллелем Gc1. J. Hirschfeld (1962)' описал генетически обусловленные варианты белков Gc,. названные им белками GcX и GcY. В последующем были обнаружены и другие варианты Gc: Gc Aborigene (GcAb); GcZ; GcBangkok (GcBkk); Gc Darmstadt (GcD); Gc Japan (GcJ); Gc Wien (GcW); Gc Opava (GcOp).
Все эти так называемые особые формы белков Gc довольно редки, однако судебно-медицинский эксперт, использующий генетически обусловленный полиморфизм системы Gc для решения вопросов, связанных со спорным происхождением ребенка, конечно же, должен знать об их существовании. Обнаружение какого-либо редкого атипичного варианта Gc у ребенка и его предполагаемого отца свидетельствует о том, что ответчик является действительным отцом ребенка. Для более точного дифференцирования атипичных вариантов системы Gc от нормальных типов при использовании иммуноэлектрофореза многие авторы рекомендуют либо применять более продолжительный иммуноэлектрофорез с обычной техникой, либо использовать так называемый перекрестный иммуноэлектро, форез по С. Laurell (1965) в модификации Н. Cleve и соавторов (1970).
Для этого по окончании обычного электрофоретического разделения из стартовых лунок удаляют остатки исследуемых сывороток, а в каналы (после удаления из них агара) помещают прецилитирующую сыворотку анти-Gc. Затем агаровую пластинку поворачивают на 90° и полоски фильтровальной бумаги, соединяющие агаровый гель с переходным буфером, располагают в следующем порядке: бумагу анода кладут со стороны канала для преципитирующих антисывороток, а бумагу катода – со стороны разделенных фракций исследуемой сыворотки вдоль оси электрофоретического разделения белков.
Естественно, что перед проведением электрофореза все стартовые лунки в агаре располагают только по одну сторону от каналов. После этого включают ток с напряжением в 2 раза меньшим, чем при начальном электрофоретическом разделении. При таком приложении электрического поля глобулины исследуемой сыворотки крови будут двигаться к аноду, т. е. к каналу с преципитирующей антисывороткой, а у-глобулины преципитирующей антисыворотки, которые главным образом и участвуют в образовании преципитатов, – в сторону катода, т. е, навстречу аг-глобулинам исследуемой сыворотки. В этом случае линии преципитации образуются уже через 3–4 ч и по ним можно довольно легко отличить атипичный вариант Gc от обычных типов этого белка.
Редкие находки атипичных вариантов Gc, которые передаются по наследству, безусловно, свидетельствуют о том, что в генном локусе системы Gc, помимо основных аллелей Gc1 и Gc2, могут находиться, по-видимому, и другие редкие аллели (Gcx, GcY, GcAb, Gcz и др.).
Система Gc уже давно практически применяется в судебно-медицинских экспертизах спорного отцовства, поскольку четкий аутосомальный кодоминантный порядок наследования ее групповых факторов позволяет эксперту с учетом фенотипов Gc ответчика, ребенка и его матери решать вопрос о возможности или невозможности рождения ребенка от определенной родительской пары. От частоты встречаемости типов Gc среди различных популяций зависит максимальная вероятность исключения ложно указанного в качестве отца ребенка мужчины с учетом только этой генетической системы. Так, по данным Т. Reinskou (1965), из 1338 дел о спорном отцовстве в 116 наблюдалось исключение мужчин в качестве отца ребенка по системе Gc. Суммарная вероятность исключения отцовства по системе Gc с учетом двух аллелей Gc1 и Gc2 составляет соответственно для негроидных, европеоидных и монголоидных популяций 7,31, 16,61 и 15,60%.
К. Henningsen (1966) сообщил об одном случае, когда мать обладала фенотипом Gc2–2, а ее ребенок – Gel–lr , т. е. по всем законам наследования групп Gc исключалась возможность рождения ребенка с такой группой Gc данной женщиной. Возможность замены или перепутывания ребенка при рождении в этом случае полностью исключалась. Было установлено, что отец матери имеет фенотип Gel–1, следовательно, в сыворотке крови этой женщины должен бы находиться гликопротеиновый компонент GoL. Однако его не было, поэтому единственно возможным объяснением этого генетического феномена является предположение о наследственной передаче в этой семье какого-то «немого» аллеля Gc°, который не обеспечивает генетическую реализацию соответствующего гликопротеина Gc и тем самым может создать иллюзию противоположной гомозиготности. Это может привести к ошибочному заключению о невозможности рождения ребенка от конкретного лица, которое в действительности является родителем данного ребенка. Отец же матери ребенка был генотипически гетерозиготным по обычному аллелю Gc1 и крайне редкому аллелю Gc°, хотя фенотипически он характеризовался группой крови Gcd–1 (т. е. якобы генотипической гомозиготой Gc'JGc1). Мать ребенка унаследовала от отца аллель Gc°, а от своей матери – обычный аллель Gc* (ее фенотип Gc2–2), т. е. также была генотипически гетерозиготной Gc°/Gc2, хотя фенотипически имела группу Gc2–2 (т. е. якобы генотипически гомозиготной Gc*/Gc2). Своему ребенку мать также передала аллель Gc°, поэтому ее ребенок также был генотипически гетерозиготным Gc°/Gcl (обычный аллель Gc1 ребенок унаследовал от своего отца – мужа матери), хотя опять же фенотипически характеризовался группой Gel–1, т. е. был генотипически гомозиготным Gc1fGc1. Правильность предположения о существовании аллеля Gc°, чрезвычайно «опасного» для судебно-медицинских экспертов, К. Heinningsen доказал количественным исследованием содержания гликопротеинов Gc в сыворотке крови ребенка, его матери и его дедушки по матери. Как и ожидалось, у всех них оно составило приблизительно 50% от нормального содержания гликопротеинов Gc в сыворотке крови человека.
О подобных наблюдениях сообщили О. Prokop и A. Rackwitz (1968). Авторы обнаружили семью, в трех
поколениях которой также наблюдалась противопожная «гомозиготность» по системе Gc сначала у матери и ее сына, а в дальнейшем у ставшего уже отцом сына у его дочери. Так же как и К. Henningsen, эти авторы считают, что такой генетический феномен доказывает cvществование в генном локусе системы Gc крайне редкой «немого» аллеля Gc°, антигенно не реализующего субстанцию Gc и который в гетерозиготной форме с одним из основных аллелей Gc1 или Gc2 создает фенотипическую иллюзию генотипической гомозиготности по соответствующему алллелю. О том, что аллель Gc° крайне редок, безусловно, свидетельствует тот факт, что до настоящего времени (за 20 лет многочисленных исследований факторов Gc среди населения Земного шара) ни разу не встретился человек, генотипически гомозиготный по этому аллелю и в сыворотке крови которого белок Gc вообще бы отсутствовал.
Хотя этот факт и должен всегда учитываться судебно- медицинскими экспертами (особенно в случаях исключения отцовства или материнства по противоположной гомозиготности системы Gc у ответчика и ребенка или же у матери и её ребенка), однако, по мнению О. Prokop и W. Gohler (1976), крайняя редкость аллеля Gc° позволяет все же эксперту в таких случаях говорить о том, что «отцовство (или материнство) в данном случае невозможно.
Соглашаясь в принципе с мнением авторов, мы все же считаем необходимым в таких случаях проводить обязательное исследование типов Gc у всех ближайших родственников, проходящих по делу лиц (их родителей, братьев и сестер) для выяснения их истинных генотипов по этой системе, а также в случаях необходимости проводить количественный учет содержания белков Gc в сыворотке крови ребенка и «исключившегося» ответчика или «исключившейся» матери ребенка.
Уже отмечалось, что бурное развитие техники, появление принципиально новых аналитических методов исследования с исключительно высокой разрешающей способностью вызвало в буквальном смысле слова переворот в, казалось бы, уже сложившихся представлениях о генетических маркерах крови человека и об их наследственной передаче. Поясним эту мысль на примере системы Gc.
При пролонгированном иммуноэлектрофорезе Т. Reinskou (1963) впервые наблюдал разделение белка Gel на две фракции GclF и GclS. Поскольку все исследованные сыворотки с типами Gel-l и Gc2-1 давали одинаковую картину, автору пришлось отказаться от мысли о какой-либо генетической полиморфности этих компонентов Gc и предположить, что аллель Gc1 управляет генетической реализацией как белка GclF, так и GclS. Исследования, проведенные группой ученых во главе с A. Rouslahti (1971), подтвердили правильность генетической гипотезы Т. Rein- skou.
Многочисленные популяционно-генетические исследования групп Gc, семейные обследования, обследования многочисленных пар мать – ребенок и однояйцевых близнецов, проводимые в течение почти 20 лет методом иммуноэлектрофореза с использованием моновалентных сывороток анти-Gc или другими электрофоретическими методами, подтверждали правильность гипотезы J. Hirschfeld о простом аутосомальном порядке наследования групп системы Gc, управляемом двумя основными аллелями Gc1 и Gc2 в едином генном локусе Gc без доминирования. Признавалось также, что в генном локусе этой системы находятся, по-видимому, чрезвычайно редкие «атипичные» аллели GcAb, Gc™, Gc°, GcY, Gc°p, Gcx, GcBkk, Gc°, Gcz и другие, которые в гетерозиготной форме с основными аллелями Gc1 или Gc2 генетически обусловливают появление особых атипичных, или «вариантных», групп Gc, передающихся по наследству. Однако J. Constans и М. Viau (1977) с помощью разработанного ими нового метода иммунной фиксации после изоэлектрического фокусирования смогли доказать генетически обусловленную гетерогенность быстромигрирующих белков Gc, считавшихся ранее генетическим продуктом единого аллеля Gc1.
Изоэлектрическое фокусирование в полиакриламидном геле проводили на приборе «Мультифор-ЛКБ». В качестве амфолинов для пластинок полиакриламидного геля использовали: на катоде 0,2 М NaOH, на аноде 1 М Н3Р04. Изоэлектрическое фокусирование по градиенту в пределах pH 4,0–6,5 проводили 4,5 ч с использованием стабилизированного тока мощностью 15 В. Начальное напряжение тока составляло 500 В, спустя 30 мин после начала изоэлектрического фокусирования его повышали до 1200 В. Пластинки охлаждали циркулирующей струей воды при температуре 12 °С. Затем проводили иммунную фиксацию белков Gc. Для этого полости ацетатцеллюлозы смачивали иммунной моновалентной сывороткой анти-Gc и осторожно накладывали их на 2–3 мин на соответствующие (для белков Gc) участки пластинок. После этого полоски ацетатцеллюлозы удаляли и пластинки промывали в течение 10 ч в сосуде с циркулирующей и проточной водой для вымывания всех остальных, иммунологически не связавшихся сывороточных белков, кроме «фиксированных» белков Gc. Затем пластинки окрашивали 0,5% раствором кумасси блю (Coomassie Brilliant Blue R-250) в смеси метанол – ледяная уксусная кислота – дистиллированная вода в соотношении 50:1:49. Обесцвечивание производили в этом же растворе без добавления красителя.
С помощью такого метода J. Constans и М. Viau обнаружили, что быстромигрирующие пары, или компоненты, белков Gel неодинаковы в различных образцах сывороток с типом Gcl-1 и Gc2-1 (вспомним совершенно одинаковое иммуноэлектрофоретическое «раздвоение» белков GclF и GclS). Они мигрируют либо несколько быстрее, либо медленнее. Первые же семейные обследования, проведенные J. Constans и М. Viau, убедительно свидетельствовали о том, что наблюдаемая ими различная миграция быстрых белков Gel в образцах сывороток крови Gcl-1 и Gc2-1 генетически обусловлена.
Таким образом, спустя почти 20 лет с момента открытия J. Hirschfeld (1959) генетически обусловленного полиморфизма системы Gc было доказано, что эта система контролируется не двумя основными аллелями Gc1 и Gc2 в едином генном локусе этой системы, а тремя основными аллелями Gcls, GclF и Gc2. Поскольку система Gc оказалась трехаллельной генетической системой, то ее полиморфизм возрос вдвое и можно всех людей подразделять не на три основные группы или фенотипа, а на шесть групп, каждой из которых соответствует единственно возможная генотипическая комбинация. Это представляет исключительную ценность для судебно-медицинских экспертов, использующих полиморфизм этой сывороточной системы в экспертизах спорного отцовства. Шесть возможных генотипических комбинаций системы Gc соответствуют следующим шести ее фенотипам.
Н. Cleve и соавт. (1978) провели генетический анализ подтипов системы Gc среди 93 семей с 176 детьми, который полностью подтвердил правильность трехаллельной генетической модели наследования групп Gc с шестью ее фенотипами. Изученный ими материал включал и 13 так называемых «критических» родительских пар по системе Gc (одну 1F-1FX1S-1S, восемь 1S-1SX1S-1S и четыре 1S-1SX2-2). Все 18 детей, родившиеся в этих семьях, обладали единственно возможными фенотипами Gc с учетом подгрупп этой системы у их родителей: соответственно 1F-4S (один ребенок), lS-ilS (10 детей) и 2-1S (7 детей).
Авторы определили частоту встречаемости трех основных аллелей системы Gc среди европейского населения: Gc1F 14,7%, Crcis 59,2%, Gc2 26,1%. Отмечено, что после внедрения метода иммунной фиксации с изоэлектрическим фокусированием в популяционно-генетических исследованиях полиморфизма системы Gc частота встречаемости редких, или «атипичных», вариантов Gc оказалась неожиданно высокой при сравнении с прежними результатами исследований, проводимых с помощью различных иммуноэлектрофоретических и электрофоретических методов.
Использование в экспертизах спорного отцовства подтипов системы Gc, вернее, всех шести ее основных фенотипов, четко отражающих единственно возможные для каждого фенотипа генотипические комбинации, значительно повышает как информативность этой системы, так и вероятность исключения мужчин, ложно указанных в качестве отца ребенка. Если, например, теоретически вероятность исключения отцовства по системе Gc с учетом двухаллельной модели наследования ее групп составила 15,58%, то при учете шести фенотипов число возможных исключений ответчиков значительно возрастает – до 29,36%.
Необходимо упомянуть и о новейшем неиммунологическом методе выявления Gc-преципитатов после изоэлектрического фокусирования в полиакриламидном геле. Этот метод разработал В. Hoste (1979). Метод, по-видимому, является чрезвычайно перспективным, поскольку он простой, быстрый и высокочувствительный. Главное его преимущество заключается в том, что он не требует дорогостоящей моновалентной сыворотки анти-Gc, фиксирующей преципитаты Gc после изоэлектрического фокусирования сывороток на пластинках.
Сразу же после окончания изоэлектрического фокусирования пластинки с полиакриламидным гелем обрабатывают раствором содержащим ЗЭО мл метанола, 660 мл дистиллированной воды 3 г сульфосалициловои кислоты (3% раствор) и 1 г красителя кумасси блю. Полосы Gc появляются немедленно после обработки (белые преципитаты, которые лучше всего просматриваются на фоне в проходящем свете). Все другие белковые фракции, в том числе трансферрин, агантитрипсин) проявлялись в виде голубого цвета через 1–2 ч после инкубации пластинок в партере красителя при 50 °С.
Сравнительное параллельное исследование многочисленных образцов сывороток крови с различными подтипами Gc, а также с его редкими атипичными вариантами показало полную идентичность Gc-преципитатов, выявляемых как методом иммунной фиксации антителами анти-Gc, так и сульфосалициловым методом. Сульфосалициловый метод основан на физико-химических свойствах белка Gc – самого термонестабильного сывороточного 1 белка. Сульфосалициловая кислота, так же как и многие другие кислоты, осаждает большинство сывороточных белков крови человека, однако в низкой концентрации; (3%) осаждает в первую очередь гликопротеины группоспецифического компонента Gc.
Учет результатов (выявление локализации и фотографирование преципитатов Gc) реакции должен быть быстрым, поскольку в дальнейшем могут проявляться (осаждаться 3% сульфосалициловой кислотой) и другие белковые фракции.
В 1978 г. в Париже состоялся первый международный рабочий конгресс, посвященный обсуждению новейших достижений в области биохимии, функции и генетически обусловленной полиморфности групповых специфических компонентов сыворотки крови человека. На нем были рассмотрены все иммунологические и разделительные методы, используемые в настоящее время при изучении генетически обусловленного полиморфизма системы Gc. Из них рекомендованы следующие: 1) метод изоэлектрофокусирования на полиакриламидных пластинках с последующей иммунной фиксацией по J. Constans и М. Viau (1977); 2) метод электрофореза в геле агарозы по А. М. Johnson и соавт. (l975); 3) метод электрофореза в 8,5% полиакриламидном геле по F. D. Kitchin. Любопытно, что для изучения полиморфизма системы Gc конгресс не рекомендовал использовать классический иммуноэлектрофоретический метод, при помощи которого и был открыт генетический полиморфизм этой сывороточной системы.
Были рекомендованы также следующие методы выявления групповых компонентов Gc-протеинов:
- Методы окраски красителем кумасси блю и амидошварцем 10В. Отмечено, что эти способы не всегда дают возможность проводить прямое определение фенотипов Gc, поэтому конгресс рекомендовал пользоваться предпочтительнее техникой специфического иммунологического исследования, которая является обязательной после изоэлектрофокусирования. Однако в 1978 г. еще не был известен метод сульфосалициловой фиксации.
- Метод двумерного антиген- антитело перекрестного гелевого электрофореза и иммунофиксирующего гелевого электрофореза но С. Laurell (1965). Главным недостатком метода является незначительное различие электрофоретической подвижности групповых преципитатов Gc, затрудняющее диагностику групп Gc. Конгресс рекомендовал в данном случае использовать метод иммунной преципитации на поверхности геля.
- Метод иммунопреципитации на ацетатцеллюлозе.
Ацетатцеллюлозные мембраны перед исследованием пропитывают моновалентной преципитирующей сывороткой анти-Gc, разведенной в зависимости от ее первоначального титра изотоническим раствором NaCl в соотношении 1:2–1:10. Затем мембраны 2 ч просушивают на воздухе и после электрофоретического разделения на 1–2 мин накладывают на поверхность геля. Затем их снимают и 4 ч промывают в проточной воде, после чего иммунные преципитаты Gc окрашиваются красителем кумасси блю или амидошварцем 10В.
Метод иммунопреципитации на ацетатцеллюлозе в принципе очень похож на метод иммунной фиксации, который применяют после изоэлектрического фокусирования для выявления групповых преципитатов Gc. Отличие заключается лишь в том, что при иммунопреципитации от избытка сывороточных белков, не относящихся к Gc-протеинам, отмывается после контакта с поверхностью геля пропитанная сывороткой анти-Gc ацетатцеллюлозная мембрана, на которой впоследствии и выявляют при окрашивании групповые Gc-преципитаты. При иммунной фиксации от посторонних сывороточных белков отмывают гель, на котором и выявляют Gc при последующем окрашивании.
На конгрессе была принята новая номенклатура системы Gc, относящаяся главным образом ко всем ранее описанным «антипичным» вариантам. Эта номенклатура довольно сложна. Все аллели системы Gc, антигенно реализующие соответствующие фенотипы Gc, разделены на две основные категории: аллели, обусловливающие появление двойных полипептидных цепей Gc (или компонентов Gc), и аллели, ответственные за образование только одиночных полипептидных цепей (или компонентов) Gc. Такое подразделение основано на электрофоретической или электрофокусической картине всех фенотипов системы, причем новая номенклатура построена на учете характер, миграции каждого компонента Gc в том или ином фенотипе.
Поскольку известно, что два основных «подаллеля» Gcl–Gc1F и Gcis ответственны за образование двух соответствующих белков Gc (двух Gc-полипептидных цепей или двух Gc-компонентов), а аллель Gc2 – за появление одного белка Gc (одного Gc-компонента, или одной полипептидной цепи Gc), то конгресс счел возможным присвоить всем аллелям системы Gc, антигенно реализующим появление двух соответствующих протеинов, начальную цифру 1, которую ставят слева от нового буквенно-цифрового обозначения соответствующего аллеля. Всем аллелям системы Gc, ответственным за появление только одного белка Gc (наподобие аллеля Gc2), присваивается начальная цифра 2, также ставящаяся слева от буквенно-цифрового обозначения соответствующего аллеля.
Необходимо также отметить, что новая номенклатура системы Gc сохраняет для трех основных аллелей этой системы их прежние наименования: IF, 1S и 2. Для всех же редких атипичных аллелей системы Gc для их систематизации, дифференцирования или установления тождества между некоторыми из этих аллелей вводится новая международная номенклатура, прежде всего учитывающая Миграцию антигенно реализованных этими аллелями Gc-протеинов, наблюдаемую после изоэлектрофокусирования в полиакриламидном геле.
При этом учитывается расположение – анодное (А) или катодное (С) – этих «вариантных» компонентов Gc по отношению к основным Gc-протеинам, появление которых обусловлено действием основных аллелей Gc1F, GclS и Gc.
Третья цифра, ставящаяся после букв А или С, характеризует степень удаления (к аноду или катоду) этих атипичных белков Gc по отношению к компонентам Gc обычного гомозиготного фенотипа GclS-lS.
Так, старое обозначение атипичного аллеля Gc1Ab, ответственного за появление редкого фенотипа Gc (Aborigine, Australia или сокращенно GcAb), по новой международной номенклатуре заменено на Gc1Al. Это значит, что данный аллель является генетическим вариантом аллеля Gc1, последний ответствен за появление двух полипептидных цепей, или компонентов Gc, мигрирующих рри изоэлектрофокусировании несколько быстрее компонентов Gc контролируемых обычным аллелем Gcis (в фенотипе GclS–IS). Тот же принцип классификации применен и к мутационным вариантам аллеля Gc2. Любой атипичный белок Gc, мигрирующий несколько быстрее обычного протеина Gc2 в фенотипе Gc2-2, и атипичный аллель, антигенно его реализующий, обозначают Gc2A1, Gc2A2 и т. д.
Путем сравнительного исследования идентифицировано 29 различных белков Gc, каждому из которых в генном локусе соответствует определенный аллель. В соответствии с уменьшающейся электроподвижностью они обозначены: 1А9, 1А8, 1А7, ilА6, 1А5, 1А4, 1АЗ, 1А2, IF, 1А1, IS, 1С1,, 1С2, 1G3, 1G4, 1С5, 1С6, 1G7, 1С8, 1С9, 1G10, 2А6, 2А5, 2А4, 2АЗ, 2А2, 2А1, 2, 2G1 и 2С2.
Частота встречаемости аллелей Gc1F, Gc2 во много раз превышает частоту встречаемости 26 других атипичных аллелей, однако такое большое их число делает вполне вероятным нахождение атипичных гетерозиготных, фенотипов у проходящих по делу лиц. При этом определение, например, в сыворотке крови ребенка и его предполагаемого отца одних и тех же атипичных фенотипов с большой вероятностью свидетельствует о том, что данный мужчина является истинным отцом ребенка.
Таким образом, сывороточная система Gc при внедрении в экспертную практику высокочувствительных разделительных аналитических методов исследования сможет стать весьма информативной при решении судебно-медицинских вопросов, связанных со спорным происхождением ребенка. Любая возможная изоэлектрофокусическая фореграмма Gc-протеинов четко отражает не только фенотип, но и единственно возможный для этого фенотипа генотипический набор индивида, на основании которого и решается вопрос о возможности рождения ребенка от определенной родительской пары.




