Периодизация этапов развития гонад
Для расширения представлений о причинах возникновения различных нарушений развития женского организма, в частности полового аппарата, и ряда гинекологических заболеваний, проявляющихся впервые либо в детстве, либо в периоде полового созревания или даже в половозрелом возрасте, необходимо достаточное ознакомление с антенатальным развитием плода, с последовательностью органогенеза и гистогенеза ряда систем и в первую очередь половых желез (гонад) человека.
По предложению Witshi, принята следующая периодизация этапов гонадного развития, а именно различают:
- период индифферентных гонад;
- период начальной половой дифференциации;
- период размножения оогоний;
- период неразъединенных ооцитов;
- период первичных фолликулов.
Первый период длится с пятой по седьмую неделю эмбрионального развития. Первичные половые клетки удается проследить на всех этапах их миграции из стенки желточного мешка; они появляются в мезенхиме зародыша на стадии 13–23 сомитов, концентрируясь в тех участках целомического эпителия, которые покрывают медиальные стороны первичных почек. Вскоре, обособляясь, эпителий, становясь многослойным, образует небольшое возвышение. Врастая в подлежащую мезенхиму, зачатковый эпителий, сосредоточенный в виде компактной клеточной массы, формирует эпителиальное ядро окончательной коры яичников. Первичные половые клетки, временно пребывая в составе зачаткового эпителия и вторично возвращаясь в мезенхимную основу гонады, получают, очевидно, по мнению А. Г. Кнорре, какую-то «информацию» для последующей дифференциации их в оогоний.
Период начальной половой дифференциации принято относить к 7–8-й неделе эмбрионального развития. В это время существуют точные топографические взаимоотношения между закладками внутренних половых органов и элементами выделительной системы (рис. 13). Тяжи зачаткового эпителия, врастающие при образовании зародышей женского пола, разделяются разрастающейся мезенхимой на так называемые пфлюгеровы тяжи и шары (круглые клеточные группы, в составе которых имеются и половые клетки).
Период размножения оогоний (8–9-я неделя) характеризуется началом образования фолликулярных клеток из клеток пфлюгевовых тяжей или прегранулезных клеток, а клетки мезенхимы превращаются в интерстициальные и тека-клетки. Число половых клеток в процессе их размножения настолько возрастает, что весь яичник прэдзтавляет собою как бы однородную клеточную массу, в которой половые клетки почти неотличимы от окружающих.
Период неразъединенных ооцитов длится с 10-й по 12-ю неделю внутриутробного развития. В это время происходит трансформация половых клеток, находящихся в составе пфлюгеровых тяжей и шаров, в ооциты. Расположенное в центре органа мозговое вещество яичника слабо выражено и переходит непосредственно в так называемые яичниковые ворота. Полагают, что так называемые хилюсные клетки происходят из недифференцированной мезенхимы половой закладки.
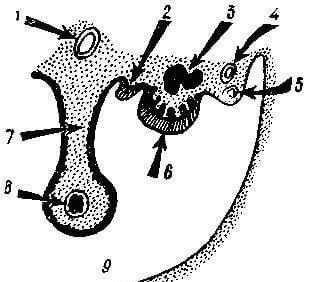
Рис. 13. Топография гонады плода (по Е. Тетеру). 1 – аорта; 2 – зачаток надпочечника; 3 – вторичная почка; 4 – вольфов проток; 5 – мюллеров проток; 6 – гонада; 7 – корень брыжейки; 8 – энтодерма кишки; 9 – первичная полость тела.
Период первичных фолликулов длится с 20-й по 38-ю неделю; в это время в яичнике происходит созревание коры, обусловленное проникновением в нее соединительной ткани из ворот яичника.
В срок около 20 недель на границе коркового и мозгового вещества возникают примордиальные фолликулы. Это происходит в результате того, что флюгеповы тяжи и шары разбиваются на более мелкие образования, каждое из которых состоит из одного ооцита, окруженного цилиндрическими фолликулярными клетками.
Соединительная ткань, достигнув покровного эпителия гонады, образует первичную белочную оболочку. Иногда часть оогоний и прегранулезных клеток, изолированных соединительной тканью, продолжает существовать в незрелом состоянии в виде отдельных островков; они могут считаться, по М. Ф. Глазунову, потенциально бластомогенными очагами.
Срок появления первичных полостных фолликулов относится к периоду между 24–30-й неделями беременности. У физически вполне здоровых матерей, по Н. В. Кобозевой и Ю. А. Гуркину, динамика фолликулярного созревания проходит в строгой последовательности.
Растущие примордиальные фолликулы обнаруживаются нередко уже на 9-й неделе, а предполостпые фолликулы с примитивной текой – начиная с 27-й недели. После 29 недель наблюдаются первые полостные фолликулы. К 33-й неделе фолликулы достигают значительной величины (до 5–7 мм), причем в части из них обнаруживается обтурационная атрезия. По Н. В. Кобозевой, на всех стадиях внутриутробного развития отмечается асимметрия яичников, которая при благоприятно протекающей беременности не превышает по длине 3 мм.
Как ныне установлено, во время внутриутробного развития происходит созревание практически всех желез внутренней секреции, между которыми устанавливаются сложные процессы взаимодействия; центральное место в эндокринной системе занимает гипофиз, контролируемая функция которого со стороны гипоталамуса устанавливается еще в период зародышевого развития. Продолжает оставаться невыясненным механизм дифференциации половых желез. Существует теория кортикомедуллярного антагонизма, согласно которой примордиальные половые железы бисексуальны, но как в корковом, так и в мозговом веществе образуются особые морфогенетические вещества.
Так, феминизирующим действием обладает вещество кортицин, а маскулинизирующим действием другое вещество – медуллярин. Однако эти вещества являются не гормонами, а ферментными системами, которые оказывают взаимное ингибиторное действие. По мере дальнейшего роста зародыша в результате пролиферации получается первичный половой тяж, содержащий половые клетки. Из первичного тяжа образуется вторичный, а из последнего – корковый слои яичника; из мозгового вещества образуется тека-ткань.
Что касается роли гипофиза в регуляции гормональной функции гонад эмбриона, то, согласно работам С. Е. Левиной (1974), яичник плода женского пола не обнаруживает гормональной активности в течение всего эмбриогенеза. Однако в гипофизе уже с 13-й недели вырабатывается ФСГ (фолликулостимулирующий гормон), а с 18-й – ЛГ (лютеинизирующий гормон). У плодов мужского пола гипофиз вырабатывает гонадотропины с 12-й недели эмбриогенеза, а по данным Л. Е. Кузнецовой (1971), даже с 8-недельного возраста.
Независимо от пола плода ЛГ появляется в крови с 17-й недели эмбриогенеза. Появление гормональной функции семенников еще до начала секреции гонадотропинов свидетельствует о том, что, по-видимому, в это время не гонадотропины определяют гонадную активность. Это позволяет прийти к заключению, что как гормональная функция гонад, так и развитие полового тракта у человеческого плода происходят независимо от гонадотропной функции гипофиза.
При дальнейшем развитии утробного плода фолликулостимулирующая функция гипофиза постоянно контролируется особым фактором, вырабатываемым половыми клетками.
Этот фактор, названный С. Е. Левиной (1971) гоноцитином, играет важную роль в торможении фолликулостимулирующей функции гипофиза. Усиление выделения ФСГ, являющееся причиной возрастной активизации гопадотропной функции гипофиза, по-видимому, обусловлено ослаблением чувствительности гипоталамо-гипофизарной системы к тормозному действию коноцитина, что связано с возрастными изменениями гипоталамуса.
Как указывает С. Е, Левина в детальном обзоре литературы по данному вопросу, механизмы, обеспечивающие развитие признаков пола у млекопитающих, до последнего времени были изучены недостаточно. Признано только, что изменения числа или состояния Х- и У-хромосом влекут за собой различные нарушения формирования этих признаков. Что касается того, когда и где впервые выявляется пол зародыша млекопитающих, то преобладало мнение, что первым признаком пола является гистологически различимая дифференцировка зачатка зародышевой гонады: семенник или яичник. Однако в настоящее время выяснено, что есть еще более ранние признаки. Фенотипическая дифференцировка пола начинается до формирования семенниковых или яичниковых структур зачатка гонады и относится как к соматическим, так и к половым клеткам раннего эмбриона, т. е. половые различия проявляются на клеточном и органном уровне, Морфогенез выводящих половых путей у зародышей млекопитающих полностью определяется наличием семенника.
В ранней стадии развития эмбриона, как известно, закладываются две пары протоков – вольфовы и мюллеровы каналы. Последние в норме у самца рассасываются, а из вольфовых протоков развивается семяпровод; у самки же рассасываются вольфовы протоки, а из мюллеровых каналов развиваются яйцеводы и матка. После ранней кастрации зародыша самца у него не только сохраняются мюллеровы каналы, но и формируется верхняя часть влагалища. Однако образование последнего может быть предотвращено заместительной андрогенной терапией.
Равным образом, введение андрогенов самке ведет к сохранению у нее вольфовых протоков, т. е. к дифференцировке ее половых путей по типу, характерному для самцов, хотя мюллеровы каналы остаются также. Наличие или отсутствие яичника не влияет на дифференцировку выводящих половых путей зародыша, т. е. вся выводящая половая система зародыша млекопитающих, независимо от хромосомного пола, дифференцируется по характерному для самца типу, если у плода имеется семенник, а при его отсутствии – по типу, характерному для самки. Таким образом, гормоны зародышевого семенника являются основными факторами, обеспечивающими половую дифференцировку генитальных протоков. Необходимые для половой дифференцировки выводящей половой системы гормоны зародышевого семенника делятся на два типа, один из которых вызывает рассасывание мюллеровых каналов и не может быть заменен андрогенами, в то время как второй способствует развитию семяпроводов, наружных половых органов и других отделов половой системы самца, будучи биологически идентичен андрогенам зрелого яичка.
У зародыша человека морфологические и гистохимические признаки секреторной активности появляются в интерстициальных клетках семенника уже в восьминедельном возрасте, а к 10 неделям происходит дифференцировка наружных органов плода по мужскому типу. В случае нарушения андрогенной секреции элементов зародышевого семенника мюллеровы каналы подвергаются обратному развитию, но мужской тип выводящих протоков наружных половых частей не формируется из-за отсутствия андрогенов. В дальнейшем у таких больных отмечается женский фенотип при полном отсутствии половых протоков вследствие того, что еще в зародышевом периоде семенник вызвал регресс мюллеровых каналов, но не предотвратил рассасывание вольфовых протоков. В подобных случаях клинически могут наблюдаться различные нарушения деятельности гонад в пубертатном периоде, обусловливающие неполноценность развития вторичных половых признаков.
От действия половых гормонов зависит половое поведение, т. е. комплекс актов, вызываемых сенсорными стимулами от особи противоположного пола. Принято считать, что центры полового поведения расположены у самца в переднем, а у самки – в центральном отделе гипоталамуса. Однако ядра подкорковых, особенно лимбических структур, а также кора головного мозга участвуют в регуляции полового поведения особи. Согласно данным интересных исследований Dorner, дифференцировка полового поведения не зависит непосредственно от хромосомного пола особи, находясь под определяющим влиянием андрогенов в перинатальном периоде развития.
Раннее введение половых стероидов или отсутствие собственных мужских половых гормонов, например после ранней кастрации, вызывает в зрелом возрасте инверсию полового поведения – мужской или женский гомосексуализм, либо гипосексуальное состояние, что, по данным ряда авторов, наблюдается в клинике примерно у 5–10% мужчин.
Хотя в ранний период дифференцировки пола зародыша половые различия непосредственно зависят от хромосомного пола особи и не обусловлены гуморальными факторами, позднее половая дифференцировка на системном уровне (т. е. вся репродуктивная система, кроме самих гонад) и на уровне организма в целом (секреция гонадотропинов и половое поведение) опосредованы гормонально. Половая дифференцировка клеток и тканей выводящих половых путей, органов-дериватов урогенитального синуса и наружных половых частей, молочных желез, гипоталамических нервных центров и заинтересованных центров спинного мозга целиком определяется гуморальными импульсами, обусловленными сигналами, исходящими из зародышевых семенников. При их недостаточности половая дифференцировка всех упомянутых структур в той или иной степени страдает, что нередко определяется лишь в периоде полового созревания или у зрелых особей. Считается доказанным, что блокада гормонально активных элементов зародышей семенника ведет к развитию женского фенотипа у генетически мужской особи. В частности, введение беременным женщинам на 3–7-м месяце беременности биологически близких к андрогенам гормонов (например, прогестинов) может вызвать маскулинизацию генитальных структур, особенно наружных половых частей плода женского пола.
Фетальные яичники не обладают генеративной функцией, так как в них никогда не удавалось обнаружить признаков овуляции и образования желтого тела; однако имеются все основания предполагать способность женской гонады выделять гормоны.
Признаки гормональной активности, по наблюдениям ряда авторов, начинаются с 28 недель беременности; в частности, довольно интенсивные процессы стероидного синтеза доказываются появлением фосфатазной активности гонад. Участие в гормонообразовании принимают не только зреющие и зрелые, но и атретические фолликулы, что, в частности, доказано Б. И. Железновым путем констатации наличия липидов во внутренней теке указанных фолликулов.
Особый интерес представляют так называемые гормоноком-петентные клетки, куда относятся клетки пфлюгеровых шаров, половые клетки, клетки зернистого слоя, текаткани и сходные с ними в функциональном отношении интерстициальные клеточные элементы. Основным источником стероидных гормонов яичникового происхождения следует признать текаткань. Несомненным остается факт участия хилюсных клеток в гормональном обмене, начиная с антенатального периода, что Н. В. Кобозевой и Ю. А. Гуркину удалось обнаружить в 8,3% всех наблюдений. В упомянутых клетках прослеживается увеличение липидных включений с нарастанием сроков утробного развития.
Н. В. Кобозевой составлена шкала оценок эндокринной активности фетальных яичников (в условных единицах), из которых следует, что этапы Функциональной дифференциации идут параллельно с усложнением структуры яичника; если в срок до 26 недель эта активность приближается к 30 условным ед., то в 29–32 недели она равна 60 ед., а после 33 недель до конца беременности достигает 100 условных ед.
Помимо анатомической асимметрии в большинстве случаев удается установить также функциональную асимметрию, причем обычно более активным оказывается правый яичник.
Подводя итоги современному состоянию вопроса, Н. В. Кобозева и Ю. А. Гуркин считают признанными следующие факты:
- внегонадное происхождение половых клеток;
- строгую стадийность развития гонад, которые вначале структурно индифферентны;
- высокую структурную дифференциацию яичников к концу внутриутробного развития;
- функциональную активизацию их в последнем триместре беременности.
Важным свидетельством гормональной деятельности фетальных яичников является обнаруженная указанными авторами фосфатазная активность эндотелия овариальных сосудов, которая в последние два месяца беременности нарастает в 5–10 раз по сравнению с ее уровнем в начальные сроки беременности.
Что касается источников функциональной активности фетальных яичников, то наиболее реальным источником ее следует считать плаценту (хорионический гонадотропин); местом приложения действия ее гормонов признается, в основном, тека-ткань.
Еще в начале нынешнего века исследователи обратили внимание на нередко встречающийся поликистозный вид яичников у многих подвергшихся вскрытию новорожденных. Обнаружение эстрогенов в высокой концентрации заставляет рассматривать такие кистозно измененные яичники как высокоактивные в эндокринном отношении образования.
Первоначальные предположения о том, что кистозные яичники следует считать вариантом нормы, в настоящее время опровергнуты наблюдениями, доказавшими, что такие изменения, в основном, наблюдаются у новорожденных, матери которых страдали поздним токсикозом или какими-либо длительными соматическими заболеваниями.
Согласно результатам исследований В. Г. Вартапетовой, при нормально протекающей беременности определяется нормопластический тип строения яичников плодов. Гипо- или гиперпластический тип строения встречаются лишь у тех доношенных новорожденных, внутриутробное развитие которых происходило в неблагоприятных условиях (длительный токсикоз у беременных матерей, грипп, туберкулез, резус-конфликт и др.). Поскольку изменения в яичниках без сочетания с какими-либо более тяжелыми уродствами совместимы с жизнью новорожденных и могут оставаться длительное время нераспознанными, допустимо предположение, что частота таких изменений значительно больше обнаруживаемой при вскрытии мертворожденных или новорожденных, погибших в перинатальном периоде.
Согласно данным исследований Н. В. Кобозевой, Ю. А. Гуркина и др., нет строгой специфичности в воздействии того или иного заболевания матери на яичники плода. Гораздо большее значение имеет длительность воздействия этих факторов, в особенности позднего токсикоза беременности. Это осложнение приводит как к подавлению структурно-функциональной дифференцировки яичников, так в ряде случаев и к ее акселерации; более легкое клиническое течение способствует активизации яичников, более длительное – отставанию в созревании гонад.
При изучении особенностей анатомической и функциональной асимметрии фетальных яичников установлено, что начиная с 7-го лунного месяца разнообразные неблагоприятные факторы внешней для плода среды (гипоксия, инфекция, дисгормоноз и др.) ведут к нарушению не только структуры, но и эндокринной функции гонад. Тормозящим влиянием обладают более тяжелые клинические формы токсикоза беременных, в особенности в случае сочетания их с соматическими заболеваниями. Особенную чувствительность к неблагоприятным факторам проявляют половые и гранулезные клетки, в результате чего в постнатальной жизни подобные яичники могут оказаться функционально несостоятельными. Однако и избыточная гормональная активность фетальных яичников может привести к их обеднению герминативными элементами, что, по-видимому, в ряде случаев становится причиной некоторых заболеваний, проявляющихся в периоде полового созревания или половозрелости (ювенильные кровотечения, недоразвитие полового аппарата, первичная аменорея, бесплодие, ранний климактерий и др.).
Важно ныне общепризнанное положение, что яичники плода могут быть поражены не только в пору возникновения половой закладки, но также и на последующих этапах дифференцировки гонад, в частности в период их функционального созревания, который, начиная с 28 недель, достигает максимума после 33 недель.
Между 18 и 24 неделями беременности в организме плода возникают структуры и появляются обусловленные ими функции, характеризующие закономерность, названную П. К. Анохиным системогенезом. В. И. Бодяжина (1963, 1966) считает этот срок критическим, наряду с общепризнанными известными ранними критическими периодами развития эмбриона (Н. Л. Гармашева, 1959; П. Г. Светлов). По мнению Н, В. Кобозевой и Ю. А. Гуркина, срок с 27 по 32 недели беременности можно считать критическим для функций фетальных яичников. На основании ряда данных правый яичник должен быть признан более зрелым и гормонально более активным по сравнению с левым, что представляет практический интерес для гинекологической клиники.




