Автоматизация исследования клеток
В данной статье будут рассмотрены автоматизированные устройства для фиксации и окраски мазков крови, автоматизация микроскопии и автоматизация проточной цитометрии.
Автоматизированные устройства для фиксации и окраски мазков крови
Используются два принципа: погружение мазков в краситель и извлечение из него; опрыскивание или заливка мазков красителем. Окрашенные мазки автоматически промываются дистиллированной водой или фосфатным буфером и высушиваются. Действия оператора сводятся к подготовке устройства к работе и распределению стекол с мазками в носителе. После завершения цикла окрашивания мазки остаются в этом носителе или попадают в емкость для них, а затем в камеру для высушивания в принудительном потоке воздуха. Варианты конструкции предусматривают: линейный транспорт мазков; поточно двигающиеся платформы; центрифужные распылители, в которых реактивы распыляются на мазки, расположенные во вращающейся карусели.
Классическим примером полностью автоматизированной системы окрашивания мазков крови является аппарат «Неша-Тек 2000» (США). Он обеспечивает автоматическую окраску гематологических препаратов на стандартизованных по размеру предметных стеклах до одинаковой глубины и отчетливости, полностью автоматизированное прохождение мазка через три дополняющих друг друга этапа окрашиваниях производительностью 60 мазков в час. Вновь поступившие мазки загружаются без прерывания работы устройства. В конце процесса окрашенные и высушенные мазки, готовые к немедленному исследованию под микроскопом складываются в специальном ящике для хранения.
Устройство имеет ряд преимуществ: обеспечивает автоматизированное равномерное окрашивание мазков, а значит, и получение воспроизводимых результатов; автоматически регулирует все параметры процесса окрашивания гематологических препаратов, за исключением получения мазка крови; автоматически дозируемые растворы обеспечивают точный химический баланс и оптимальную степень окрашивания каждого мазка крови; значительно повышает производительность труда в лаборатории, специалисты, занятые на данном участке работы, освобождаются для других работ; устраняется необходимость в трудоемком приготовлении окрашивающих и буферных растворов, так как устройство обеспечивается специальными наборами реактивов, каждой из которых содержит точно стандартизованные растворы уникального состава; устраняется необходимость в трудоемком процессе чистки и уборки рабочего места, попадание красителя на рукц одежду, рабочий стол; предлагается широкий выбор режимов окрашивания. Однако, приобретая это устройство, пользователю необходимо учитывать некоторые особенности его применения – стандартизованные по размерам предметные стекла, которые бы не мешали процессу продвижения препаратов в технологической цепочке, и реактивы от изготовителя – «закрытые», обеспечивающие высокое качество окрашивания и бесперебойную работу перистальтических насосов.
Современные устройства для фиксации и окраски мазков крови имеют встроенные микропроцессоры, позволяющие программировать объемы реактивов, процедуру их розлива, временные параметры, вносить необходимые изменения в эти параметры в случае необходимости, наблюдать за ходом всех процессов на дисплее. Так, прибор «CELL-DYN SMS» (США) способен автоматически выполнить все процедуры приготовления мазков крови: отбор крови из пробирки с образцом, нанесение мазка на пленку, печатание там же идентификационных данных о пациенте, проведение процедуры окраски по одному из 10 запрограммированных протоколов со скоростью до 120 проб в час. Некоторые варианты таких приборов используются только с реактивами фирм- изготовителей, т. е. являются «закрытыми» системами.
Автоматизация микроскопии
Автоматизация исследований клеток может быть осуществлена несколькими способами. Принципиально новый класс микроскопов – автоматические микроскопы-анализаторы — самостоятельно выполняют основные этапы исследования. В состав такого микроскопа-анализатора кроме цифрового микроскопа входят автоматические средства перемещения и фокусировки препарата (моторизованные предметный стол и узел фокусировки, блок управления) (рис. 11.1). Автоматически избирается маршрут просмотра препарата, фокусируются и обнаруживаются клетки заданных типов, контролируется качество приготовления препарата и условий наблюдения. В сравнении с ручной микроскопией есть возможность значительно увеличить выборку просматриваемых клеток, следовательно, повысить объективность и точность анализа, автоматически классифицировать клетки по субпопуляциям, представлять их на экране монитора для просмотра врачу в виде галерей изображений.
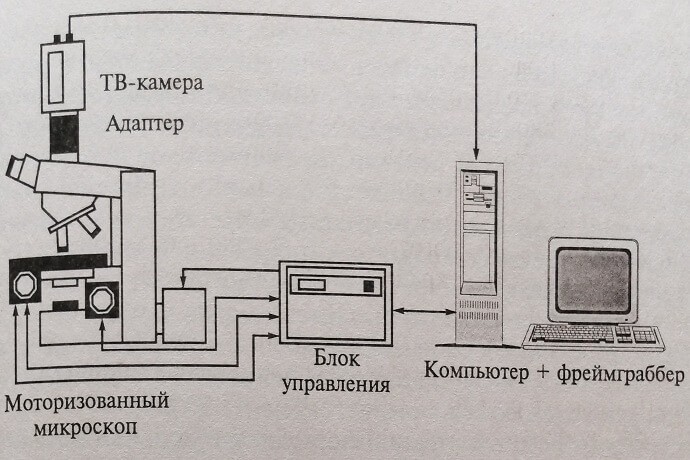
Рис. 11.1. Схема микроскопа-анализатора
При классификации лейкоцитов и эритроцитов используют статистические параметры формы, размеров, окраски, текстуры, полученные на основе архива из 300 000 изображений. Врач избавляется от рутинных операций по сбору выборки клеток и выполняет роль эксперта. В нашей стране функции автоматизированного микроскопа удалось реализовать для анализа мазков крови (МЕ-КОС-Ц1, вариант 1, производительность 20 мазков в час, предусмотрена возможность подключения гематологического анализатора), подсчета клеток крови в камере Горяева, анализа препарата фекалий при исследованиях в паразитологии с производительностью 15 препаратов в час (МЕКОС-Ц1, вариант 3), осадка мочи, подсчета популяции лимфоцитов, меченных FITC, с использованием компьютерных программ «Денситоморфометрия» и «Фонотека».
Отечественная программа «Денситоморфометрия» предназначена для того, чтобы после полуавтоматического определения контуров объектов определять более 20 их характеристик, включая оптическую плотность, форму, размеры, текстурные и другие характеристики. С помощью программы «Фонотека» можно создавать базы высококачественных видеоизображений, структурировать и вести документацию, а также импортировать, экспортировать, редактировать и формировать галереи изображений.
Анализ мазка крови с использованием МЕКОС-Ц1 происходит следующим образом: лаборант устанавливает мазок на предметный столик автоматизированного микроскопа и нажимает кнопку клавиатуры. Далее система начинает сканировать препарат, отображая на экране монитора траекторию движения и выделяя клетки заданных типов. Через 2 мин после начала сканирования препарата на экран монитора выводятся все обнаруженные лейкоциты в виде отдельных галерей (сегментоядерных, палочкоядерных лейкоцитов, лимфоцитов, моноцитов, эозинофилов и т.д.).
Если в анализируемом мазке присутствуют бластные клетки, то после завершения просмотра они представляются в виде отдельной галереи под названием «прочие». В этой же галерее предоставляются все случаи, связанные с нарушением технологии приготовления мазка и его окраски. Врач-гематолог просматривает представленные галереи клеток и при необходимости нажатием 1-2 клавиш корректирует результаты автоматического анализа.
На основе автоматизированных микроскопов МЕКОС-Ц1 создается автоматизированное рабочее место (АРМ) врача-гематолога, в котором сочетаются исследования на гематологическом анализаторе с микроскопическим анализом морфологии клеток крови. Точность дифференцировки лейкоцитов с применением АРМ врача-гематолога составляет не менее 90 %.
На просмотр лейкоцитарной формулы и при необходимости ее коррекцию у врача уходит 30-40 с. Аналогичным образом программа автоматического анализа создает «эритроцитарную формулу» крови, когда в отдельные галереи выделяются микроциты, нормоциты, макроциты и все патологические формы эритроцитов (каплевидные, дакриоциты, эхиноциты, сфероциты и т.д.), морфологический анализ при этом дополняется автоматическим построением кривой Прайс-Джонса и уникальной гистограммы распределения эритроцитов по содержанию гемоглобина.
При исследовании эритроцитов в препарате анализируется не менее 1000 клеток. Точность автоматизированного анализа параметров красной крови составляет не менее 99 %. Для анализа мазков крови при лейкозах и подсчета миелограмм в мазках костного мозга существует специальная программа.
Полностью автоматизированные системы для микроскопии наряду с автоматизацией самого процесса микроскопии включают и компьютерный анализ, т. е. распознавание и классификацию изображений. Такая система состоит из автоматизированного микроскопа, в который ручным способом вносят фиксированные и окрашенные мазки биоматериала, она сканирует препарат, фиксирует изображения клеток, «просеивает» изображения с помощью сложной аналитической системы, основанной на принципе «нервной сети» (neural network). Системы автоматического анализа изображений разработаны и для флюоресцентной микроскопии.
На аналогичном принципе основана работа отечественной системы автоматической микроскопии мазков периферической крови «АСПЕК» (автоматический скрининг периферической крови). Система может использоваться как автоматический счетчик для выполнения гематологических анализов в клинико-диагностических лабораториях, как исследовательская система для проведения морфометрии клеток и демонстрационная установка в учебном или экспертном процессе.
Другим примером автоматизированных систем анализа изображения клеток являются системы фирмы «ВидеоТесТ» (Санкт-Петербург). Система «ВидеоТесТ-Мастер (Морфология)» обеспечивает преобразование и анализ изображений, полученных с помощью цветной камеры высокого разрешения, установленной на микроскопе. Результаты обрабатываются статистически. Изображения и данные могут быть сохранены в базе данных «ВидеоТесТ-Альбом».
Программа «ВидеоТесТ-Сперм» обеспечивает анализ видеоизображений нативных эякулятов спермы и используется для изучения морфологии сперматозоидов в окрашенных мазках.
Система «ВидеоТесТ-Карио» позволяет выполнять хромосомный анализ, обеспечивает ввод метафазных пластинок с микроскопа с помощью цифровой камеры, автоматическое кариотипирование, построение кариограмм и идиограмм. «ВидеоТесТ-Подсчет колоний» – система, предназначенная для выделения, подсчета, измерений, идентификации колоний бактерий одного, двух, трех, четырех типов.
Дальнейшим шагом является подключение микроскопа в систему телемикроскопии для осуществления консультации у специалистов, находящихся в другом учреждении или городе.
Автоматизация проточной цитометрии
В современных технологиях гематологического анализа все шире используются проточные анализаторы разного уровня сложности. Но, несмотря на все достоинства, даже самые совершенные современные анализаторы не могут полностью заменить микроскопический анализ клеток крови. Этот метод должен сохраняться на вооружении в любой лаборатории, выполняющей гематологические исследования, поскольку является «золотым стандартом».
Преимущества современных проточных анализаторов для подсчета и оценки форменных элементов крови состоят в следующем: высокая производительность (до 100-120 проб крови в час); микроанализ (объем пробы – 12-150 мкл крови); анализ большого массива (десятки тысяч) клеток; высокая точность (правильность и воспроизводимость); большое количество одновременно определяемых и рассчитываемых параметров (более 20); графическое представление результатов исследований (гистограммы, скетограммы).
Технология автоматического подсчета клеток была разработана в 1947 г. братьями Култер. Метод получил название апертуро-импедансного (или метод электрического импеданса, кондуктометрический метод, метод Култер).
Принцип метода. Метод основан на подсчете числа и определении характера импульсов, возникающих при прохождении клеток через отверстие малого диаметра (апертуру) в узкой капиллярной трубке диаметром порядка 100 мкм, по обе стороны от которой расположены изолированные друг от друга электроды сети постоянного тока. Если через этот узкий канал, заполненный электропроводящим раствором, проходит клетка крови, то в этот момент сопротивление электрическому току в канале слегка возрастает (рис. 11.2), это изменение улавливают современные электронные приборы. Таким образом, каждый случай прохождения клетки через канал сопровождается появлением электрического импульса, и для того чтобы подсчитать концентрацию клеток, необходимо пропустить через него определенный объем суспензии клеток в электропроводящем растворе и сосчитать число электрических импульсов, которые при этом образуются.
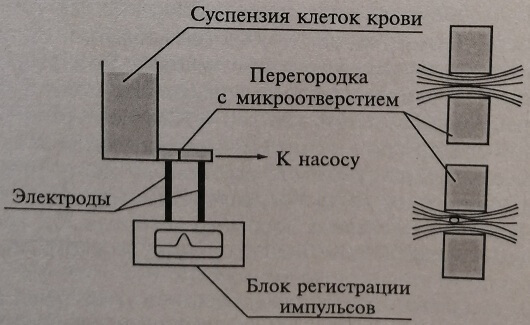
Рис. 11.2. Схема работы кондуктометрического счетчика клеток: справа вверху показаны линии прохождения электрического тока через микроотверстие в отсутствие клетки крови, внизу – в том случае, когда через микроотверстие проходит клетка крови
Если в канале одномоментно находятся две клетки, то образуется один импульс, и это приведет к ошибке подсчета клеток. Для исключения этих ошибок пробу крови разводят до такой концентрации клеток, при которой в канале датчика всегда будет не более одной клетки. При характерном диаметре канала 80 мкм и его длине 100 мкм, объем измерительного канала получается 0,5 мм3. В этом случае, чтобы уменьшить концентрацию клеток крови до нужной величины, необходимо выполнить разведение крови в 25 000 раз.
Задача разделения эритроцитов и тромбоцитов в проточных анализаторах решается путем измерения амплитуды (высоты) электрического сигнала. Тромбоциты — клетки, меньшие по размерам, чем эритроциты, они образуют импульсы низкой амплитуды, а сравнительно большие по размерам эритроциты дают импульсы высокой амплитуды. Устройство, разделяющее импульсы по величине амплитуды, называется дискриминатором. В современных гематологических анализаторах встроены многоканальные дискриминаторы. Поскольку каждый канал соответствует определенному объему клеток (рис. 11.3), они дают детальную информацию о размерах клеток в виде гистограмм (рис. 11.4).
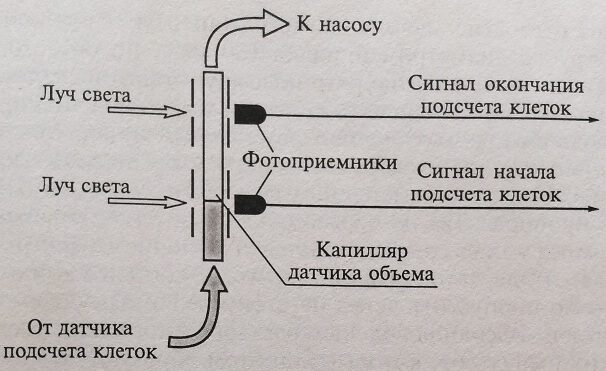
Рис. 11.3. Схема датчика объема клетки
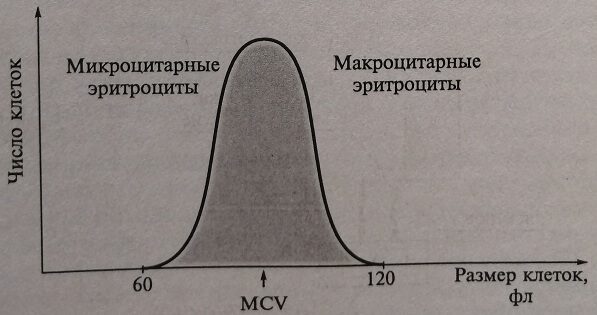
Рис. 11.4. Гистограмма распределения эритроцитов по объему, полученная в автоматическом цитометре: по оси абсцисс – объем клеток в фемтолитрах; по оси ординат – число клеток; медиана – средний объем клеток (MCV); коэффициент вариации или среднее квадратичное отклонение – ширина распределения (RDW)
После выделения на гистограмме зоны объемов клеток, соответствующих эритроцитам, и после суммирования данных, зарегистрированных по всем каналам дискриминатора, получают общее количество эритроцитов (они в современных анализаторах обозначаются аббревиатурой RBC (от англ. red blood cells)), прошедших через датчик. При суммировании результатов подсчета эритроцитов, полученное в каждом канале значение умножают на объем соответствующего канала, в результате автоматически вычисляют объем, который занимают эритроциты в крови, т е значение гематокрита НСТ. При делении величины гематокрита на концентрацию эритроцитов получают характеристику эритроцитов — средний корпускулярный объем (mean corpuscular volume – MCV). Этот показатель используют также для расчета коэффициента вариации объема эритроцитов и обозначают как RDW (red cell distribution width). Он является показателем гетерогенности эритроцитов по объему, характеризует степень анизоцитоза. Аналогичным образом измеряют концентрацию тромбоцитов – PLT(platelet), тромбокрит – РСТ (platelet crit), средний объем тромбоцитов (mean platelet volume – MPV), ширину распределения тромбоцитов по объему (platelet distribution width – PDW), рассчитывают как коэффициент вариации тромбоцитометрической кривой. Этот показатель количественно отражает гетерогенность популяции тромбоцитов по объему, т. е. степень анизоцитоза тромбоцитов.
В отличие от ручного подсчета тромбоцитов, при котором проводят предварительный лизис эритроцитов, в проточных гемоцитометрах подсчет эритроцитов и тромбоцитов выполняют в одной камере без предварительной обработки крови. При этом возникают проблемы дифференцировки больших форм тромбоцитов (макротромбоцитов) и сравнимых с ними по объему эритроцитов (микроцитов), их фрагментов (шизоцитов), а также отшнуровавшихся фрагментов цитоплазмы лейкоцитов (клеточный дебрис).
Для предупреждения подсчета одних элементов вместо других в кондуктометрических счетчиках анализируется не только амплитуда электрического импульса, но и его форма. Встроенные дискриминаторы определяют высоту электрического сигнала, пропорциональную размеру частицы, и ширину (длительность) импульсов. Таким образом, все импульсы, соответствующие размерам частиц от 1,8 до 30,0 фл, подсчитываются как тромбоциты. Если амплитуда импульса превышает соответствующую размерам 30 фл, появляется сообщение «Micro RBC», либо «Macro PLT», при этом происходит автоматическая коррекция количества тромбоцитов и выдается истинный результат.
Поскольку размеры эритроцитов и лейкоцитов близки, разделить их по величине амплитуды электрического импульса невозможно. Поэтому лейкоциты вносят некоторый вклад в подсчет эритроцитов. Но вклад этот, за исключением явных лейкоцитозов, ничтожно мал, им можно пренебречь, так как в норме концентрация эритроцитов в крови на три порядка выше концентрации лейкоцитов. Для раздельного определения концентрации лейкоцитов (white blood cells – WBC) и эритроцитов в крови используют различие свойств мембран этих клеток к действию гемолитиков.
Эритроциты легко лизируются под действием поверхностноактивных веществ. Претерпевающие при этом некоторые изменения лейкоциты остаются целыми и могут быть подсчитаны. Поэтому перед подсчетом лейкоцитов в кондуктометрических счетчиках, прежде, чем пропустить кровь через апертуру датчика, к ней добавляют раствор, лизирующий эритроциты. Мелкие фрагменты, до которых разрушаются эритроциты, дают электрические импульсы очень низкой амплитуды и не мешают определению лейкоцитов.
Во всех современных проточных цитометрах есть возможность для определения концентрации гемоглобина с помощью встроенных в них гемоглобинометров. Поэтому кроме определения концентрации гемоглобина НЬ, имеется возможность рассчитать среднее содержание гемоглобина в эритроците (mean corpuscular hemoglobin – МСН) в пикограммах, которое очень важно знать при разделении анемий на нормохромные, гипо- и гиперхромные. Среднее содержание гемоглобина является более объективным показателем, чем цветной показатель, не отражающий синтез гемоглобина в эритроците и его содержание в нем. Метод позволяет рассчитать также среднюю концентрацию гемоглобина в эритроците (mean corpuscular hemoglobin concentration – MCHC), которая отражает истинное насыщение эритроцита гемоглобином.
Получаемую в результате проточной цитометрии информацию можно разделить на две основные группы – параметры непосредственно измеряемые на этих анализаторах, например RBC, PLT, WBC, НЬ, и расчетные параметры, такие, как MCV, МСН, MCHC, РСТ, PCV, PCD и др.
Гистограммы распределения отдельных типов клеток крови по размерам, которые также выдаются при этом автоматическом анализе, как и возможность получения новых параметров, по сравнению с ручными визуальными измерениями избавили специалистов лабораторий от необходимости использовать трудоемкие методы.
С помощью автоматических счетчиков клеток крови можно не только оценить размеры клеток, но и получить цитохимические и другие характеристики клеток крови. Они анализируют около 10 000 клеток в одном образце и имеют несколько различных каналов для подсчета клеток и определения гемоглобина.
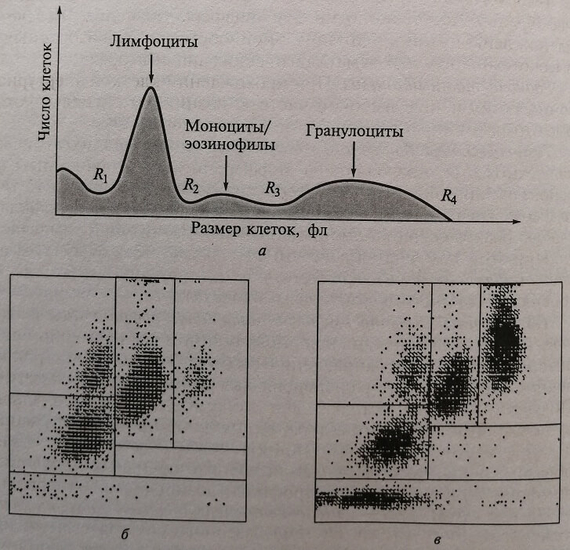
Современные цитометры наряду с кондуктометрическим методом могут быть оснащены устройствами для оценки рассеяния света лазера, что дает возможность строить скетограммы, т.е. диаграммы распределения клеток по их способности рассеивать свет лазера. Это позволяет более четко выделять различные группы клеточных элементов, отличающиеся не только по размеру, но и по зернистости.На гистограмме клеток крови, полученнии с помощью анализатора «Coulter STKS» (рис. 11.5), видны пики лимфоцитов, моноцитов, эозинофилов, гранулоцитов, а также «флаги» – сигналы о наличии нетипичных клеток: R1 – наличие ядерных эритроцитов, сгустков тромбоцитов, больших тромбоцитов, криоглобулина, малых лимфоцитов, нелизированных эритроцитов; R2 – реактивные лимфоциты, лимфобласты, базофилы, свертки крови; R3 – эозинофилия, моноцитоз, бласты, сгустки крови.
Рис. 11.5. Гистограмма распределения клеток крови по объему на анализаторе Coulter STKS: а – пример графического распределения лейкоцитов; б – скетограмма нормального соотношения лейкоцитов; в – скетограмма при эозинофилии
Отечественный гематологический анализатор «МИКРОН-2000» позволяет анализировать 21 гематологический параметр с производительностью 60 анализов в час. Для анализа требуется 20 мкл капиллярной или 150 мкл венозной крови. Однако возможно дифференцированное определение лишь трех гранулоцитов, лимфоцитов и клеток, промежуточных межцу лимфоцитами и гранулоцитами (средние клетки, моноциты).
Сочетание кондуктометрического принципа с применением радиочастотного анализа, рассеивания света лазера, дифференцирующих лизатов, специфического окрашивания клеток позволило расширить использование автоматических анализаторов для исследования различных клеточных элементов крови, в первую очередь для дифференциального подсчета лейкоцитов.
На высокотехнологичных гематологических анализаторах выполняется дифференцированный счет лейкоцитов по пяти основным категориям. Кроме того, эти анализаторы обладают системами «сигналов тревоги». Это – сигналы, предупреждающие и концентрирующие внимание оператора на наличие в образцах патологических клеток.
Технологии автоматизированной цитометрии
Можно выделить несколько типов технологий для дифференциального подсчета клеток, лейкоцитов и лейкоцитарной формулы, реализованных в высокотехнологичных гематологических анализаторах.
Радиочастотный анализ. При прохождении клеткой апертурного отверстия в токе высокой частоты возникают сигналы, которые отражают характер внутренней структуры клетки.
Технология пероксидазного канала. Это проточная цитохимическая технология, позволяющая дифференцировать лейкоциты на основе различной активности пероксидазы в них. Активность этого фермента наиболее выражена в эозинофилах и нейтрофилах, слабую реакцию дают моноциты, в лимфоцитах она не выявляется. При этом измеряется рассеяние клетками света от луча лазера (так определяется размер клеток) и поглощение клеткой света (оценка активности пероксидазы в клетке).
Технология VCS – трехмерный анализ дифференциации лейкоцитов. Технология основана на одновременном компьютерном анализе клеток по трем направлениям: объем (volume), электропроводность (conductivity), дисперсия лазерного света (laser scatter). Полученные по трем каналам данные комбинируются и анализируются с помощью компьютера, в результате происходит распределение клеток по дифференцировочным кластерам, и, таким образом, лейкоциты разделяются на пять основных популяций: лимфоциты, моноциты, нейтрофилы, эозинофилы, базофилы.
Технология MAPSS – изменение дисперсии лазерного света клетками. Это многоугловая система лазерного светорассеяния, или поляризация многоуглового светорассеяния, т.е. регистрация интенсивности светорассеяния клетками поляризованного лазерного луча под разными углами. Технология компьютерного анализа дисперсии лазерного света клетками крови применена в гематологических автоанализаторах фирмы «Abbott» для дифференциации эозинофилов и базофилов. С помощью этой технологии могут
быть получены сведения о различных свойствах клеток и в pe3v тате на гематологических анализаторах строятся скетограммы лейкоцитов крови.
Технология с использованием специфического химического лизис лейкоцитов. Технология основана на предварительной обработке лейкоцитов реактивами, вызывающими дифференцированный лизис всех клеток, за исключением лейкоцитов определенной популяции (эозинофилов или базофилов). Затем проводят дискриминантный анализ всех клеток по размеру и сложности структуры.
Измерение флюоресценции красителей, связанных с избирательными клеточными структурами. Технология лежит в основе проточной цитофлюориметрии. Наибольшее применение в цитофлюориметрии нашли методики распределения клеток по содержанию ДНК и флюоресцентные метки клеток антителами (иммунофенотипирование), которые можно применить одновременно на одном образце.
В проточных цитометрах флюоресценция имеет несколько преимуществ: флюоресцентное излучение прямо пропорционально специфическим клеточным компонентам, концентрация флюорохромов, используемых для исследования клетки, очень низкая, нефлюоресцирующие соединения могут становиться флюоресцирующими при взаимодействии с внутриклеточными структурами или ферментами.
Дальнейшее развитие проточная цитометрия получила за счет сочетания трех аналитических принципов: одновременного применения оптических эффектов флюоресценции, переднего (FSC) и бокового (SSC) светорассеяния; метода специфического связывания с использованием разнообразных моноклональных антител при возможном одновременном связывании нескольких моноклональных антител с различными антигенами одной и той же клетки для более точной ее антигенной характеристики (двойное, тройное, четырехточечное связывание; нанесение меток на моноклональные антитела разнообразными флюорохромами, отличающимися своими флюоресцентными характеристиками (многоцветная флюорометрия) использования разных источников света, в том числе одновременного (например, двух лазеров).
Вследствие перечисленных свойств современные проточные цитофлюорометры значительно превосходят по своим аналитическим возможностям гематологические анализаторы, предназначенные для подсчета количества клеток, позволяя одновременно исследовать множество клеточных популяций в одной пробе с помощью нескольких методов и маркеров.
Принципиальная схема цитофлюорометра приведена на рис. 11.6.
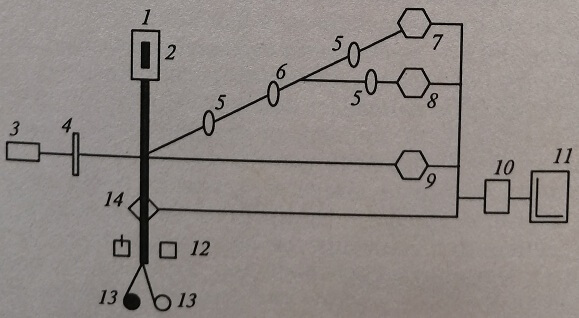
Рис. 11.6. Схема устройства проточного цитофлюорометра: 1 – проточная камера; 2 – зона гидродинамического фокусирования; 3 – источник света; 4 – линзы; 5 – светофильтры; 6 – зеркала; 7 – фотодетектор света флюоресценции; 8 – фотодетектор бокового светорассеяния; 9 – фотодетектор прямого светорассеяния; 10 – электронная система обработки данных; 11 – дисплей; 12 – сортер; 13 – резервуары для разделенных клеток; 14 – пьезоэлектрический детектор