Аменорея
Аменорея – отсутствие менструаций. Это не всегда патологическое состояние, так как в определенные периоды жизни женщины она является физиологическим состоянием. Аменорею различают первичную и вторичную. Первичная аменорея – полное отсутствие менструации у женщины на протяжении предшествующей жизни, вторичная – отсутствие бывших ранее регул не менее чем в течение 3 мес. Аменорея может быть истинной и ложной. Истинная аменорея – отсутствие циклических процессов в яичнике, матке, в системе гипофиз – гипоталамус. Ложная аменорея – отсутствие регул при наличии циклических процессов в матке, яичниках. Она наблюдается при анатомических пороках развития половых органов – при атрезии или отсутствии влагалища, зарастании маточного зева в результате Рубцовых изменений, при сплошной девственной плеве. В определенное время появляется боль внизу живота, в области поясницы, иногда имеется картина острого живота в результате поступления крови через трубы в брюшную полость. При влагалищном или ректальном исследовании удается пропальпировать гематокольпос, гематометру или гематосальпинкс. До следующих регул эти образования могут рассасываться. Лечение ложной аменореи – хирургическое.
Факторы, провоцирующие аменорею, показаны на следующем рисунке.

Виды аменореи
По этиологическому фактору истинная аменорея бывает физиологической и патологической.
Физиологическая аменорея встречается в детском возрасте, в течение беременности, во время лактации, в старческом возрасте. Во время беременности происходит образование плаценты, продуцирующей стероидные (эстрогены, прогестерон), и белковые (хорионический гонадотропин) гормоны. Циклические процессы в гипофизе, половых органах отсутствуют. Очень редко на фоне наступившей беременности можно встретить продолжение функциональных изменений в матке, яичниках. У 75% женщин, кормящих ребенка грудью, отмечается «лактационная» аменорея, длящаяся от 5 мес до 2 лет. Механизм «лактационной» аменореи нервнорефлекторный: в результате раздражения рецепторов молочной железы нервные импульсы поступают в гипофиз, стимулируя выделение ЛТГ, увеличивающего секреторную функцию молочных желез и угнетающего гонадотропную функцию гипофиза, – наступает аменорея. Иногда у кормящих женщин встречаются ановуляторные циклы.
В старческом возрасте наружные и внутренние половые органы у женщины атрофируются, половые железы не функционируют, угнетается выделение гонадотропных гормонов.
Первичная патологическая аменорея чаще наблюдается при резком недоразвитии или аплазии матки и яичников на фоне общего инфантилизма. Причиной задержки развития организма могут быть перенесенные тяжелые заболевания (туберкулез, малярия), неправильное питание в детстве, гипофункция или гиперфункция гипофиза. Возникновение повреждающих факторов в детском возрасте, а тем более внутриутробно, чаще всего сопровождается соматическими нарушениями, в первую очередь отсутствием вторичных половых признаков, недоразвитием гениталий, угнетением или усилением роста.
В этиологии аменореи большое место могут занимать нарушения функции надпочечника, гипоталамуса, щитовидной и других желез внутренней секреции, а также хромосомные нарушения.
К вторичной патологической аменорее могут привести как местные, так и общие факторы. К первым относятся опухоли, аномалии положения женских половых органов, нагноительные воспалительные процессы, свищи акушерско-гинекологического происхождения; ко вторым– хронические отравления морфием, ртутью, свинцом, острые инфекционные заболевания, хронические инфекции, анемии, неполноценное питание, нарушение функций желез внутренней секреции, особенно понижение функции гипофиза в результате воспаления, опухолей, патологического послеродового периода.
Обычно соматическое развитие при вторичной аменорее не нарушено или нарушено в гораздо меньшей степени, чем при первичной.
Различают аменорею с поражением гипоталамуса, гипофиза, яичников, матки, надпочечников, щитовидной железы. В результате взаимосвязи в деятельности эндокринных желез нарушения функции одной всегда вызывают целый комплекс изменений в остальных. Разделение аменореи по такому принципу позволяет выявить ведущее звено в механизме ее возникновения, а следовательно, помогает в выборе патогенетической терапии.
В зависимости от преимущественного поражения органа можно условно выделить аменорею центрального и периферического генеза. К первой группе относятся нарушения деятельности гипоталамуса, гипофиза и коры головного мозга. Определенное значение в развитии аменореи имеет нервно-психический фактор, так как регуляция полового цикла находится под непосредственным действием высших отделов центральной нервной системы. Сильный испуг, длительные тяжелые переживания, психозы часто ведут к отсутствию регул. Диагноз обычно не представляет затруднений, и менструальный цикл восстанавливается при устранении неблагоприятного фактора.
Психогенная аменорея может возникать при ложной беременности, которая иногда бывает при страстном желании иметь ребенка или, наоборот, при страхе в связи с возможной беременностью. В этом случае наблюдаются иногда и гормональные изменения: экскреция го-надотропных гормонов оказывается увеличенной. Диагностика этого вида аменореи тоже не представляет особых трудностей: матка в таких случаях не увеличена, количество экскретируемых эстрогенов находится в пределах нормы для небеременных женщин, а прегнандиола несколько выше нормы.
Аменорея с преимущественным поражением гипоталамуса может возникать как в детском возрасте, так и после полового созревания. В последнем случае наблюдается первичная аменорея, сочетающаяся с гипогонадизмом и часто с ожирением. Наиболее частые формы гипоталамической аменореи – адипозно-генитальная дистрофия (синдром Бабинского-Фрелиха) и персистирующая лактация в сочетании с аменореей и гипотрофией половых органов (синдром Киари-Фроммеля).
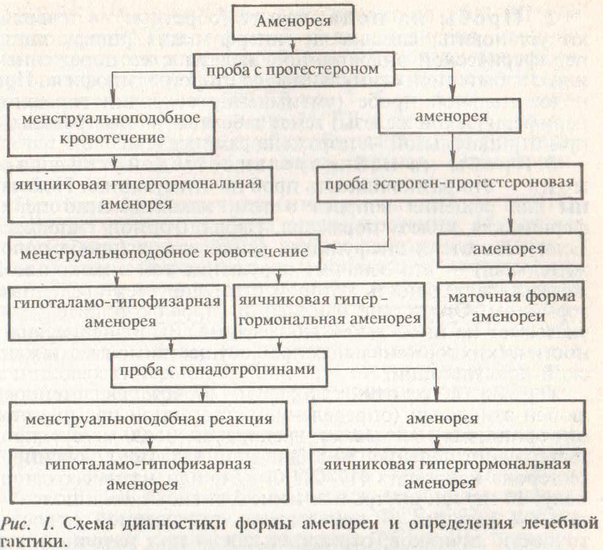
Классификация форм аменореи приведена на рисунке 1.
Синдром Бабинского-Фрелиха
Синдром Бабинского-Фрелиха развивается чаще всего до наступления полового созревания и характеризуется ожирением, недоразвитием или атрофией половых желез и задержкой роста (у детей). Заболевание возникает в результате поражения паравентрикулярных и вентро-медиальных ядер гипоталамуса опухолью или воспалительным процессом. Нередко развивается после нейрогенных инфекций, а также после перенесенных в детстве свинки, брюшного тифа, гриппа.
Клиника заболевания характеризуется медленным течением. Важно установить начало его, так как адипозо-генитальная дистрофия у взрослых обычно является следствием заболевания, развившегося в детском возрасте. Отмечается усиленное накопление подкожной жировой клетчатки в области живота, таза, бедер и грудных желез. Лицо округлое; масса превышает норму на 15-30 кг. Кожа у больных мягкая, нежная, часто имеет мраморный вид. Интеллект не нарушен.
На лобке и в подмышечной впадине волосы очень редкие или отсутствуют. Половые органы гипопластичны, малые половые губы недоразвиты, влагалище узкое, матка значительно уменьшена в размерах.
При опухолевой форме заболевания может отмечаться расширение турецкого седла, а также симптомы сдавления зрительных нервов вплоть до их атрофии, повышение внутричерепного давления, головная боль. При лабораторных исследованиях для адипозо-генитальной дистрофии характерно резкое снижение экскреции ФСГ и ЛГ, а также эстрогенов и прегнандиола. В вагинальном мазке преобладают промежуточные клетки, часто встречаются парабазальные и базальные (до 30-40%), поверхностные единичные. Сахарная кривая после нагрузки – плоская, основной обмен снижен.
Адипозо-генитальную дистрофию необходимо дифференцировать с другими формами аменореи центрального генеза – в первую очередь с синдромом Лоренса-Муна-Бидля, посткастрационным синдромом и алиментарным ожирением.
Синдром Лоренса-Муна-Бидля
Синдром Лоренса-Муна-Бидля является наследственным заболеванием, передающимся по аутосомно-рецессивному типу. При сходности клинических признаков заболеваний для последнего характерны резкая умственная отсталость, а также пороки развития (полидактилия, пигментный ретинит и др.).
При дифференциальной диагностике посткастрационного синдрома и адипозо-генитальной дистрофии важнейшее значение имеет тщательное изучение анамнестических данных и результатов гормональных исследований. В частности, в первом случае заболевание развивается после одномоментного выключения ранее функционировавших яичников (И. А. Мануйлова, 1972), обнаруживается повышение экскреции гонадотропных гормонов, особенно ФСГ, и снижение экскреции эстро-генных гормонов.
При алиментарном ожирении экскреция гонадотропных гормонов оказывается в пределах нормы или несколько снижена.
Лечение адипозо-генитальной дистрофии следует начинать с исследований, позволяющих исключить или установить наличие опухоли. В последнем случае необходимо хирургическое лечение, после чего показаны комплексная терапия, направленная на нормализацию массы тела, и гормональные препараты.
С целью снижения массы тела необходимо ограничить количество жиров, углеводов, жидкости и поваренной соли, показана лечебная физкультура. Кроме того, рекомендуется назначать тиреоидин по 0,05–0,20 г в сутки в течение 4-5 дней с перерывами 2–3 дня.
При гипогонадизме применяют гонадотропные гормоны (хориогонин по 500 ME ежедневно в течение 2–4 дней с перерывами на 20– 30 дней), затем вводят эстрогенные гормоны (микрофоллин по 0,01 мг 2 раза в день или фолликулин по 5 тыс.– 10 тыс. ЕД ежедневно в течение 20 дней). Если указанная терапия спустя несколько месяцев привела к развитию вторичных половых признаков и увеличению матки, можно назначать циклическую терапию эстрогенами и прогестероном (Е. И. Кватер, 1967).
Синдром Киари-Фроммеля характеризуется персистирующей галактореей, аменореей и прогрессирующей гипотрофией половых органов. Это заболевание вначале считалось осложнением послеродового периода, позднее аналогичная клиническая картина была описана и у нерожавших женщин после психических травм, в результате опухоли гипоталамо-гипофизарной области, после длительного приема гормональных контрацептивных средств (И. В. Скородумова,1970; Gambell и соавт., 1971). Этиология и патогенез синдрома Киари–Фроммеля до настоящего времени не уточнены. В основе заболевания лежит повреждение центров гипоталамуса, регулирующих биосинтез пролактинтормозящего релизинг-фактора (ЛТГ– IF), в результате чего происходит увеличение секреции ЛТГ. В свою очередь длительное выделение ЛТГ угнетает продукцию ФСГ, что приводит к снижению эстрогенной секреции яичников и аменорее.
Наряду с гинекологическими расстройствами при синдроме Киари-Фроммеля часто бывают нарушения углеводного и липидного обмена, ожирение, неустойчивость артериального давления, психические расстройства.
Диагноз этого заболевания обычно несложен. Гормональные исследования свидетельствуют о резком уменьшении экскреции ФСГ и эстрогенных гормонов при нормальной экскреции 17-кетостероидов.
При опухолевом процессе показано хирургическое или рентгенологическое лечение. В остальных случаях терапия должна быть направлена на подавление лактации гормональными препаратами. Хороший эффект описан также при применении препаратов ФСГ – гонадотропина сывороточного по 500 ЕД в течение 10-20 дней. Из физических методов рекомендуется эндоназальный электрофорез тиамина (В. И. Бодяжина и соавт., 1972) в течение 30 дней, а также гальванический воротник (2-3 курса в год).
Аменорея может возникать при гипофункции всей передней доли гипофиза, продуцирующей кроме гонадотропных гормонов соматотропный (СТГ), адренокортикотропный (АКТГ) и тиреотропный (ТТГ) гормоны (пангипопитуитаризм). Кроме того, встречается аменорея, обусловленная выпадением только гонадотропной секреции при сохранившейся продукции других гипофизарных гормонов. Нарушение менструальной функции может происходить и при гиперсекреции одного или нескольких гормонов гипофиза – СТГ, АКТГ, ТТГ.
В зависимости от времени повреждения гипофиза такая аменорея может быть первичной (при врожденном заболевании или в детском возрасте) или вторичной (в случаях развития болезни в зрелом возрасте).
Гипофункция передней доли гипофиза может проявляться в виде гипофизарного нанизма, характеризующегося задержкой роста, часто бывает врожденной и легко диагностируется с детства. При этом преобладает дефицит СТГ, хотя продукция остальных гормонов передней доли также резко снижена. Лечение гипофизарного нанизма относится к компетенции эндокринолога и должно быть направлено в первую очередь на увеличение роста больной, а не на создание менструального цикла, Эстрогенные гормоны в таких случаях можно применять крайне осторожно, так как они ускоряют закрытие эпифизарных хрящей, что приводит к окончательной остановке роста.
Синдром Шихана
У взрослых гипопитуитаризм с вторичной аменореей известен как синдром Шихана, развивающийся после родов или абортов, осложнившихся массивной кровопотерей или сепсисом. Непосредственной причиной заболевания являются тромбозы, спазмы или эмболии портальных сосудов гипофиза с последующим его некрозом. При некрозе железы возникает клиническая картина синдрома Шихана. По данным К. Н. Жмакина (1976), у женщин с развившимся гипопитуитаризмом после патологических родов отмечается неблагоприятный преморбидный фон – недоразвитие гипоталамо-гипофизарной системы, позднее наступление регул и нарушение менструального цикла, а также патология настоящей и предшествующей беременности.
В зависимости от того, какая часть гипофизарной ткани некротизирована, признаки заболевания могут быть явными или стертыми. Наиболее ранним признаком заболевания является отсутствие лактации или раннее ее исчезновение. Менструации или не появляются (вторичная аменорея), или скудные и нерегулярные. Нарастает слабость, адинамия, потеря массы тела. Спустя несколько месяцев отмечаются гипотрофические изменения половых органов, выпадение волос в подмышечных впадинах и на, лобке, а иногда и на голове. Эндокринологические исследования показывают резкое снижение экскреции эстрогенов, ЛГ и ФСГ. В вагинальных мазках появляются базальные клетки, симптом зрачка и феномен папоротника отсутствуют. В более поздней фазе заболевания выявляются нарушения других желез внутренней секреции, зависимых от гипофизарной стимуляции. Так, уменьшение секреции АКТГ вызывает гипофункцию коры надпочечников, что проявляется повышенной утомляемостью, гипотонией, снижением экскреции 17-КС, отрицательной пробой с АКТГ. Уменьшение продукции ТТГ вызывает гипотиреоз, клинически выражающийся в апатии, вялости, сонливости. Снижается основной обмен и накопление радиоактивного йода в щитовидной железе.
При стертой форме синдрома Шихана все описанные признаки выражены слабее. Синдром Шихана необходимо дифференцировать с болезнью Симмондса (гипофизарная кахексия), встречающейся очень редко и обусловленной чаще всего опухолью гипофиза или повреждением центрального гипоталамуса. Заболевание характеризуется прогрессирующим истощением, упадком сил, старческим видом больной.
Лечение синдрома Шихана следует проводить с момента появления первых признаков заболевания, сочетая заместительную гормональную терапию с полноценным питанием, содержащим достаточное количество витаминов и поваренной соли. Для восстановления функции половых желез рекомендуется одна из схем циклической терапии эстрогенными и гестагенными гормонами (например: этинилэстрадиол по 0,05 мг ежедневно в течение 20 дней, затем по 30 мг прегнина ежедневно в течение 7 дней). Такая терапия, проводимая 3–4 мес в год, улучшает трофику половых органов, хотя обычно овуляторный цикл не восстанавливается. При надпочечниковой недостаточности назначают кортикостероидные гормоны (кортизон по 12,5–20 мг ежедневно в течение 20 дней), при гипотиреозе – одновременно с кортизоном тиреоидин начиная с небольших доз: 0,015 г 2 раза в день с постепенным повышением до 0,05 г 2 раза в день.
Несмотря на то что функция передней доли гипофиза при синдроме Шихана не восстанавливается, правильно применяемая заместительная терапия приводит к восстановлению нормального самочувствия больных.
Другие заболевания, связанные с аменореей
Гипофизарный евнухоидизм, возникающий во время полового созревания, характеризуется выпадением гонадотропной функции гипофиза с сохранением остальных его гормонов. При этом отмечается первичная аменорея, сочетающаяся с недоразвитием половых органов и евнухоидными пропорциями тела. Заболевание обычно бывает после инфекционных заболеваний или черепно-мозговых травм.
Результаты лабораторных исследований свидетельствуют о значительном снижении экскреции ФСГ и ЛГ, а также эстрогенов и прегнандиола при нормальных показателях 17-КС и основного обмена. Проба с эстрогенами обычно положительная, проба с ФСГ также положительна, что подтверждает гипофизарный генез заболевания.
Лечение сводится к терапии полового инфантилизма, для чего рекомендуется сочетание гонадотропных и половых гормонов. Терапию начинают с эстрогенных гормонов – фолликулина по 5-10 тыс. ЕД внутримышечно ежедневно или синэстрола по 1 мг в день per os в течение месяца. Можно применять циклическую терапию по Кватеру на протяжении 3–4 мес. При положительном результате терапии половыми гормонами (увеличение матки, рост грудных желез) циклическую терапию можно чередовать с введением гонадотропинов.
При умеренном угнетении гонадотропной функции гипофиза можно рекомендовать лечение синтетическими прогестинами типа инфекундина в течение 2–3 мес (по 1 таблетке в день в течение 21 дня с перерывом 7 дней). Этот метод основан на том, что введенные половые стероиды временно выключают функцию гипофиза и после такого «отдыха» деятельность последнего активизируется (эффект отдачи).
Аменорея, обусловленная гиперпродукцией одного из гормонов передней доли гипофиза, может быть при акромегалии и гигантизме, что связано с гиперпродукцией СТГ. Заболевание возникает при опухоли передней доли гипофиза, реже – при воспалительных поражениях или травмах.
Патогенез гигантизма и акромегалии сходен – обе патологии связаны с резким повышением секреции СТГ, а аменорея объясняется антагонизмом между гормоном роста и гонадотропными гормонами, а также снижением секреции ФСГ. Если заболевание начинается в пубертатный период, до окостенения эпифизарных зон, то у больных отмечается пропорциональное увеличение роста. В таком случае аменорея бывает как первичной, так и вторичной. При развитии заболевания после 20 лет возникает акромегалия, аменорея всегда вторичная.
Клиника заболевания весьма характерна, поэтому диагностика чаще всего не вызывает затруднений. Прежде всего внимание обращается на внешний вид больных – чрезмерный рост при гигантизме, резкое изменение внешности больной при акромегалии. При последней характерен диспропорциональный рост костей и некоторых органов: кости черепа утолщены, резко увеличена нижняя челюсть и надбровные дуги, увеличен в размерах нос, язык и уши, размеры внутренних органов также увеличены. Одним из ранних признаков заболеваний следует считать утолщение костей кисти, стоп, нарушение прикуса, а также жалобы на головную боль, слабость, легкую утомляемость.
Большое значение для правильной диагностики имеет рентгенологическое обследование черепа, показывающее увеличение размера турецкого седла, а в случае опухоли – деструкцию его стенок. Достаточно диагностичным признаком акромегалии является сужение полей зрения с височных сторон (битемпоральная гемианопсия).
Лабораторные исследования свидетельствуют о снижении экскреции эстрогенных гормонов, 17-КС, у длительно болеющих женщин мазки с большим количеством базальных клеток.
Акромегалию и гигантизм следует дифференцировать с наследственным гигантизмом (синдром Марфана), который встречается редко. Этот синдром наследственного генеза, высокий рост сочетается с пороками сердечно-сосудистой системы, вывихом хрусталика; размеры турецкого седла в пределах нормы и отсутствуют офтальмологические изменения.
Лечение проводится в эндокринологических стационарах. Гормональная терапия включает эстрогенные препараты (по 20–30 мг/сут в течение 5–6 нед), которые останавливают рост. Следует помнить, что такие большие дозы препарата по принципу обратных связей могут блокировать гонадотропную функцию гипофиза. Поэтому большие дозы эстрогенов следует рекомендовать женщинам пожилого или зрелого возраста. Более рациональна циклическая терапия по Кватеру в течение 6–10 циклов, с перерывами по 5-7 дней.
При болезни Иценко-Кушинга (гиперпродукция АКТГ), обусловленной поражением гипоталамо-гипофизарной области и вызванной гиперкортицизмом, также отмечается аменорея.
Болезнь Иценко-Кушинга встречается в возрасте 20–40 лет, часто после патологических родов. Сопровождается значительным ожирением (преимущественно на лице и туловище), вторичной аменореей, а также гипертонией, головной болью, часто – гипертрихозом. При лабораторных исследованиях устанавливается нормальный уровень 17-КС и эстрогенов. Пробы с АКТГ или с дексаметазоном (преднизолоном) положительны.
Кольпоцитологические исследования свидетельствуют о наличии эстрогенной стимуляции (индекс кариопикноза в пределах 40–60%), а симптомы зрачка и папоротника достаточно выражены в течение длительного времени.
При дифференциальной диагностике данного заболевания необходимо исключить опухоль коры надпочечника и первичный гиперкортицизм (синдром Иценко-Кушинга), что легко сделать, проанализировав результаты клинико-лабораторных исследований: в последнем случае отмечается резкое увеличение экскреции 17-КС и 17-ОКС, проба с дексаметазоном отрицательна.
Лечение болезни Иценко–Кушинга проводится в эндокринологических стационарах с использованием рентгенооблучения гипоталамо-гипофизарной области. Из гормональных препаратов можно рекомендовать синтетические прогестины (инфекундин, бисекурин) по 1 таблетке в день в течение 21 дня с 7-дневным перерывом на протяжении 4-5 мес. Гормональную терапию сочетают с диетой, направленной на уменьшение ожирения.
К аменорее периферического генеза прежде всего относится яичниковая, которая встречается в половине всех случаев (К. М. Жмакин, 1966), маточная аменорея, вызванная дисфункцией периферических эндокринных органов (коры надпочечников, щитовидной железы).
Яичниковая аменорея возникает при отсутствии гормональной функции яичников, в то время как функция гипофиза и гипоталамуса сохранена. При врожденном повреждении яичников, чаще всего генетически обусловленном, а также до наступления пубертации аменорея первичная, нарушения яичников в более старшем возрасте вызывают вторичную аменорею.
Врожденная патология яичников, связанная с дефектом ткани или с их аплазией, обусловлена хромосомными аномалиями. Как известно, у человека 46 хромосом, из них 44 соматические, а 2 – половые. От последних зависит развитие организма по женскому или мужскому типу. Соматические клетки женского организма содержат две половые хромосомы XX, а мужского – XY.
При отсутствии одной из половых хромосом (ХО), а также при наличии добавочных половых хромосом (XXX) или же при мозаицизме, когда часть клеток содержит нормальный набор их, а часть – патологический, возникают нарушения полового развития и первичная аменорея. Часто эта патология сочетается с соматическими нарушениями и изменениями психики.
Важным диагностическим критерием изменения количества половых хромосом является исследование полового хроматина. Так, при наличии двух Х-хромосом в клетке одна из них находится в неактивном спирализованном состоянии и образует в ядре клетки женского организма тельце полового хроматина. Разработан простой и быстрый метод определения полового хроматина в мазках слизистой полости рта с окраской препаратов ацетоорсеином. По количеству телец X-хроматина можно судить о количестве Х-хромосом: число Х-хромосом всегда на единицу больше числа телец полового хроматина.
Дисгенезия гонад чаще всего проявляется в виде синдрома Шерешевского-Тернера, реже – в чистой и смешанной форме.
Синдром Шерешевского–Тернера, по данным Е. Ф. Давиденковой и И. С. Либерман (1975), встречается в 1-2 случаях на 3000 новорожденных девочек, по другим данным – гораздо чаще (в 2-4 случаях на 1000 новорожденных девочек); основной причиной заболевания является моносомия X.
Признаки заболевания часто проявляются с рождения: дети отличаются малым ростом и массой тела, у них бочкообразная грудная клетка, короткая и широкая шея, высокое верхнее нёбо, низкое расположение ушей. Встречаются множественные дефекты развития внутренних органов. У взрослых рост обычно не превышает 140 см. Резко выражены признаки полового инфантилизма – вторичные половые признаки и молочные железы отсутствуют, влагалище и матка недоразвиты. При лабораторных методах исследования установлены отсутствие полового хроматина, очень низкая экскреция эстрогенов, атрофический. тип влагалищного мазка с преобладанием базальных клеток и значительное повышение содержания в моче гонадотропных гормонов. В случаях мозаицизма с кариотипом X0/XX, X0/XY, X0/XXX половой хроматин может присутствовать в 3-10% клеток.
«Чистая» форма дисгенезии гонад представляет собой синдром, выражающийся в резком инфантилизме без соматических аномалий, присущих синдрому Шерешевского-Тернера. Заболевание встречается очень редко. Характерен женский фенотип, тогда как кариотип чаще всего по мужскому типу – XY, встречается мозаицизм XY/XX. Половой хроматин у таких больных отрицательный или резко сниженный, экскреция гонадотропных и половых гормонов такая же, как при синдроме Шерешевского-Тернера.
«Смешанная» форма дисгенезии гонад, также встречающаяся очень редко, характеризуется интерсексуальным строением наружных половых органов, наличием недоразвитых матки и влагалища. На месте яичников с одной стороны – рудиментарный яичник, а с другой – яичко. Часто у таких больных развиваются опухоли гонад. Половой хроматин отрицательный или значительно сниженный, так как кариотип X0/XY или XY, экскреция эстрогенов резко снижена, 17-КС повышена.
Лечение дисгенезии гонад представляет собой трудную задачу и зависит от возраста больной и формы заболевания. До полового созревания терапия должна быть направлена на увеличение роста больной (при синдроме Шерешевского-Тернера), у взрослых – на развитие вторичных половых признаков, для чего рекомендуются эстро-генные гормоны (микрофоллин по 0,05 мг в день, 20 дней с 10-дневным перерывом; курс лечения 6–8 мес). После появления менструаль-ноподобного кровотечения периодически назначается циклическая терапия по Кватеру (И. С. Розовский, 1973). Такое лечение не приводит к ликвидации заболевания, но вызывает развитие вторичных половых признаков. Так как при дисгенезии гонад приходится назначать длительные курсы гормональной терапии, важно пользоваться минимальными, «поддерживающими» дозами препаратов. Хорошее действие оказывают гормоны пролонгированного действия – стерильные таблетизированные препараты для подсадки в жировую клетчатку (эстрадиол или диэтилстильбэстрол), которые медленно рассасываются, оказывая свое действие в течение 40-80 дней.
Гипогормональная яичниковая аменорея (не связанная с генетическими аномалиями) может быть обусловлена повреждением ткани яичника в детстве или даже внутриутробно (хроническая интоксикация матери, инфекционные заболевания детского возраста и т. д.). В таком случае в период полового созревания наряду с отсутствием менструаций отмечаются соматические нарушения (евнухоидные пропорции тела, отсутствие вторичных половых признаков). Матка у таких больных гипопластична, влагалище узкое, большие и малые половые губы недоразвиты.
При лабораторных исследованиях выявляется низкое содержание эстрогенных гормонов и высокое – гонадотропных, что обусловлено отсутствием тормозящего влияния эстрогенов на гипофиз. Гормональная проба с ФСГ отрицательная, с эстрогенами – положительная. Дифференциальная диагностика проводится с гипофизарным евнухоидизмом, для которого характерна сниженная экскреция гонадотропных гормонов и положительная проба с ФСГ.
Патология яичников, появившаяся после полового созревания, может развиться в результате перенесенных заболеваний или хронических интоксикаций, опухолей яичника, склерокистозной дегенерации. В этих случаях аменорея носит вторичный характер, а менструальная функция угасает постепенно. Возникающая гормональная недостаточность зависит от степени повреждения яичниковой ткани. Обычно у таких больных вторичные половые признаки развиты нормально, наружные половые органы также в норме или с легкой гипотрофией. Однако при длительной гипофункции яичников отмечаются признаки гипотрофии половых органов и гипоплазия молочных желез. В тяжелых случаях матка атрофируется. При гипофункции яичников отмечаются вазомоторные и нервные расстройства, обычно сопровождающие климакс,– приливы, головокружение, озноб, сердцебиение и т. д.
При гипогормональной аменорее, развившейся в детском возрасте, лечение следует начинать до окончания периода полового созревания, рекомендуя в таких случаях эстрогенные гормоны, которые стимулируют развитие гениталий и грудных желез. Проводят не менее 3–4 циклов эстрогенной терапии по 10 тыс. ЕД фолликулина или эстрадиола в день в течение 20 дней с последующими 10-дневными перерывами. После соответствующего контроля, увеличения размера матки и грудных желез можно назначать циклическую терапию эстрогенами и прогестероном по Кватеру или другой вариант терапии, построенный на минимально эффективных дозах гормонов. Лечение продолжается в течение 1–2 лет курсами по 3–4 мес с перерывами между курсами 4–6 мес.
Гормональную терапию следует сочетать с физическими методами лечения, диетой (при ожирении) и возможным устранением факторов, оказывающих вредное влияние на организм.
В случаях, когда заболевание развилось после полового созревания и носит более легкий характер, к циклической гормональной терапии можно приступить без предварительной эстрогенной подготовки. Лечение аменореи яичникового генеза гонадотропными гормонами весьма дискутабельно, так как при этой патологии отмечается повышенная их секреция.
Гипергормональная яичниковая аменорея встречается редко и связана с длительной персистенцией фолликула, причем десквамации эндометрия не наступает. При этой патологии отсутствуют какие-либо изменения в половом или соматическом развитии женщин. При лабораторном исследовании выявляются высокое количество эстрогенов, постоянно выраженный феномен зрачка (+ + + ) и папоротника, преобладание поверхностных клеток в мазке с высокими показателями индексов кариопикноза и эозинофилии. При этой форме аменореи назначают прогестерон по 5–10 мг в течение 3–5 дней в месяц.
Маточная аменорея, по М. П. Кузнецовой (1976), встречается примерно в Уз случаев, характеризуется нормальной деятельностью системы гипоталамус – гипофиз – яичники при первичном поражении эндометрия в результате воспалительного процесса, травматизации его при родах и аборте, внутриматочного введения йода и т. д. Если нарушение эндометрия произошло до наступления полового созревания, наступает первичная аменорея, если после него,– развивается вторичная аменорея. При маточной аменорее нарушается рецепторный аппарат матки, вследствие чего не бывает нормальной реакции на гормональную стимуляцию.
Для яичниковой аменореи характерно отсутствие менструаций при функционирующих яичниках. У таких больных нет нарушений полового и соматического развития. Клинико-лабораторные методы исследования свидетельствуют о двухфазном цикле: экскреция эстрогенов и прегнандиола имеет характерные колебания, базальная температура двухфазна. Комбинированная проба с эстрогенами и прогестероном при маточной аменорее всегда отрицательна.
Маточная аменорея может возникать вследствие атрезии внутреннего зева, когда менструальная кровь из полости матки через трубы попадает в брюшную полость.
Хотя при маточной форме аменореи функция системы гипоталамус – гипофиз – яичники сохранена, в результате длительного течения заболевания, связанного с поражением эндометрия инфекционным процессом, возникает вторичная недостаточность яичника и гипофиза.
Важное значение в диагностике маточной формы аменореи имеет исследование соскоба эндометрия, позволяющее установить наличие специфического (туберкулезного) эндометрита, а также состояние стенки матки.
Лечение зависит от причины аменореи: при туберкулезном эндометрите рекомендуется специфическая терапия (Р. И. Малыхина, 1970). Во всех случаях показано выскабливание, позволяющее удалить неполноценную слизистую матки. Имеются данные о хорошем результате после пересадки эндометрия или плодных оболочек в полость матки.
При образовании синехий в полости матки рекомендуется местное введение эстрогенов в виде таблеток (Е. И. Кватер, 1967).
Кроме описанных форм аменореи периферического генеза, встречаются аменореи, вызванные первичным нарушением функции некоторых эндокринных желез, в первую очередь коры надпочечников и щитовидной железы.
При патологии коры надпочечников (гиперплазии и опухоли) возникает значительная вирилизация организма женщины. Больные с этой патологией нуждаются в лечении в эндокринологическом стационаре. Нормализация функции коры надпочечника приводит к восстановлению менструального цикла.
Часто гипофункция щитовидной железы, а также тиреотоксикоз приводят к стойким аменореям. После лечения основного заболевания менструальный цикл у таких больных нормализуется.